脂肪间充质干细胞对兔扩张皮肤血管增殖影响的实验研究
2015-12-02张泽敏姚永明吴彩风牛常英谭慎兴唐胜建杨彪炳
张泽敏,姚永明,阎 贺,吴彩风,牛常英,谭慎兴,唐胜建,杨彪炳
0 引 言
扩张皮肤移植是整形以及修复重建外科领域中常用的一种技术手段,但对于大面积皮肤缺损的患者,仅靠传统过度机械扩张的方法来获取大量皮肤组织易导致其缺血坏死。因此,如何更有效地提高扩张皮肤中毛细血管的数量及其成活率显得尤为重要。脂肪间充质干细胞(adipose-derived stem cells,ADSCs)是从脂肪组织分离出来的多能干细胞,经诱导后,可以向骨、软骨、脂肪等间充质细胞甚至上皮细胞分化[1]。本实验通过注射ADSCs使扩张皮肤中CD31和血管内皮生长因子(vascular endothelial growth factor,VEGF)表达量增加,从而提高了扩张皮肤的血管化程度和皮瓣成活率,为临床实际应用提供了一定的实验依据。
1 材料与方法
1.1 实验材料 健康清洁型3月龄新西兰大白兔,实验动物合格证号:SCXK(鲁)20120005,体重2~2.5 kg,购自潍坊医学院动物中心,饲养温度控制在20~25℃,湿度约50%,DMEM培养基(低糖)(美国HyClone有限公司);胎牛血清(美国HyClone有限公司);CK19、CD31、VEGF、鼠抗兔单克隆抗体、羊抗鼠IgG、Elisa试剂盒(北京博奥森生物技术有限公司);SW-CJ-1F型超净工作台(中国);Heraews二氧化碳培养箱(德国);DMIRE2型全自动倒置相差显微镜(Leica,德国);KA-1000型低速离心机(郑州南北仪器设备公司);30mL皮肤软组织扩张器(上海威宁整形制品有限公司)。
1.2 方法
1.2.1 ADSCs的分离、培养、传代以及鉴定 在无菌条件下取兔肾周新鲜脂肪,放置于盛有PBS缓冲液的无菌培养皿中,用PBS缓冲液反复冲洗,剔除肉眼可见的小血管、包膜以及多余组织,剪成糊状,用0.1%Ⅰ型胶原酶消化,经200目筛网过滤后,加入完全培养基(含10%FBS的DMEM低糖培养基)终止消化,室温下(离心半径8 cm,1200 r/min)离心10 min,弃上清,留贴壁细胞;用低糖DMEM培养液重悬并接种至培养瓶中,于培养箱中(37℃、5%CO2)培养,观察细胞生长及形态特征。用免疫荧光细胞染色检测 ADSCs表面特异性标记物 CD34、CD44、CD29及CD106的表达情况。
1.2.2 扩张模型的建立 将20只兔随机数字表法分为实验组和对照组,每组10只。用3%戊巴比妥钠(1.0mL/kg)经耳缘静脉注射麻醉大白兔,取仰卧位,术区常规备皮、消毒、铺巾。于兔脊柱左侧2 cm肋骨上设计一圆形扩张区域,垂直于脊柱方向切长约2 cm的切口,用血管钳充分钝性剥离至浅筋膜,在浅筋膜深层剥出一腔隙,实验组和对照组于腔隙内均置入一30 mL圆形硅橡胶软组织皮肤扩张器(植入之前检查扩张器完整性),彻底止血。检查完毕后,并向扩张囊内注入20 mL等渗盐水,使之充盈,缝合皮肤切口。术后即刻和术后(1次/d,连续3 d)肌肉注射青霉素。将第3代ADSCs经胰酶消化、分离,用无血清DMEM配制成浓度为5×106个/mL的细胞悬液,于术后在实验组扩张皮下(真皮层)多点均匀注射ADSCs悬液1 mL,同法对照组仅注射无血清DMEM培养基1 mL。1周后伤口愈合拆线并开始注水,实验组和对照组均每3天注水1次(10 mL/次),重复上述步骤,4周完成注水(120 mL)。
1.2.3 扩张皮肤的组织学观察 4周扩张完成后,将扩张最明显的皮肤组织取下置于4%多聚甲醛中固定,行石蜡组织切片,HE染色,在200倍光镜下观察扩张皮肤组织中血管断面情况。
1.2.4 扩张皮肤组织中CD31的免疫组化检测及微血管密度检测 将石蜡切片脱蜡至水,30%的H2O2浸泡,热抗原修复,自然冷却后用10%羊血清孵育,加入一抗并4℃过夜;滴加生物素化标记的二抗,滴加SABC,DAB显色;三蒸水充终止显色,经苏木精轻度复染,PBS冲洗,用甘油封固。阴性对照用PBS代替一抗以排除假阳性。同时对CD31标记的微血管进行计数:先在低倍镜(10×10)随机找出10个微血管着色密度最高区域,在200倍镜下计数着棕色的微血管,取其平均数即为微血管密度[2]。
1.2.5 扩张皮肤组织中VEGF表达 取适量冻存的扩张皮肤组织标本,PBS洗净后用眼科剪将其剪碎,将液氮缓慢少量倒入并充分研磨组织使其匀浆,然后离心机(直径3cm,10000r/min)离心15min,弃匀浆留上清液,按照ELISA试剂盒说明书进行操作,终止后在酶标仪450 nm波长下处读取吸光值并输出浓度值来检测VEGF的表达量。
1.3 统计学分析 采用SPSS 17.0软件进行分析,定量资料以均数±标准差(±s)表示,所有数据经正态性和方差齐性检验,采用t检验的方法进行分析。以P≤0.05为差异具有统计学意义。
2 结 果
2.1 ADSCs形态学观察及免疫细胞化学鉴定 原代ADSCs呈圆形、透亮,24 h后贴壁细胞充分伸展。7 d左右,细胞形成鱼群样聚集,并形成集落,彼此融合呈长梭形分布。ADSCs特异性标志物 CD29、CD44阳性表达,而与造血系统有关的抗原CD106、CD34则呈阴性表达。见图1。
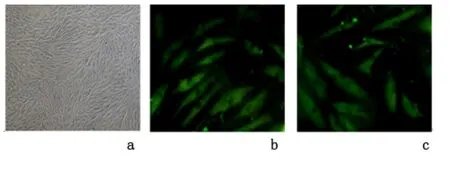
图1 兔脂肪间充质干细胞的形态学观察与鉴别Figure 1 Morphological observation and identification of the expanded white rabbit model and adipose derived mesenchymal stem cells
2.2 扩张皮肤的组织学检查 2组皮肤在扩张后胶原纤维均呈疏松排列,其中部分胶原纤维发生断裂;实验组中毛细血管断面较对照组明显增多。见图2。
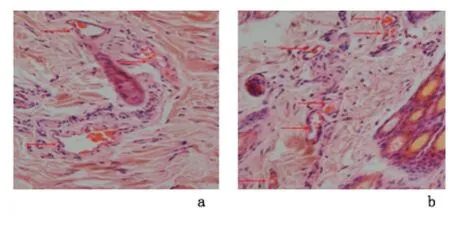
图2 兔扩张皮肤组织中毛细血管数量(HE×200)Figure 2 The number of capillaries in the skin tissue after expansion(HE×200)
2.3 扩张皮肤中CD31及微血管密度检测 免疫组化染色显示:实验组CD31表达量明显增加。实验组微血管密度[(10.70 ±1.89)个/视野]明显高于对照组[(5.20 ±1.48)个/视野],差异有统计学意义(P<0.05)。见图3。
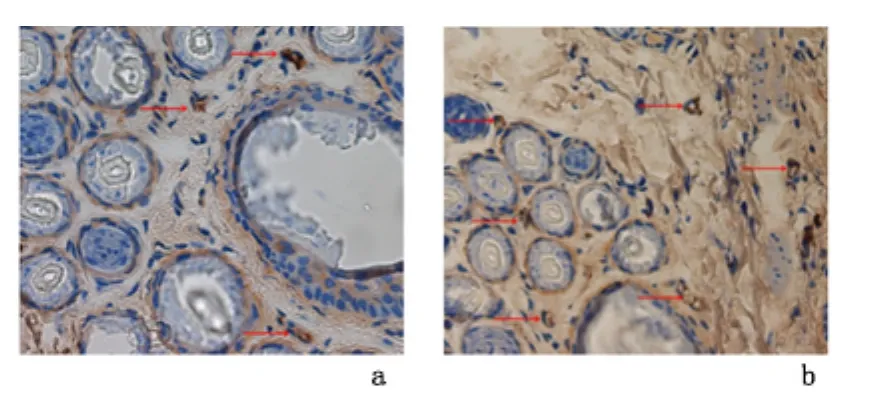
图3 兔扩张皮肤组织中CD31的表达(免疫组化染色 ×400)Figure 3 The expression of CD31 in skin tissue after expansion(IHC×400)
2.4 VEGF在兔扩张皮肤中的表达 ELISA测得的结果显示实验组扩张皮肤组织VEGF的表达[(300.27±23.40)pg/mL]明显高于对照组[(215.46 ±24.19)pg/mL],差异有统计学意义(P <0.05)。
3 讨 论
在扩张皮瓣移植过程中,皮瓣成活率主要取决于其中毛细血管数量以及血液供应情况。以往研究表明,毛细血管的新生主要依靠内皮祖细胞的分化、迁移以及血管内皮细胞的增殖、修复来完成[3-4]。另有学者发现,扩张皮瓣由于受到牵拉、缺氧等刺激使其毛细血管的数量明显高于普通皮瓣[5]。但Mc-Cann等[6]发现在扩张皮瓣面积大于原始面积50%时,扩张皮瓣中毛细血管的数量会小于普通皮瓣中的数量。上述结果说明不能单纯仅靠机械应力来获取大量额外的皮肤组织。众所周知,皮瓣的血管化程度与其移植后成活率密切相关,高度血管化的皮瓣移植可明显提高其成活率;低血管化的皮瓣移植其坏死率会明显增加。因此,寻找提高扩张皮肤中血管化的方法尤为重要。
近年来文献报道了许多提高皮肤血管化的方法,Lee等[7]研究发现罂粟碱能增加扩张皮肤血流量;栾杰等[8-9]也认为通过外用罂粟碱霜剂来作用于扩张皮肤,对皮瓣微血管可以起到一定扩张作用,并通过提高血流量来增加皮瓣的存活长度。另外,二甲基亚砜[10]、类固醇类、茶碱类药物[11]也被证实能够加速组织血管化。随着细胞分子生物学技术的快速发展,干细胞技术目前正以其无可比拟的优越性被应用于多种临床治疗及研究中[12-13],同其他干细胞相比,ADSCs具有来源丰富、易于获得、免疫原低[14]、无不良反应等优点,同时又避免了许多伦理问题,已逐步成发展成为种子细胞的新来源。
皮肤扩张模型是典型的牵拉、缺血损伤性模型。研究表明,干细胞在外界牵拉刺激和VEGF的共同作用下可促进其向内皮细胞转化[15-16]。在本次实验中免疫组化结果显示实验组血管内皮细胞特异性标记物CD31的表达量明显增加,且微血管密度也明显增大。这说明ADSCs在皮肤组织扩张过程中促进了血管内皮细胞的增殖,其参与毛细血管管壁结构的生成,微血管数量的增加进而保证了扩张皮肤更好的血液供应,更好地为周围新生组织提供更多的血液营养支持以利于扩张皮肤组织更好地生长;除此之外,脂肪干细胞还具有分泌功能[17-18],可分泌多种与创面的愈合、血管的重建密切相关的因子,如VEGF、碱性成纤维细胞生长因子等。在这些因子当中,VEGF被认为是与血管新生最密切相关的细胞因子,可促进内皮系细胞的存活和血管新生[19-20]。因此,VEGF可通过植入的ADSCs分泌从而在扩张皮肤再生过程发挥着一定的作用,通过刺激内皮细胞、促进内皮细胞增殖分化从而促进新生血管形成。但目前的实验结果尚不能定论脂肪干细胞在扩张皮肤中的转归以及其促进扩张皮肤中毛细血管增生的具体机制,它是否最终转化为了血管内皮细胞,仍有待进一步研究。
综上所述,脂肪干细胞是一种非常有前景的种子细胞[21],它在促进扩张皮肤组织血管化,降低扩张皮瓣的坏死率方面具有重要的意义,为今后的临床实际应用提供了实验依据。
[1] Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-228.
[2] Hollingsworth HC,Kohn EC,Steinberg SM,et al.Tumor angiogenesis inadvanced stage ovarian carcinoma[J].Am J Pathol,1995,147(1):33-41.
[3] Semenza GL.Vasculogenesis,angiogenesis,and arteriogenesis:mechanisms of blood vessel formation and remodeling[J].J Cell Biochem,2007,102(4):840-847.
[4] Asahara T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275(5302):964-966.
[5] Bozkurt A,Groger A,O'Dey D,et al.Retrospective analysis of tissue expansion in reconstruc-tive burn surgery:evaluation of complication rates[J].Burns,2008,34(8):1113-1118.
[6] McCann JJ,Mitchell GM,O'Brien BM,et al.CA.Comparative viability of expanded and unexpanded axial pattern skin flaps in pigs[J].Br J Plast Surg,1988,41(3):294-297.
[7] Lee P,Squier CA,Bardach J.Enhancement of tissue expansion by anticontractile agents[J].Plast Reconstr Surg,1985,76(4):604-610.
[8] 栾 杰,唐 勇,张旭辉,等.外用罂粟碱霜对扩张皮肤血流量及扩张皮瓣成活长度的影响[J].实用美容整形外科杂志,2002,13(4):209-212.
[9] 栾 杰,唐 勇,杨佩瑛,等.外用罂粟碱霜加速组织扩张的实验研究[J].中华整形外科杂志,2002,18(1):29-32.
[10] Raposio E,Santi PL.Topical application of DMSO as an adjunct to tissue expansion for breast reconstruction[J].Br J Plast Surg,1999,52(3):194-197.
[11] Matt BH,Squier CA,Kelly KM,et al.Enhancement of expansion of guinea pig skin by local delivery of an anticontractile agent using a new bilumen expander[J].Ann Plast Surg,1990,24(4):335-341.
[12] 彭 岱,王汉东.干细胞在脊髓损伤治疗现状与进展[J].医学研究生学报,2013,26(11):1226-1228.
[13] 耿艳霞,黎介寿,李秋荣.肠道干细胞与肠道损伤修复的研究进展[J].医学研究生学报,2013,26(2):181-185.
[14] 梁 爽,袁桂峰,钟毓娟,等.小鼠脂肪干细胞的免疫原性及移植安全性[J].中国组织工程研究,2012,16(1):47-50.
[15] Anderson RR.Polarized light examination and photography ofthe skin[J].Arch Dermatol,1991,127(7):1000-1005.
[16] Bai K,Huang Y,Jia X,et al.Endothelium oriented differentiation of bone marrow mesenchymal stem cells underchemical and mechanical stimulations[J].J Biomech,2010,43(6):1176-1181.
[17] Moon KM,Park YH,Lee JS,et al.The effect of secretory factors of adipose-derived stem cells on human keratinocytes[J].Int J Mol Sci,2012,13(1):1239-1257.
[18] Jung H,Kim HH,Lee DH,et al.Transforming growth factor-beta 1 in adipose derived stem cells conditioned medium is a dominant paracrine mediator determines hyaluronic acid and collagen expression profile[J].Cytotechnology,2011,63(1):57-66.
[19] Ferrara N,Alitalo K.Clinical applications of angiogenic growthfactors and their inhibitors[J].Nat Med,1999,5(12):1359-1364.
[20] Cheng X,Wang Z,Yang J,et al.Acidic fibroblast growth factor delivered intranasally induces neurogenesis and angiogenesis in rats after ischemic stroke[J].Neurol Res,2011,33(7):675-680.
[21] 陈 嵩,毛 钊.牙周组织工程中牙龈成纤维细胞的研究进展[J].医学研究生学报,2013,26(3):293-295.
