核酸染色剂SYBR-Gold染色特性分析
2015-06-05金磊
金 磊
(徐州医学院医学生物化学与分子生物学教学实验中心,江苏徐州221002)
核酸染色剂SYBR-Gold染色特性分析
金 磊
(徐州医学院医学生物化学与分子生物学教学实验中心,江苏徐州221002)
目的检测SYBR-Gold前染色与后染色的优缺点。方法采用前染色、后染色的方法使用SYBR-Gold对双链DNA进行染色检测,EB染色作为参照,琼脂糖凝胶电泳为检测手段,凝胶成像系统拍照观察。结果SYBRGold其前染色与后染色对于双链DNA检测能力均强于EB染色,但是SYBR-Gold预混凝胶前染色其分辨效果及DNA迁移速度受到DNA浓度的影响;SYBR-Gold预混样品的前染色方式对于目的基因的判读误差较大。结论SYBR-Gold不适合预混样品前染色,DNA样品浓度过大(大于250ng)不适合预混凝胶前染色,SYBR-Gold后染色是理想的染色方式。
SYBR-Gold;溴化乙锭;核酸染色剂;琼脂糖凝胶电泳
(Chin J Lab Diagn,2015,19:0194)
核酸染色在基因工程领域应用非常广泛,结合琼脂糖凝胶电泳可以分离、鉴定DNA片段大小,对于DNA浓度也可以根据荧光激发强度进行半定量[1]。目前,对于凝胶染色的核酸染色剂,溴化乙锭(Ethidium bromide、EB)仍然占据主导地位,EB可以结合双链DNA、单链DNA以及RNA,EB结合双链DNA后荧光强度激发比游离凝胶中的EB发出的荧光强度大20-25倍[2],具备优越的DNA检测能力,在琼脂糖凝胶及聚丙烯酰胺凝胶中可分别检测痕量的双链DNA。但是EB具有致突变性,对于环境安全有一定影响[3]。
随着对核酸染色剂研究的深入以及化学合成技术的发展,出现了一些经过改进的花青类核酸染色剂,相对于EB具有染色灵敏度高、环保、对核酸的结合具有选择性等特点。比如SYBR GreenⅠ结合双链DNA能力远强于单链DNA及RNA,因此可以作为实时定量PCR的核酸染色剂,SYBR-Gold可以结合双链DNA、单链DNA及RNA,在结合双链DNA后具有2个荧光激发峰,一个位于300nm处,另一个位于495nm处,且对于核酸的检测能力均高于EB及其他SYBR系列的染色剂[4]。而且安全、环保,已有文献报到SYBR Gold在Ames实验中没有发现至突变性[5]。但是SYBR-Gold试剂价格要远高于EB,为了降低使用成本,使用SYBRGold做前染色的优势报道越来越多[6],尤其是使用SYBR-Gold染色样品的前染色方式会极大的节约试剂的用量[7,8],而另有文献报道这种染色方式会使得DNA迁移速度发生滞后[4]。因此本文使用EB作为参照,使用后染色及前染色两种染色方式评估SYBR-Gold在检测双链DNA的灵敏度以及染色特点,给选择使用SYBR-Gold以及适合这种染色剂的染色方式提供参考。
1 材料与方法
1.1 质粒与菌株原核表达载体pXMCB-B2及菌种JM101为为本实验室保存
1.2 主要试剂PCR体系、分析级琼脂糖凝胶、质粒提取试剂盒购自Promega公司、凝胶纯化试剂盒购自生工(上海)生物工程有限公司、1kbDNA ladder、100bpDNA ladder、Gel loading Dye 6x购自NEB公司,SYBR-Gold in DMSO购自invitrogen公司;EB、DMSO购自Sigma公司,1xTBE缓冲液(final concentrations of 45mmol/L Tris-Boric Acid,2mmol/L EDTA PH:8.3)为实验室配置。
1.3 前染色及1%凝胶配置称取0.6g琼脂糖溶于60ml 1xTBE缓冲液中,使用65℃水浴加热待琼脂糖全部融化,量筒分别量取30ml凝胶共2份,分别加入SYBR-Gold(10000x)3μl、EB(0.5μg/ml)3μl混匀后分别灌至6x6cm胶槽中,然后放置于室温约1小时待其凝固。后染色凝胶配置同前染色,但是凝胶中不加染色剂。
1.4 后染色电泳结束后将不含染色剂凝胶放入1xTBE缓冲液的容器中,使凝胶完全侵入缓冲液,缓冲液中分别含SYBR-Gold:10000x、EB:0.5μg/ml,摇床低速染色40min。
1.5 电泳将无染色剂凝胶放入同一电泳槽,含染色剂凝胶使用单独电泳槽在同一条件下分别电泳。电压1.5V/cm2,时间60min。
1.6 目的基因的扩增与纯化使用实验室保存质粒为模板,使用特异性上游、下游引物扩增长度为711 bp的目的基因,PCR反应程序为94℃预变性2min、94℃变性1min、58℃退火1min、72℃延伸1min;变性、退火、延伸共计25个循环;最后72℃延伸5min。测序正确后使用凝胶纯化系统进行纯化。
1.7 PCR产物的浓度测定取2μl的PCR产物,使用Thermo公司的NanoDrop2000系统进行DNA浓度测定,然后将DNA稀释至25ng/μl冻存备用。
1.8 DNA ladder浓度与SYBR-Gold浓度稀释1kb DNA ladder按照每6μl 8ng、16ng、35ng、63ng、125 ng、250ng、500ng的浓度稀释配置备用;其中500ng从0.5kb到10kb每条带对应质量为42ng、42ng、36ng、48ng、125ng、33ng、42ng、50ng、42ng、42ng,其余浓度按照稀释倍数类推。SYBR-Gold按照1∶167、1∶333、1∶667、1∶1 000稀释于60%DMSO中,染色样品后SYBR-Gold被稀释6倍,其终浓度为:1∶1 000 1∶2 000 1∶4 000 1∶6 000。
2 结果
2.1 EB与SYBR-Gold预混凝胶前染色特性分析
如图A、B分别为EB与SYBR-Gold前染色,1-7上样量分别为:8ng、16ng、32ng、63ng、125ng、250ng、500ng电泳在同一条件下进行,电泳结束后立即拍照,我们发现:1、EB与SYBR-Gold对于双链DNA最小检测量能力与DNA片段大小相关,对于0.5kb的DNA片段EB最小检测量约为5ng(第4列),而SYBR-Gold最小检测量约为0.6ng(第7列),随着DNA片段的增大,两种染色剂的检测能力均有所增强,3-10kb的DNA片段EB的最小检测量约为0.6ng(第1列),而SYBR-Gold染色至第一列仍然较清晰,因此SYBR-Gold的前染色的最小检测量应小于0.6ng。2、EB染色较SYBR-Gold染色分辨效果好,SYBR-Gold前染色的分辨效果与DNA浓度相关,当DNA总浓度为250ng以上时(第6列),3-10kb的DNA条带不能分辨。3、SYBR-Gold染色当浓度为250ng以上时,3-10kb的DNA条带其迁移速度明显增加。因此SYBRGold预混凝胶前染色不适合检测浓度超过250ng的DNA品。

图1 A:EB前染色,B:SYBR-Gold前染色,1-7样品质量为:8 ng、16 ng、35 ng、63 ng、125 ng、250 ng、500 ng,从0.5 kb至10 kb相应DNA条带为0.5 kb、1 kb、1.5 kb、,2 kb、3 kb、4 kb、5 kb、6 kb、8 kb、10kb。
2.2 EB与SYBR-Gold后染色特性分析
凝胶后染色是电泳完毕后再进行单独染色,因此DNA条带在介质中移动不受染色剂干扰,对于目的基因判断更准确,DNA也不易产生弯曲、变形、拖尾等现象。后染色使用的样品DNA、上样量、电泳条件与前染色完全一致,电泳结束后将凝胶分别放入含有EB(0.5μg/ml)与SYBR-Gold(10000x)的1xTBE缓冲液中进行后染色,如图2,A为EB后染色,B为SYBR-Gold后染色。结果显示:后染色检测双链DNA的效果较前染色更有优势,EB后染色对于0.5kb的双链DNA片段最小检测量约为2.7ng(第3列),而3kb之后的双链DNA片段最小检测量至少为0.6ng(第1列),而SYBR-Gold后染色每条DNA条带都清晰可见,由此可见SYBRGold后染色对于双链DNA检测的灵敏度优于EB染色及SYBR-Gold前染色。
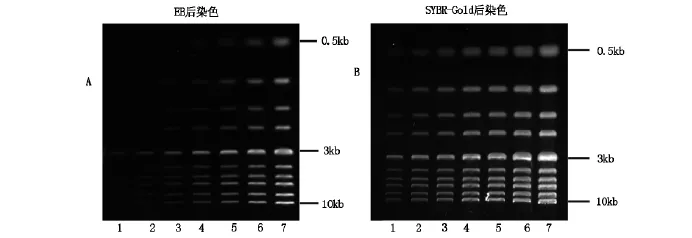
图2 A:EB后染色,B:SYBR-Gold后染色,1-7样品质量为:8 ng、16 ng、35 ng、63 ng、125 ng、250 ng、500 ng,从0.5 kb至10 kb相应DNA条带为0.5 kb、1 kb、1.5 kb、,2 kb、3 kb、4 kb、5 kb、6 kb、8 kb、10 kb。

图3 SYBR-Gold预混样品前染色,1-4 SYBR-Gold稀释倍数为1∶1000 1∶2000 1∶4000 1∶6000。
2.3 SYBR-Gold预混样品前染色特性分析
有报道称染样品法的前染色可以极大的节省染色剂的用量[7,8],SYBR-Gold是否适合此种染色方法,我们进行检测,如图3,1-4分别是将SYBR-Gold按照1∶1 000、1∶2 000、1∶4 000、1∶6 000的终浓度染色250ng的DNA样品,并在避光的环境中静止15分钟,然后进行电泳。我们发现随着SYBRGold浓度的稀释,不仅DNA条带的荧光强度发生衰减,而且DNA的迁移速度也逐渐增快。这种现象说明SYBR-Gold稀释浓度会影响DNA的迁移速度。另外有文献报道,SYBR-Gold预混样品前染色其迁移速度也会受到DNA浓度影响[9]。
2.4 SYBR-Gold预混样品对目的基因判断的影响
通过上述实验发现SYBR-Gold预混样品的染色方式中,其稀释浓度会影响DNA的迁移速度,这种现象对于使用分子量标准DNA来判断目的基因片段大小是否会发生显著影响,我们进一步检测,。如图4-A,1-8为按照比例稀释在DMSO中的SYBR-Gold同时染色目的基因(711bp)与分子量标准DNA(100bp DNA ladder,NEB),SYBR-Gold的终浓度为1∶1 000、1∶2 000、1∶4 000、1∶6 000,在避光环境中放置15分钟后电泳检测,我们发现不同浓度稀释的SYBR-Gold对目的基因的判断不尽相同,图中分子量标准DNA在0.5kb与1kb之间依次为0.6kb、0.7kb、0.8kb、0.9kb,相同目的基因样品(711bp),其大小在各浓度稀释的SYBRGold染色的情况下依次为:约1kb(1∶1 000)、约0.95kb(1∶2 000)、约0.85kb(1∶4 000)、约0.95 kb(1∶6 000)。图4-B为SYBR-Gold后染色作为参照。可见在每种SYBR-Gold浓度稀释情况下目的基因的判读与其实际大小均不符,最接近实际大小的0.85bp仍然误差约140bp(约20%),无法达到实验要求,因此我们认为SYBR-Gold不适合预混样品的前染色方式。
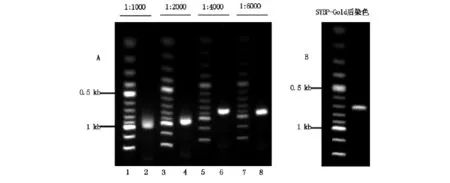
图4 A:SYBR-Gold预混样品前染色,SYBR-Gold稀释倍数为1∶1000(1、2)1∶2000(3、4)1∶4000(5、6)1∶6000(7、8),目的基因大小711 bp。B:SYBR-Gold后染色。
3 讨论
基于荧光信号为基础的核酸染色剂仍然是检测核酸的重要手段,通常结合凝胶电泳的方法来鉴定分析核酸片段大小,也可根据荧光强度对核酸浓度进行半定量,传统染色剂对于单链DNA的检测能力要弱很多,在一些实际工作中,比如以RNA为模板构建cDNA基因文库,EB对于核酸的检测能力往往不能满足需求,一些新型核酸染色剂的问世大大提高了核酸的检测能力,PicoGreen是一种很灵敏的双链DNA定量试剂,在荧光仪上可检测双链DNA的最低浓度为25pg/ml,检测精度比传统方法提高100倍,另外PicoGreen定量检测不会受到单链DNA及RNA的干扰[10]。一些新技术的建立也提高了核酸的检测能力,比如使用碱性品红在聚丙烯酰胺凝胶中可以检测10-20pg的DNA[11],竞争逆转录PCR结合SYBR-Gold染色可以对mRNA进行定量分析[12]。另外在凝胶成像系统中适当延长曝光时间也可以提高核酸的检测能力,因此,即便是相同的核酸染色剂,合理的使用不同的检测方法可以提高核酸的检测水平。在本文中,两种核酸染色剂使用后染色的方式对于双链DNA的检测能力均强于前染色。SYBR-Gold在这方面尤为明显,虽然SYBR-Gold在前染色方面易受到诸多因素的干扰,但是其优异的后染色能力、在Ames实验中无至突变性、环保、用量很少等优势使SYBR-Gold越来越多的被广大科研人员接受。
[1]Lee PY,Costumbrado J,Hsu CY,et al.Agarose gel electrophoresis for the separation of DNA fragments[J].J Vis Exp,2012,62:3791.
[2]Vardevanyan P.O,Antonyan A.P,The binding of ethidium bromide with DNA:interaction with single-and double-stranded structures[J].Experimental and molecular medicine,2003,6:527.
[3]Victoria L,Singer Timothy E.Lawlor,Stephen Yue.Comparison of SYBR Green I nucleic acid gel stain mutagenicity and ethidium bromide mutagenicity in the Salmonella/mammalian microsome reverse mutation assay(Ames test)[J].Mutation Research,1999,439:37.
[4]Rabiya S.Tuma,Matthew P.Beaudet,Xiaokui Jin,et al.Characterization of SYBR Gold Nucleic Acid Gel Stain:A Dye Optimized for Use with 300-nm Ultraviolet Transilluminators[J].Analytical Biochemistry,1999,439:278.
[5]Kirill I.Kirsanov,Ekaterina A.Lesovaya,Marianna G.Yakubovskaya,SYBR Gold and SYBR Green II are not mutagenic in the Ames test[J].Mutation Research,2010,699:1.
[6]Suenaga E,Nakamura H.Prestaining method as a useful tool for the agarose gel electrophoretic detection of polymerase chain reaction products with a fluorescent dye SYBR gold nucleic acid gel stain[J].Anal Sci,2005,6:619
[7]Huang Q,Baum L,Simple and Practical Staining of DNA with GelRed in Agarose Gel Electrophoresis[J].Clin Lab,2010,56:149.
[8]Robert K.and Ingeborg T.Prestaining of PCR products with SYBR Green for agarose gel electrophoresis:advantages and limitations[J].Clin Chem Lab Med,2011,49(6):1069.
[9]Huang Q,Fu WL,Comparative analysis of the DNA staining effi-ciencies of different fluorescent dyes in preparative agarose gel electrophoresis[J].Clin.Lab,2010,56:149.
[10]Li X,Wu Y,Zhang L,et al.Comparison of three common DNA concentration measurement methods[J].Anal Biochem,2014,451:18.
[11]Chen M1,Cong WT,Zhou X,et al.A method for sensitive staining of DNA in polyacrylamide gels using basic fuchsin[J].Bio-analysis,2013,12:1545.
[12]Oba R,Kudo Y,Sato N,et al.A new method of competitive reverse transcription polymerase chain reaction with SYBR Gold staining for quantitative analysis of mRNA[J].Electrophoresis,2006,14:2865
The Characterization of SYBR Gold nucleic acid dye
JIN Lei.(Experimental center for Medical Biochemistry and
Molecular Biology Teaching.Xuzhou Medical College,Xuzhou,Jiangsu221002,China)
ObjectiveIt is analyse two method for staining DNA fragments in agarosewith SYBR-Gold.MethodsIt used poststaining and prestaining to dye double strand DNA in agarose gel electrophoresis.The same way is used to stain DNA with EB as a control.And we analysed the results by the gel imaging system.ResultsWe found SYBR-Gold was much more sensitive than EB to detect double strand DNA.But the effect of resolution and the mobility of DNA fragments were affiliated to the concentration of the samples in precasting SYBR-Gold in gels.And it was low accurate in measuring the size of DNA fragments through the agarose gel with adding SYBR-Gold in loading buffer.ConclusionWe do not recommend that you stain the sample with SYBR-Gold before agarose gel electrophoresis.It is also not suitable to precast SYBR-Gold in gels when the concentration of samples is too high.However,the poststain with SYBR-Gold is an ideal method.
SYBR-Gold、EB、nucleic acid dye、agarose gel electrophoresis
R392.3
A
2014-08-16)
1007-4287(2015)02-0194-05
国家自然科学基金项目(81100852)
