固定化苯丙氨酸脱氨酶拆分D,L-苯丙氨酸制备D-苯丙氨酸
2015-05-05房月芹朱龙宝丁重阳周哲敏
房月芹,朱龙宝,黄 楠,周 丽,丁重阳,刘 颖,周哲敏,*
(1.江南大学环境与土木工程学院,江苏无锡 214122;(2.江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡 214122) (3.安徽工程大学生物化学工程学院,安徽芜湖 241000)
固定化苯丙氨酸脱氨酶拆分D,L-苯丙氨酸制备D-苯丙氨酸
房月芹1,朱龙宝2,3,黄 楠2,周 丽2,丁重阳2,刘 颖1,周哲敏2,*
(1.江南大学环境与土木工程学院,江苏无锡 214122;(2.江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡 214122) (3.安徽工程大学生物化学工程学院,安徽芜湖 241000)
为了建立新的D-苯丙氨酸生产工艺,对固定化苯丙氨酸解氨酶(PAL)拆分D,L-苯丙氨酸进行了研究。以介孔材料(MCM-41)为载体固定PAL,将其用于拆分消旋体D,L-苯丙氨酸制备高光学纯的D-苯丙氨酸。最佳的固定化条件是载酶量为50mg/g、壳聚糖浓度为0.1%(w/v)、戊二醛浓度为0.05%(v/v),固定化酶的活性达到最大,酶活保留达到92%,重复利用20次后,活性仍能保持85%。将制备的固定化酶应用于D,L-苯丙氨酸的拆分,反应24hL-苯丙氨酸转化率达到98%,D-苯丙氨酸的ee值达到96%,且连续拆分10个批次后固定化酶对L-苯丙氨酸的转化率仍保持在95%以上。因此,高效稳定的固定化PAL在拆分D,L-苯丙氨酸生产D-苯丙氨酸中具有良好的应用前景。
苯丙氨酸脱氨酶,介孔材料MCM-41,固定化,D,L-苯丙氨酸拆分
D-苯丙氨酸能增强人体免疫功能,具有出色的镇痛作用,常用做抗肿瘤药物、糖尿病治疗药物及HIV蛋白酶抑制剂的生产原料。目前通常采用不对称化学合成法[1-2]、氨基酰化酶法[3]、海因酶法[4]等方法制备。这些方法都有一定的局限性,其中不对称化学合成法采用的手性助剂来源有限,价格昂贵;氨基酰化酶法需要对底物进行乙酰化,工艺路线长;海因酶法反应步骤多,产物分离复杂。
PAL特异性催化L-苯丙氨酸分解为反式肉桂酸和氨[5],应用于合成芳香丙氨酸和治疗苯丙酮尿症[6]。在工业应用方面鲜有报道,仅黄建坡等采用固定化粘红酵母细胞法生产D-苯丙氨酸[7]。但由于在粘红酵母细胞内PAL的表达量较低,且固定化细胞在催化反应时底物和产物进出细胞会受到传质阻力,所以转化速率较低。本实验室前期已克隆了来源于粘红酵母的PAL基因,并在大肠杆菌中实现了高效表达,该酶热稳定性高,pH耐受性好,非常适用于工业应用[8]。
介孔二氧化硅如MCI-41由于具有大比表面积和孔径率,高机械强度、表面具有活性基团等优点而被广泛用作固定化材料[9-10]。MCM-41孔径在1~30nm,与自然界大部分酶的直径相近,酶能进入介孔材料孔道内[11-12]。由于酵母PAL的直径在10nm内[13],因而选择孔径为2~12nm的MCM-41作为载体,酶不仅能进入孔道内,而且孔径越小,比表面就越大,酶的装载量就越大。本文以介孔材料MCM-41为载体,采用了一种简单有效的吸附后交联方法[14]对PAL进行固定化。并用固定化酶对D,L-苯丙氨酸进行拆分制备D-苯丙氨酸,初步探索了D-苯丙氨酸生产的可行性。
1 材料与方法
1.1 材料与仪器
PAL为本实验室自制[8];介孔分子筛MCM-41、壳聚糖、戊二醛、D,L-苯丙氨酸、Bradford蛋白浓度测定液均为市售分析纯试剂。
大容量冷冻离心机 日本日立;超声波细胞破碎仪 日本索尼公司;HPLC 日本日立;培养箱和摇床 博迅实业有限公司
1.2 实验方法
1.2.1 PAL的固定化 在5mL蛋白浓度为0.5mg/mL的PAL溶液中(用0.05mol/L、pH8.5 Tris-HCl缓冲液配制),加入50mg介孔材料MCM-41,置于15℃的恒温震荡器(200r/min)吸附4h,所得固定化酶用缓冲液洗净后加入终浓度为0.1%(w/v)的壳聚糖溶液,持续搅拌2h并用缓冲液洗净后重悬于缓冲液中,最后以体积分数为0.05%(v/v)的戊二醛溶液于4℃下交联固定化酶1h[9-10]。
1.2.2 吸附量和酶活的测定 用Bradford法分别测定吸附前酶液中和吸附后上清中的蛋白浓度,蛋白量之差为固定化酶的吸附量。在反应体系中加入与游离酶等蛋白量的固定化酶按照文献[7]进行酶活测定。
酶活保留(%)=固定化酶酶活/游离酶酶活×100
相对酶活(%)=固定化酶酶活/固定化酶的最高酶活×100
1.2.3 固定化PAL的性质 在反应条件为45℃,pH8.5下对固定化酶的酶活进行20次重复测定,研究其操作稳定性。
1.2.4 固定化PAL拆分D,L-苯丙氨酸 将含有30mg PAL的固定化酶加入1L D,L-苯丙氨酸溶液中(D-苯丙氨酸和L-苯丙氨酸各50mmol/L,pH8.5),在45℃下搅拌反应,每隔3h取出0.1mL反应液,测定其中L-苯丙氨酸的含量,反应24h后结束转化过程。
1.2.5 转化率的测定 拆分反应中取出的反应液按照文献[15]测定其中D-苯丙氨酸和L-苯丙氨酸的含量,计算出L-苯丙氨酸的转化率。
转化率=(C0-Ci)/C0×100%
式中:Ci:第i次所取反应液中L-苯丙氨酸的浓度;C0:转化前D,L-苯丙氨酸溶液中L-苯丙氨酸的浓度。
式中:D表示D-phe的浓度;L表示L-phe的浓度。
2 结果与分析
2.1 MCM-41的载酶量
从图1可以看出,当载酶量为50mg/g时,固定化酶的相对酶活最高。载酶量对相对酶活的影响与介孔分子筛MCM-41的通道大小有关,当介孔材料MCM-41的孔道被酶分子所饱和时,固定化酶活性达到最大;当载酶量较小时,酶分子为了能够获得对载体孔道和表面的最大接触,会发生变形和伸展而导致构象变化,引起酶活损失[15];而当载酶量超过最适载量后,又会使通道内阻塞,底物难以进入通道,只能与载体表面所固定的酶分子反应,相对活力不增反降。

图1 载酶量对固定化酶相对酶活的影响Fig.1 Effect of loading amount on relative activity of immobilized enzyme
2.2 壳聚糖浓度对固定化酶的影响
由图2可知,当壳聚糖浓度为0.1%(w/v)时,固定化酶的相对酶活最高;随着壳聚糖浓度进一步升高,相对酶活开始下降。因为在壳聚糖浓度为0.1%(w/v)时,既能够保证酶分子不发生渗漏又不至于形成过于致密的网状层阻碍底物与产物的进出,固定化酶的酶活才能达到最高。

图2 壳聚糖浓度对固定化酶的影响Fig.2 Effect of chitosan concentration on relative activity of immobilized enzyme
2.3 戊二醛浓度对固定化酶的影响
由图3可知,在戊二醛浓度较低时,相对酶活随着戊二醛浓度的升高而升高,在戊二醛浓度为0.05%(v/v)时,相对酶活最高;此后,固定化酶的相对酶活随着戊二醛浓度升高而迅速降低。这是由于戊二醛的主要作用是交联壳聚糖层,在浓度较低时,不能形成稳定的壳聚糖网状结构,固定化酶不稳定有酶渗漏的情况发生[10],导致相对酶活较低;但是,过量的戊二醛又会过度交联酶分子,使酶活降低。因此,固定化PAL的最佳条件确定为:载酶量为50mg/g,壳聚糖溶液浓度为1%(w/v),戊二醛溶液浓度为0.05%(v/v)。

图3 戊二醛浓度对固定化酶的影响Fig.3 Effect of glutaraldehyde concentration on relative activity of immobilized enzyme
2.4 固定化PAL的性质
在工业生产中,固定化酶的操作稳定性高就能增加其在催化反应中的重复使用次数,是节约成本的重要条件[16]。图4显示的是固定化PAL的操作稳定性。在20次催化反应后固定化酶的酶活仅比初始酶活下降了15%,比Cui[17]等制备的固定化PAL有明显的提高。以MCM-41为载体,通过先吸附后交联制备的固定化PAL之所以能有较高的稳定性,可能是由MCM-41独特的有序介孔结构及壳聚糖与戊二醛交联所形成的坚固网状层决定的,有序介孔结构能保证酶分子的均匀分布而外层的网状层则有效地阻止酶分子的渗漏[9-10]。这些结果表明,本实验制备的固定化酶在性质上符合工业应用所需。

图4 固定化酶的操作稳定性Fig. 4 The operational stability of the immobilized enzyme
2.5 拆分反应的效率
将上述制备的固定化酶应用于拆分D,L-苯丙氨酸(D-苯丙氨酸和L-苯丙氨酸各0.05mol/L,pH8.5),结果如图5所示。可见,在反应的前12h L-苯丙氨酸的转化率迅速上升到78%;而此后拆分反应的转化速率越来越慢,反应24h后,转化率达到98%以上。转化率随时间变化的规律,可以由拆分反应中的产物抑制作用来解释。在反应前期,生成的反式肉桂酸的量很少,L-苯丙氨酸浓度高,反应速率大,L-苯丙氨酸的转化率迅速上升;随着底物中L-苯丙氨酸被大量地转化为反式肉桂酸,高浓度的反式肉桂酸严重抑制拆分反应的进行,从而导致转化12h后转化率增加的速率显著下降;直至反应24h,底物中L-苯丙氨酸几乎被转化完全,转化率到达98%以上,可视为拆分反应已经完成。所以,实验中将24h定为拆分反应的终点。

图5 固定化酶拆分反应的效率Fig. 5 The chiral resolution efficiency of the immobilized enzyme
2.6 底物浓度对拆分效率的影响
底物浓度不仅是判断反应效率的重要参数,同时还会影响拆分效率。表1显示的是不同D,L-苯丙氨酸浓度下的固定化酶拆分效率。由表可知,在浓度较低时,固定化酶将D,L-Phe中的L-Phe完全转化所需时间和转化效率不同,随着浓度的增加,拆分效率越来越高,在接近D,L-Phe饱和浓度[18]时,效率达到最高为每小时转化2.08mmol L-Phe。
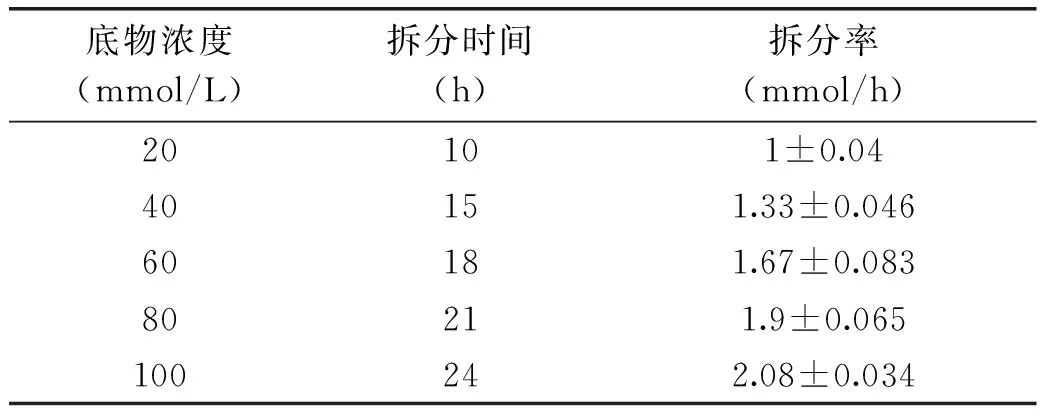
表1 不同底物浓度下的拆分效率Table 1 Effect of different concentration of D,L-Phe on the chiral resolution efficiency
从工业制备的规模和效率上综合考虑,高底物浓度下的拆分反应有利于节约成本,所以本实验选择100mmol/L的D,L-Phe进行反应。
2.7 拆分反应的批次稳定性
批次稳定性是衡量工艺是否可行的重要条件。图6显示的是固定化PAL拆分D,L-苯丙氨酸的批次稳定性。由图可知,固定化酶在连续进行10个批次拆分反应的过程中始终能够将L-苯丙氨酸的转化率保持在95%以上的水平。

图6 固定化酶拆分的批次稳定性Fig. 6 The batch stability of the immobilized enzyme
3 结论
利用介孔分子筛MCM-41、壳聚糖、戊二醛采取先吸附后交联的方法固定化PAL,经过条件优化得到了酶活保留高达92%、稳定性良好的固定化酶。将固定化PAL用于催化拆分D,L-苯丙氨酸的反应中,固定化酶的操作稳定性高,在连续10个批次的拆分反应后,转化率始终保持在95%以上。因此,固定化PAL拆分D,L-苯丙氨酸为D-苯丙氨酸高效制备提供了新方法。
[1]蒋耀忠,刘桂兰. D-苯丙氨酸的不对称合成[J]. 氨基酸杂志,1988,02:1-4.
[2]Oguri T,Kawai N,Shioiri T,et al. Amino acids and peptides. 29. New efficient asymmetric synthesis of a-amino acid derivatives with recycle of a chiral reagent-asymmetric alkylation of a chiral Schiff base from glycine[J]. Chem Pharm Bull,1978,26:803-808.
[3]闫博,朱占锋. D-氨基酰化酶拆分D,L-苯丙氨酸制备D-苯丙氨酸[J]. 氨基酸和生物资源,2008(2):36-38.
[4]魏浩. D-苯丙氨酸制备新工艺的研究[D]. 南京:南京工业大学,2003.
[5]Heberling MM,Wu B,Bartsch S,et al. Priming ammonia lyases and aminomutases for industrial and therapeutic
applications[J]. Curr Opin Chem Biol,2013,17(2):250-260.
[6]Bourget L,Chang T M. Phenylalanine ammonia-lyase immobilized in semipermeable microcapsules for enzyme replacement in phenylketonuria[J]. FEBS letters,1985,180(1):5-8.
[7]黄建坡,尹若春,张萍萍,等. 生物酶不对称转化生产D-苯丙氨酸的方法[P]. 安徽:CN101671716,2010-03-17.
[8]Zhu L,Cui WJ,Liu Y,et al. Cloning,expression and characterization of phenylalanine ammonia-lyase from Rhodotorula glutinis[J]. Biotech Lett,2013,35(5):751-756.
[9]Zhao J,Wang Y,Luo G,et al. Immobilization of penicillin G acylase on macro-mesoporous silica spheres.[J]. Bioresour Technol,2011,102(2):529-535.
[10]Gao S L,Wang Y J,Diao X,et al. Effect of pore diameter and cross-linking method on the immobilization efficiency of Candida rugosa lipase in SBA-15[J]. Bioresour Technol,2010,101(11):3830-3837
[11]Hartmann M,Kostrov X. Immobilization of enzymes on porous silicas-benefits and challenges.[J]. Chem Soc Rev,2013,42(15):6277-6289.
[12]Magner E. Immobilisation of enzymes on mesoporous silicate materials.[J]. Chem Soc Rev,2013,42(15):6213-6222.
[13]Macdonald M J,D’Cunha G B. A modern view of phenylalanine ammonia lyase.[J]. Biochem Cell Biol. 2007,85(3):273-282
[14]赵平,吴海君,高丽红,等. 手性流动相HPLC法拆分苯丙氨酸对映体[J]. 华东理工大学学报:自然科学版,2002,03:225-227.
[15]Ernst W,Patrick A,Bo M. Improved activity retention of enzymes deposited on solid supports[J]. Biotechnol Bioeng,1993,41:171-178.
[16]Sheldon R. Cross-linked enzyme aggregates(CLEAs):stable and recyclable biocatalysts[J]. Biochem Soc T,2007,35(6):1583.
[17]Cui JD,Li LL,Bian HJ. Immobilization of cross-linked phenylalanine ammonia lyase aggregates in microporous silica gel[J]. PloS one,2013,8(11):e80581.
[18]周骏山.实用氨基酸手册[M]. 无锡:无锡市氨基酸研究所,1989,73.
Chiral resolution ofD,L-phenylalanineusing immobilized phenylalanine ammonia-lyase for production ofD-phenylalanine
FANG Yue-qin1,ZHU Long-bao2,3,HUANG Nan2,ZHOU Li2,DING Zhong-yang2,LIU Ying1,ZHOU Zhe-min2,*
(1.School of Environment and Civil Engineering,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Key Laboratory of Industrial Biotechnology,Ministry of Education,Wuxi 214122,China;3.School of Biochemical Engineering,Anhui Polytechnic University,Wuhu 241000,China)
In order to establish a new method for the production of D-phenylalanine,the chiral resolution of D,L-phenylalanine using immobilized phenylalanine ammonia lyase(PAL)was investigated. The mesoporous silica materials MCM-41 was used as support. Under the optical immobilization conditions,a maximum activity of PAL was 92% of the free enzyme. The reusability of immobilized enzyme retained 85% activity after 20 cycles. Using the immobilized PAL to catalyze resolution of D,L-phenylalanine,a 98% conversion ratio of L-phenylalanine was attained within 24h,and the enantiomeric excess value of D-phenylalanine attained 96%. The immobilization enzyme ran continuously for 10 batches,the conversion ratio retained above 95%. Therefore,the immobilized PAL showed commercial application for the production of D-phenylalanine from chiral resolution of D,L-phenylalanine.
phenylalanine ammonia lyase(PAL);MCM-41;immobilization;chiral resolution of D,L-phenylalanine
2014-07-23
房月芹(1969-),女,硕士,实验师,研究方向:分子生物学。
*通讯作者:周哲敏(1969-),男,博士,教授,研究方向:酶工程与技术。
工业生物技术教育部重点实验开发课题(KLIB-KF201107,KLIB-KF201203)。
TS255.1
B
1002-0306(2015)11-0243-04
10.13386/j.issn1002-0306.2015.11.041
