细粒棘球蚴线粒体CO1基因的克隆与序列分析
2015-05-04于晶峰刘晓松常建华杨晓野杨莲茹李秀霞
于晶峰,李 滨,刘晓松,常建华,杨晓野,王 瑞,杨莲茹,李秀霞,木 兰
细粒棘球蚴线粒体CO1基因的克隆与序列分析
于晶峰1,3,李 滨1,刘晓松2,常建华2,杨晓野1,王 瑞1,杨莲茹1,李秀霞3,木 兰3
目的 研究细粒棘球蚴(Echinococcus granulasus)种间遗传标记特点,为该虫种的分子分类学研究提供基础。方法 在内蒙古地区从羊肝脏采集细粒棘球蚴,肝包虫病患者手术剥离囊包后,签署知情同意书,采集细粒棘球蚴。提取虫体DNA,扩增线粒体细胞色素氧化酶1(CO1)基因,将其克隆到PGM-T载体后,用PCR技术鉴定阳性菌落,并进行测序,运用DNAstar5.0 软件计算序列间的相似性,计算遗传距离,同时,应用MEGA4.0软件的最大似然法(ML-Maximum Likelihood)和邻接法(NJ-Neighbor Joining)构建系统发育树,进行聚类分析。结果 细粒棘球蚴DNA扩增出的羊株、人株CO1基因序列片段长度为936 bp。同其他亲缘关系较近的属CO1基因序列比对:羊株、人株细粒棘球蚴CO1序列与黄花棘球绦虫的同源性最高,分别为91.9%、91.2%;羊株、人株细粒棘球蚴CO1序列与黄花棘球绦虫位于同一分支,自展值(Boostrap)最高,均为100%。羊株、人株细粒棘球蚴CO1序列所属分支与原头目的Proteocephalus macrocephalus所属分支相隔较远。结论 CO1基因序列稳定保守,无宿主特异性,可作为细粒棘球蚴理想的种间遗传标记。
细粒棘球蚴;CO1基因;克隆;序列分析
细粒棘球绦虫(Echinococcusgranulosus)属带科、棘球属,又称包生绦虫。成虫寄生于犬科食肉动物,幼虫(棘球蚴)寄生于人和多种食草类家畜及其它动物,引起一种严重的人兽共患病,称棘球蚴病或包虫病。棘球蚴病分布地域广泛,随着世界畜牧业的发展而不断扩散,已成为全球性重要的公共卫生和经济问题[1-2]。细粒棘球绦虫的虫株鉴定非常复杂,以往主要利用其形态学特征结合其他方面的资料(如流行病学、生物化学、同工酶分析)作为虫株鉴定的根据[3]。虽然利用形态学和生物学特征能为虫株的鉴定提供一些有价值的资料,但由于受到多种因素(如宿主和环境)的影响,并不能完全反映其基因水平的差异。而DNA序列作为遗传信息的载体,在世代传递过程中,除保有遗传稳定外,还不断的发生变异。因而,DNA序列分析对物种间的进化关系的确立、种间和种内亲缘关系的确立均具有重要意义[4-5]。近年来,随着生物信息学的发展,将动物寄生虫基因组DNA中的未知序列与已知序列(如GenBank、Ensembl、UCSC)进行比较,进而确定虫种的种属和分类。已成为分子生物学分析动物寄生虫进化关系的一个强有力的工具[6-7]。
1 材料与方法
1.1 材料
1.1.1 试验样品细粒棘球蚴包囊采自内蒙古锡盟西乌旗绵羊屠宰场,和锡林浩特市医院包虫病患者。锡盟西乌旗绵羊屠宰场调查成年绵羊与幼年绵羊共2 313只,患羊数量为30只,18名锡林浩特市某医院B超检查疑似包虫病患者,手术后经病理证实确诊为包虫病,患者均签署知情同意书。收集囊包后用10 mL注射器将囊液吸出,离心1 min 30 s,使囊液与原头蚴分离,-20 ℃保存。
1.1.2 菌种、载体及主要试剂 大肠杆菌Top10感受态细胞、血液组织细胞基因组提取试剂盒(DP304)、琼脂糖胶回收试剂盒(DP209-03)、pGM-T连接试剂盒( VT202-02)均购自天根(北京)生化科技有限公司;Premix Ex Taq(RR003A)、DL2000 DNA Marker、氨苄青霉素(Amp)、5-溴-4-氯-3-吲哚-β-D半乳糖苷(X-gal)、异丙基-β-D-硫代半乳糖苷(IPTG)、10×Loading Buffer均购自大连宝生物工程有限公司;核酸染料,购自北京市赛百盛基因技术有限公司;其它盐酸,氢氧化钠等常规生化试剂由内蒙古农业大学兽医学院寄生虫学研究室提供。
1.2 基因组DNA提取及PCR扩增 细粒棘球蚴原头蚴基因组DNA的提取按照血液组织细胞基因组提取试剂盒进行。根据杨俊克[8]报道的细粒棘球蚴CO1基因的引物序列,上游引物(CO1-F):5′-TTGTTAGGTGGTTTGTCTGA-3′和下游引物(CO1-R):5′-GGCCATCACAAATAAACAT-3′由生工生物工程(上海)股份有限公司合成。
以提取的细粒棘球蚴原头蚴基因组DNA为模板,进行目的基因扩增。体系为80 μL(各组分用量:Premix Taq 40 μL,CO1-F 4 μL,CO1-R 4 μL模板4 μL,dH2O补足至80 μL)。PCR反应条件为:95 ℃预变性5 min;95 ℃变性40 s,56 ℃退火30 s,72 ℃延伸1 min 20 s, 35个循环;72 ℃完全延伸10 min。反应结束后,对PCR产物分别进行1%琼脂糖凝胶电泳检测,于紫外灯下观察结果。
1.3 扩增片段的克隆与测序 利用琼脂糖胶回收试剂盒对PCR产物的目的片段进行纯化。根据pGM-T载体说明书将胶回收的PCR产物与PGM-T载体进行连接,目的PCR片段,XμL,pGM-T vector 1 μL,10×T4 DNA Ligation Buffer 1 μL,ddH2O补足至10 μL。载体与目的片段的摩尔比控制在1∶3~1∶8。轻弹混匀短暂离心后16 ℃水浴过夜连接。待反应结束后立即将PCR管置于冰上。
连接产物转化至感受态细胞,进行蓝白斑筛选。挑取白色菌落,置于2 mL LB液体培养基中(含有Amp),150 r/min、37 ℃振荡培养12~16 h,取1 μL进行菌液PCR鉴定。PCR反应体系为20 μL,反应条件同1.2的PCR扩增。PCR产物经琼脂糖凝胶电泳检测,有目的条带的阳性菌液送生工生物工程(上海)股份有限公司测序。
1.4 序列分析 应用NCBI中的nucleotide blast对测得序列细粒棘球蚴的CO1基因进行同源搜索。综合考虑序列覆盖率(Query coverage)、最大序列相似度(Max ident)、随机匹配可能性(E value)3个因素,选取圆叶目、裂头目(Diphyllobothriide)、原头目(Proteocephalidea)等其他科属种的CO1基因的序列(表1),运用DNAstar5.0 软件计算序列间的相似性,计算遗传距离,同时,应用MEGA4.0软件的最大似然法(ML-Maximum Likelihood)和邻接法(NJ-Neighbor Joining)构建系统发育树,进行聚类分析。系统发育树进行自举检验(bootstrap),检验次数为1 000。
2 结 果
2.1 PCR扩增结果 PCR扩增产物经1%琼脂糖凝胶电泳检测,结果见图1。结果表明CO1基因在约936 bp处获得了特异性条带,与预期片段大小吻合,无非特异性的扩增条带。
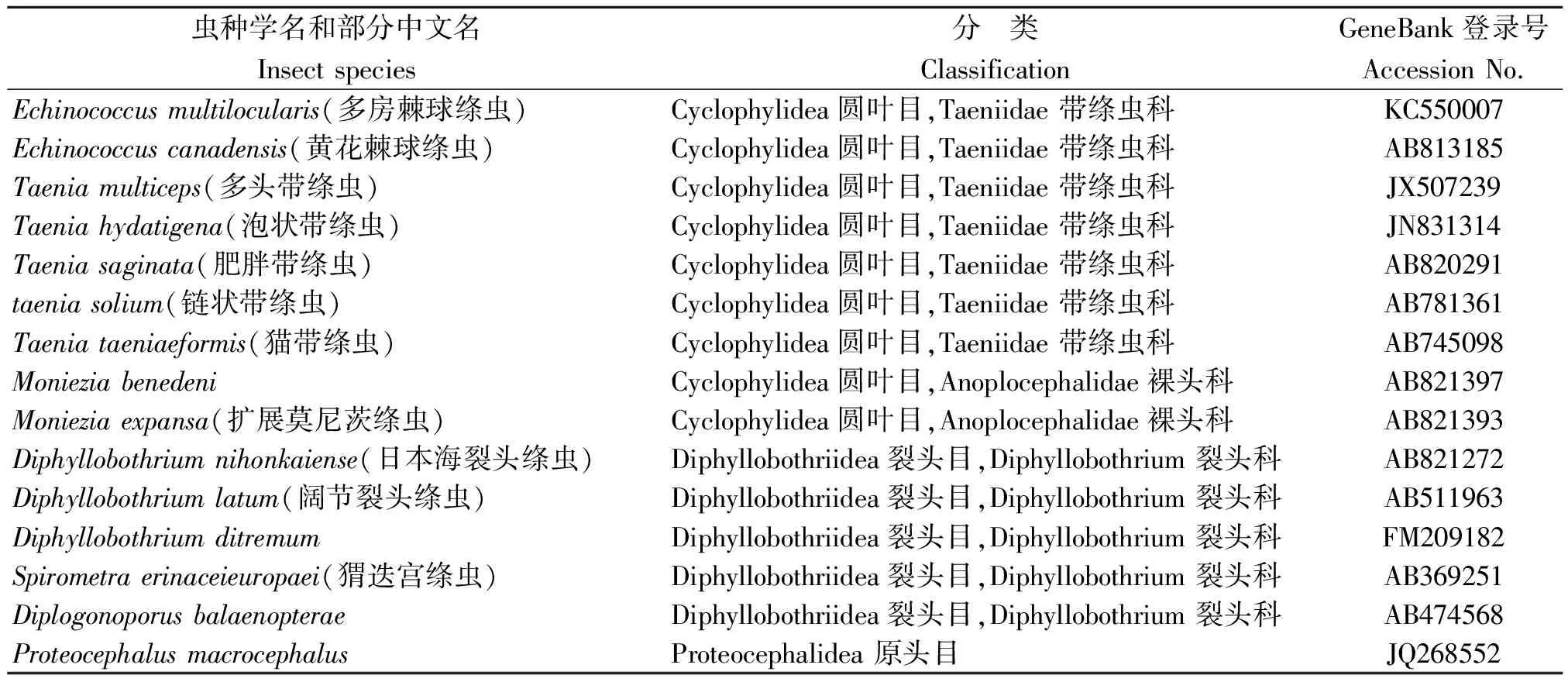
表1 15种绦虫线粒体CO1基因相关资料

M:DL-2000分子量标记;1:西乌旗羊株样本;2~7:锡林浩特人株样本;8:阴性对照
M:DL 2000 DNA marker;1:Xuwuqi sheep samples;2~7:Xilinhaote human samples;8:Negative control
图1 细粒棘球蚴CO1基因PCR产物电泳结果
Fig.1 Electrophoresis results of PCR products of CO1 gene fromEchinococcusgranulosus
2.2 克隆结果 阳性菌液经PCR鉴定和1%琼脂凝胶电泳检测后,在800 bp~1 000 bp之间出现了清晰的特异性条带(见图2)。
2.3 测序结果

M:DL-2000分子量标记;1:西乌旗羊株样本;2~7:锡林浩特样人株本;8:阴性对照
M:DL 2000 DNA marker;1:Xuwuqi sheep samples;2~7: Xilinhaote human samples;8:Negative control
图2 阳性克隆菌液PCR鉴定电泳结果
Fig.2 Electrophoresis results of positive clone bacterium by PCR amplification
2.3.1 西乌旗羊株细粒棘球蚴CO1序列 西乌旗羊株细粒棘球蚴以CO1-F、CO1-R为引物,通过PCR糖扩增获得了CO1基因部分序列,经克隆测序、去载体接头等处理获得了长度为936 bp的序列,其A、G、T、C的含量分别为15.60%、25.00%、48.72%、10.68%,A+T含量为64.32%。具体序列如下:

The shaded region was the prime poistion
2.3.2 锡林浩特市人株细粒棘球蚴CO1序列 锡林浩特市人株细粒棘球蚴DNA样品经克隆测序所得的序列长度也为936 bp,其A、G、T、C的含量分别为15.60%、25.11%、47.54%、11.75%,A+T含量为63.14%。具体序列如下:

The shaded region was the prime poistion
2.3.3 序列比对结果 对比结果显示西乌旗羊株与锡林浩特人株细粒棘球蚴的同源性为98.5%,变异率为1.5%,相应区域存在12个变异位点,突变类型均为转换,即G与A置换和T与C置换。将获得的羊株细粒棘球蚴CO1序列、人株细粒棘球蚴CO1序列与NCBI数据库进行同源分析,通过nucleotide blast同源比对(http://blast.ncbi.nlm.nih.gov)结果表明羊株细粒棘球蚴CO1序列与蒙古细粒棘球蚴的CO1基因序列相似性最高,人株细粒棘球蚴CO1序列与伊朗细粒棘球蚴的CO1基因序列相似性最高,相似性均在99%以上,基因型均是G1型。羊株细粒棘球蚴CO1序列与人株细粒棘球蚴CO1序列的相似性也达到了99%。
2.3.4 基因序列同源性与遗传距离分析 羊株细粒棘球蚴CO1序列、人株细粒棘球蚴CO1序列均与圆叶目、带绦虫科的黄花棘球绦虫的同源性最高,分别为91.9%、91.2%;羊株细粒棘球蚴CO1序列、人株细粒棘球蚴CO1序列与圆叶目、带绦虫科的黄花棘球绦虫的遗传距离最小,分别为0.086、0.092。
采用ML法和NJ法构建的系统发育树结果显示羊株细粒棘球蚴CO1序列、人株细粒棘球蚴CO1序列与带绦虫科的黄花棘球绦虫位于同一分支,系统发育树的自举检验值(Boostrap)最高,均为100%(图3、图4)。羊株细粒棘球蚴CO1序列、人株细粒棘球蚴CO1序列所属分支与原头目的Proteocephalus macrocephalus所属分支相隔较远。
3 讨 论

图3 基于CO1构建的17种绦虫之间的系统发育树(ML-Maximum Likelihood法)
Fig.3 Phylogenetic treebased CO1 among 17 kinds of tapeworm(ML-Maximum Likelihood method)

图4 基于CO1构建的17种绦虫之间的系统发育树(NJ-NeighborJoining法)
Fig.4 Phylogenetic treebased CO1 among 17 kinds of tapeworm(NJ method)
mtDNA是生物体细胞内重要的细胞器,是能量产生与转换的场所。线粒体因其进化速率快,母系遗传、基因重组率低、独立进化、基因组精简等特点[3]。已成为重要的分子标记,广泛的用于物种基因遗传变异的研究,尤其更适合于种下分类学的研究[8]。目前mtDNA基因组及其相关编码基因序列已广泛应用于寄生虫的分类和系统发生等方面的研究。在细粒棘球蚴研究方面,马秀敏等(2007)[9]对新疆不同地区44个患有细粒棘球蚴病的病人进行了研究,根据细粒棘球绦虫mtDNA rrnL的特征构建了PCR-RFLP技术,即可用于其基因型的鉴定。近年来,国内外专家陆续报道了有关细粒棘球绦虫基因型的研究进展,而基因型之间的对比也是当今学术领域研究的热点问题[10-13]。杨俊克等(2004年)[8]用线粒体DNA的CO1基因测序的方法,调查了采自青海省、甘肃省和新疆维吾尔族自治区的24株细粒棘球蚴分离株基因型的变异情况,结果表明不同地区CO1基因变异率均在1%以下,这与本实验得出的结果相一致,即内蒙古两地区的细粒棘球蚴线粒体CO1基因序列高度相似,不因宿主的不同而出现明显的差异,这为将来全面了解内蒙古地区基因变异情况提供了理论依据。
进化树的构建有助于我们了解物种的进化历史,为生物学中物种的分类提供可靠的依据。通过比较不同绦虫CO1基因序列显示,虽然此基因在不同种属绦虫间有部分序列相当保守,但各种属绦虫间仍存在着特定的差异。这些差异与种系发生的远近程度存在一定的关系。如细粒棘球蚴与同属带绦虫科的黄花棘球绦虫的同源性达到了91.9%;而与演化关系较为疏远的Diplogonoporus balaenopterae则差异较大(同源性仅为75.2%),分属不同的种属(Diplogonoporus balaenopterae,裂头目,裂头科)。CO1基因的进化分析都将细粒棘球蚴与黄花棘球绦虫划到了同一个分支,这说明他们之间发生分歧的时间较短,可能在生活习性方面还存在某些相似性。
[1]Dakkak A. Echinococcosis / hydatidosis: a severe threat in Mediterranean countries[J]. Vet parasitological, 2010, 174 (1/2):2-11.
[2]Romig T, Dinkel A, Mackenstedt U. The present situation of echinococcosis in Europe[J]. Parasitol Int, 2006, 55(Suppl): S187-191.
[3]Li Bin.Epidemiological Investigation ofEchinococcusgranulosusand Analysis of CO1 and ND1 Gene Sequence[D].Department of Preventive Veterinary Medicine, Inner Mongolia Agricultural University,2013:14.(in Chinese) 李滨.细粒棘球蚴的流行病调查及CO1与ND1基因序列分析[D].内蒙古农业大学预防兽医学,2013:14.
[4]Folmer O, Biack M, Hoeh W, et al. DNA primers for amplification and mitochondrial cytoehrome coxidase subunit 1 from diverse metazoan invertebrate[J]. Mo1 MarBio1 Biotechnol, 1994, 3:29.
[5]Tie YM, Ma JX, Wang YD. Investigation on cystic echinococcosis for sheep from Xinghai region[J]. Qinghai Agr Anim Husb, 2008, 38(7): 612-615. (in Chinese) 铁永梅,马建霞,王永殿.兴海地区绵羊棘球蚴病调查[J].青海农牧业,2008, 38(7): 612-615. (in Chinese)
[6]Xu ZJ, Zhang CY, Tan YH, et al. Prevalence of hydatid disease in Heilongjiang Province[J]. Chin J Parasitol Parasit Dis, 2004, 22(2): 93. (in Chinese) 徐之杰,张崇友,镡云辉,等.黑龙江省棘球蚴病流行概况[J].中国寄生虫学和寄生虫病,2004,22(2):93.
[7]Ishida N, Hasegawa T, Takeda K, et al. Polymorphic sequence in the D-loop region of equine mitochondrial DNA[J]. Animal Genetics, 1994, 25: 215-221.(in Chinese)
[8]Yang JK, Jia WZ, Jing tao,et al.Three provinces E.granulosus Gene Variation Analysis in china[J].Chinese Journal of Veterinary Science and Technology,2004,34(9):12-16.(in Chinese) 杨俊克,贾万忠,景涛,等.我国三省区细粒棘球绦虫基因的变异分析[J].中国兽医科技,2004,34(9):12-16.
[9]Ma XM.WULAMU MT,Ding JB,et al.PCR-RFLP technique in E.granulosus seed strains Identification[J].Journal of Pathogen Biology,2008,3(4):281-287.(in Chinese) 马秀敏,吾拉木马木提,丁剑冰,等.PCR-RFLP技术在细粒棘球绦虫种株鉴定中的应用[J].中国病原生物学杂志,2008,3(4):281-287.
[10]Feagin JE. Mitoehondrial genome diversity in parasites[J].Int J Parasitol, 2000, 30: 371-390.
[11]Tu BX, Zhang WL, Zhang WB, et al. Investigation onEchinococcusgranulosusinfection in camel from Alashan of Inner Mongolia[J]. Endem Dis Bull, 2003, 18(2): 99 (in Chinese) 图布新,张文林,张文彬,等.内蒙古阿拉善左旗骆驼中细粒棘球蚴感染的调查[J].地方病通报,2003,18(2):99.
[12]Liu GH, Dai RS, Zhao GH, et al. Cloning and sequence analysis of mitochondrial cytochrome c oxidase subunit 1 fromTaeniahydatigenaisolates from Changsha and Xiangxi in Hunan province[J]. J Trop Med, 2009, 9(2): 117-120. (in Chinese) 刘国华,戴荣四,赵光辉,等.湖南长沙及湘西泡状带绦虫分离株线粒体cox1基因的克隆及序列分析[J].热带医学杂志,2009,9(2):117-120.
[13]Brown G G, Gadaleta G, Pepe G, et al. Structural conservation and variation in the D-loop containing region of vertebrate mitochondrial DNA[J]. J Mol Biol, 1986, 192: 503-511.
Yang Xiao-ye,Email:xiaoyeyang122@sohu.com;Mu lan,Email: wodetenghe@126.com
Cloning and sequence analysis of the partial CO1 gene within mitochondrial DNA ofEchinococcusgranulosus
YU Jing-feng1,3,LI Bin1,LIU Xiao-song2,CHANG Jian-hua2, YANG Xiao-ye1,WANG Rui1,YANG Lian-ru1,LI Xiu-xia3,MU Lan3
(1.KeyLaboratoryofClinicalDiagnosisandTreatmentTechnologyinAnimalDisease,MinistryofAgriculture;CollegeofVeterinaryMedicine,InnerMongoliaAgriculturalUniversity,Hohhot010018,China; 2.InnerMongoliaAcademyofAgricultural&AnimalHusbandrySciences,Hohhot010031,China; 3.SchoolofBasicMedicalScience,InnerMongoliaMedicalUniversity,Hohhot010110,China)
We investigated the inter-specific genetic marker ofEchinococcusgranulosus, which was used for further study in molecular classification. The genomic DNA ofEchinococcusgranulosuscollected from the infected sheep and people in Inner Mongolia were extracted. The mitochondrial cytochrome oxidase subunit 1 ( CO1) gene was amplified by PCR using universal primers, and then the PCR product was cloned into pGM-T vectors. The insert was sequenced successfully and compared with other cestodes sequences by DNAStar 5.0 and MEGA 4.0. Results showed that the PCR product was 936 bp in length. Compared with other CO1 gene sequences of related cestodes, the homology amongEchinococcusgranulosusandEchinococcuscanadensiswere 91.9% and 91.2%.EchinococcusgranulosusandEchinococcuscanadensiswere in the same branch, and bootstrap values (Boostrap) in the highest was 100%.Echinococcusgranulosusaffiliated branch of the original leaders of the branch belonged toProteocephalusmacrocephalusfar apart. It suggested that the CO1 gene sequences were stably conservative and non-host-specific, which can be used as an ideal species amongEchinococcusgranulosusgenetic markers.
Echinococcusgranulosus; CO1 gene; cloning; sequence analysis
国家公益性行业(农业)专项资助(No.201103008,No.201303037)
杨晓野,Email:xiaoyeyang122@sohu.com; 木 兰, Email:wodetenghe@126.com
1.农业部动物疾病临床诊疗技术重点实验室/内蒙古农业大学兽医学院,内蒙古呼和浩特 010018; 2.内蒙古农牧业科学院兽医研究所,呼和浩特 010031; 3.内蒙古医科大学基础医学院,呼和浩特 010110
Supported by the National Public Service Sectors (Agriculture) Special Funding(Nos.201103008 and No.201303037 )
10.3969/cjz.j.issn.1002-2694.2015.06.008
R383.3
A
1002-2694(2015)06-0532-05
2015-03-02;
2015-05-20
