弗氏枸橼酸杆菌CF74的FliS蛋白功能研究
2015-05-04刘丽云
刘丽云,郝 帅,孙 晖
弗氏枸橼酸杆菌CF74的FliS蛋白功能研究
刘丽云1,郝 帅2,孙 晖1
目的 研究弗氏枸橼酸杆菌CF74的FliS蛋白功能。方法 构建弗氏枸橼酸杆菌CF74fliS的精确缺失突变株(CF74ΔfliS)及其互补菌株(CF74pfliS),并进行细菌游动性实验,检测它们对THP1细胞的粘附性和细胞毒性的作用。并用Western blotting方法检测FliC蛋白在培养上清中的分泌。结果 弗氏枸橼酸杆菌CF74ΔfliS突变株没有游动性,而回补株CF74pfliS回补了游动性。而且,CF74ΔfliS突变株降低对THP1细胞的粘附和细胞毒作用,其回补株恢复了粘附性和细胞毒性。此外,CF74ΔfliS突变株降低FliC蛋白在培养上清中的分泌。结论 FliS蛋白影响弗氏枸橼酸杆菌CF74的游动性,并参与其对宿主细胞的粘附和细胞毒作用。
弗氏枸橼酸杆菌;CF74ΔfliS;游动性;粘附性;细胞毒性
弗氏枸橼酸杆菌属于枸橼酸杆菌属、肠杆菌科、革兰氏阴性杆菌、兼性厌氧、周身鞭毛、菌毛、无芽胞和无荚膜。弗氏枸橼酸杆菌在自然界广泛存在,是人类和动物肠道的正常菌群,属于条件致病菌。弗氏枸橼酸杆菌可以引起包括腹泻在内的多种感染性疾病如:尿道感染、脑膜炎、脓毒症以及医院获得性感染等[1-3]。弗氏枸橼酸杆菌可以通过获得毒力因子变成致病菌,引起腹泻等感染,Pereira AL等报道聚集性粘附的弗氏枸橼酸杆菌具有强的细胞毒性[4-5]。
鞭毛作为细菌运动的重要器官,参与细菌的粘附,也是重要的毒力决定因子,参与了一系列的致病过程,鞭毛所提供的动力可能是细菌侵入细胞的重要因素;鞭毛蛋白可以作为粘附素,决定了细菌在细胞表面的吸附,以及其后的侵袭与定植过程;鞭毛蛋白可以引起宿主细胞的炎性反应;在病原菌中,鞭毛的组装系统,类似于毒力因子的分泌系统,在细菌内外膜之间存在复杂的调控机制,可以介导一系列胞外毒素的分泌,其中包括磷脂酶YplA的分泌[6-12]。FliS作为鞭毛蛋白的胞浆输出伴侣蛋白,可以防止未成熟的鞭毛单体过早的在胞浆中聚合。FliS通过与FliC C端螺旋结构域结合,帮助鞭毛蛋白亚单位之间聚合的稳定性[13]。
我们分离到一株弗氏枸橼酸杆菌CF74,该菌具有强的粘附性和细胞毒性,并且具有完整的鞭毛系统[4]。我们推测鞭毛蛋白参与了这一系列的致病过程。为了探索FliS在弗氏枸橼酸杆菌CF74致病中的作用,本研究构建了fliS的精确缺失突变株(CF74ΔfliS)及其互补菌株(CF74pliS),来研究弗氏枸橼酸杆菌CF74 中FliS在游动性、粘附性和细胞毒性的作用。从而了解FliS在弗氏枸橼酸杆菌致病性中的作用。
1 材料和方法
1.1 材料
1.1.1 菌株、质粒和引物 见表1。

表1 供试菌株、质粒及引物
1.1.2 主要试剂和仪器 实验所用Taq DNA聚合酶、T4连接酶、高保真酶、dNTPs、DNA Marker为TaKaRa公司产品;质粒提取试剂盒、PCR产物纯化试剂盒、琼脂糖凝胶回收试剂盒为QIAGEN生产;电泳仪、凝胶成像仪等为Bio—Rad公司产品;Cyto-Tox 96 Cytoxicity Kit购自美国 Promega公司;1640培养基和小牛血清购自GIBCO公司;CO2培养箱为Thermo Forma Steri-Cycle。
1.2 方法
1.2.1 培养基及培养条件 弗氏枸橼酸杆菌的常规培养条件为:LB液体培养基(1%胰蛋白胨、0.5%酵母提取物、1%NaCl,调节pH至7.4)及LBA固体平板(LB液体培养基中加入1.5%琼脂),37 ℃培养。培养基中所需链霉素(Str)和氨苄青霉素(Amp)浓度均为100 μg/mL。10%蔗糖LBA平板用于弗氏枸橼酸杆菌突变株的筛选。含有0.3%琼脂的LBA平板用于弗氏枸橼酸杆菌游动性实验。
1.2.2 弗氏枸橼酸杆菌CF74目的基因缺失突变株及回补株的构建 通过融合PCR技术将弗氏枸橼酸杆菌CF74的fliS基因上下游同源臂融合得到缺失fliS基因编码区的DNA片段,并将此PCR产物克隆到自杀载体pWM91上,通过DNA测序得到片段正确的重组质粒。将重组质粒转化大肠埃希菌SM10λpir,再接合转移至弗氏枸橼酸杆菌CF74中,经pWM91质粒上sacB基因利用蔗糖平板进行反向筛选并通过PCR进行鉴定,得到fliS缺失突变株。PCR扩增fliS基因全序列的DNA片段408 bp,将目的片段克隆到载体pBAD24中,通过DNA测序得到片段正确的重组质粒。将重组质粒经电转化导入弗氏枸橼酸杆菌CF74fliS突变株中,通过PCR进行鉴定,得到回补株CF74ΔfliS+pBAD24-fliS(简称CF74pfliS)。
1.2.3 弗氏枸橼酸杆菌游动性检测 将弗氏枸橼酸杆菌CF74野生株、CF74△fliS和CF74pfliS接种于LBA中,37 ℃培养过夜。次日,用灭菌的牙签挑单克隆,刺人含0.3%琼脂的LBA平板中,30 ℃静置培养16 h后,我们对游动的菌圈直径进行测量,并且除以平皿的直径,获得相对的游动面积百分比,用来比较菌株的游动能力。所有菌株设立3个平行。并且进行至少2次重复实验。
1.2.4 弗氏枸橼酸杆菌粘附和细胞毒实验 单核细胞株THP-1细胞(TIB-202TM,ATCC)接种于24孔细胞板,培养液为1640(含5%小牛血清),培养过夜经过分化为巨噬细胞。细菌感染细胞的MOI为100∶1,在37 ℃ ,5% CO2的温箱中共同孵育3 h后,经过PBS清洗24孔板,细胞被含有0.25% Triton X-100的PBS裂解液中裂解,然后倍比稀释裂解产物,涂LBA平板,在37 ℃的温箱培养过夜。次日进行菌落计数。每个样品有3个平行,并且进行至少2次重复实验。
LDH实验是按照Cytotox96 kit (Promega)操作说明进行的。具体步骤如下:THP-1细胞接种于96孔板,培养液为1640含5%FBS,培养过夜,经过分化为巨噬细胞;次日,细菌感染细胞的MOI为100∶1,在37 ℃ ,5% CO2的温箱中共同孵育6 h。离心,移取每孔上清50 μL 至另一96 孔板,并在每孔加入50 μL LDH 反应液,避光反应30 min(室温15~25 ℃);每孔加入50 μL LDH 终止液,酶标仪测吸光度,测量波长为490 nm,参考波长为630 nm。低对照组为不加细菌的细胞培养液,高对照组为细胞被加入lysis完全裂解(promege 试剂盒带,在显色前40 min加入 1Xlysis)。细胞毒性%=(OD样品-OD低对照)/(OD高对照-OD低对照)×100%。每个样品有3个平行,并且进行至少2次重复实验
1.2.5 上清蛋白准备和Western blot分析 收集CF74野生株和CF74△fliS缺失株摇至OD600为1.0的上清培养基,用0.22 μm滤膜(Millipore)过滤除菌,加入10% (v/v) TCA( Sigma-Aldrich),在4 ℃过夜沉淀蛋白。次日,经过高速离心,冰丙酮洗剂,干燥上清蛋白。定量蛋白后,用蛋白上样buffer溶解上清蛋白进行Western blot分析,一抗为兔抗FliC抗体 (Abzome Co,Ltd China, 1∶5 000) 和二抗HRP标记的羊抗兔抗体(MBL, 1∶10 000),ECL发光显色。
1.2.6 统计学分析 SPSS软件包版本为13.0 (SPSS Inc., Chicago, IL, USA)进行所有数据的统计学分析。非参数检验(Mann-WhitneyU-test)用于组间的差异比较分析,P<0.05为有统计学意义。
2 结 果
2.1 弗氏枸橼酸杆菌CF74△fliS缺失株和CF74pfliS回补株的PCR验证 用fliS全长引物分别扩增CF74野生株、CF74△fliS缺失株和回补株CF74pfliS的基因组DNA。如图1所示,缺失株没有带,野生株和回补株在大约400 bp的位置有一条特异性的带。结果表明构建的fliS缺失株和回补株是成功的。
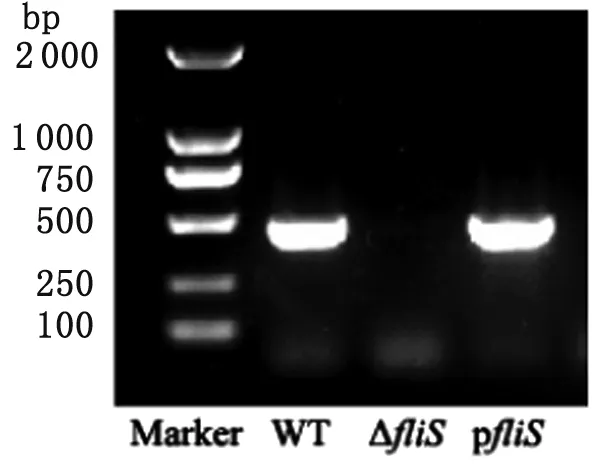
fliS mutant was checked by amplifying of full sequence of fliS.
2.2 弗氏枸橼酸杆菌CF74ΔfliS缺失株没有游动性 为了研究FliS是否影响细菌的游动性,我们对CF74野生株、CF74ΔfliS缺失株和回补株 F74pfliS进行了游动性实验分析。如图 2A所示,CF74ΔfliS没有游动性,CF74pfliS和CF74野生株具有相类似的游动性。CF74野生株的相对游动面积为57.7%,CF74ΔfliS的相对游动面积为0,CF74pfliS的相对游动面积62.3%。CF74ΔfliS游动明显低于CF74野生株和回补株CF74pfliS(P<0.01) 图 2B。上述结果表明FliS影响弗氏枸橼酸杆菌的游动性。
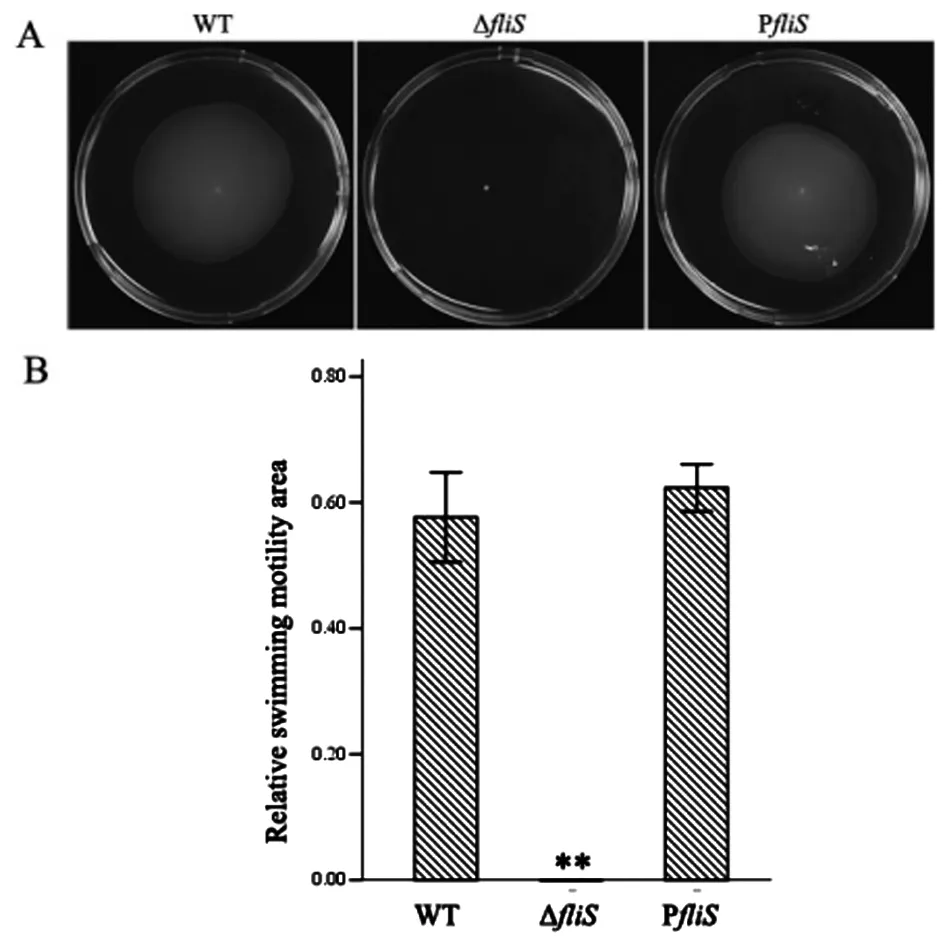
A: Representative images of swimming motility ofC.freundiiCF74, CF74ΔfliSand CF74pfliS;
B: Quantification of the inhibition of swimming motility halo by CF74ΔfliSmutant in swim plates.
The y-axis represents relative swimming motility area, the x-axis represents different strains.
Statistical significance was determined by Mann-Whitney U-test between CF74ΔfliSand CF74 or CF74pfliS. **:P<0.01.
图2FliS对游动性的影响
Fig.2 Effect of theFliSon motility
2.3 弗氏枸橼酸杆菌CF74 FliS蛋白参与对THP-1细胞的粘附和细胞毒作用 通过比较CF74野生株、CF74ΔfliS和 F74pfliS对THP-1 细胞的粘附差异。我们发现CF74ΔfliS对THP-1细胞的粘附能力明显低于CF74野生株(P<0.01),而回补株CF74pfliS回补了对THP-1细胞的粘附能力(图3 A)。结果表明FliS参与弗氏枸橼酸杆菌CF74对宿主细胞的粘附作用。
进一步研究FliS对弗氏枸橼酸杆菌CF74的细胞毒作用。我们用CF74野生株、 CF74ΔfliS和 F74pfliS分别感染THP-1细胞6 h,通过测定它们作用的THP-1 细胞LDH的释放情况分析发现,CF74野生株感染的THP-1细胞的LDH释放率为25%,缺失株CF74ΔfliS的LDH释放率为10%,回补株CF74pfliS的LDH释放率为15%。CF74ΔfliS感染THP-1细胞的LDH释放率明显低于CF74野生株(P<0.01),回补株CF74pfliS明显补回了感染THP-1细胞的LDH释放率(图3B)。结果表明FliS参与弗氏枸橼酸杆菌CF74对宿主细胞的细胞毒作用。
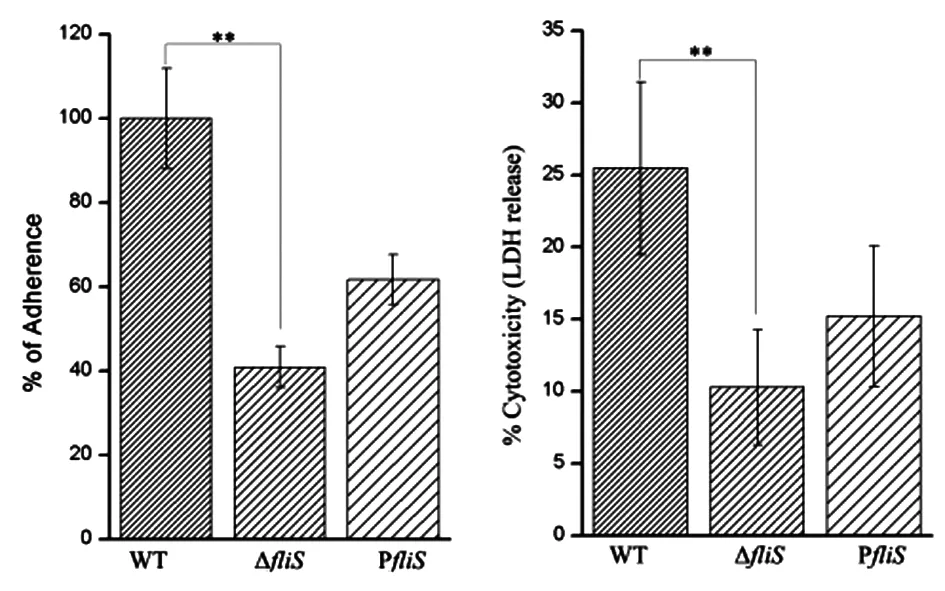
A: Effects of FliS on CF74 adherence to THP-1 cell (MOI, 100). Performance of CF74ΔfliSwas compared statistically to the wild type CF74. **:P<0.01.
B: Lactate dehydrogenase (LDH) released were measured from THP-1 cells after exposure toC.freundiiCF74, CF74△fliSand CF74pfliSat 6 hours using optical density reading at A490/630 (vertical axis).
Significant differences between wild type and CF74△fliSmutant were shown with **:P<0.01.
图3 CF74的FliS对THP-1细胞的粘附和细胞毒的影响
Fig.3 Effect of the FliS on adhesion and cytotoxicity to THP-1 cell
2.4 弗氏枸橼酸杆菌CF74 FliS蛋白影响FliC蛋白的分泌 通过检测CF74野生株和CF74△fliS缺失株对FliC蛋白分泌的影响,发现CF74△fliS缺失株中的FliC蛋白的分泌降低(图4)。

Immunoblot analysis of FliC protein in the culture supernatant (Sup) prepared fromC.freundiiCF74 and CF74△fliSgrown in LB.
The position of a reactive band corresponding to FliC was detected with anti-FliC antibody.
图4 FliS影响鞭毛蛋白FliC的分泌
Fig.4 Effect of FliS on the secretion of flagellar protein FliC
3 讨 论
细菌的游动性依赖于鞭毛系统。弗氏枸橼酸杆菌具有完整的鞭毛系统,鞭毛系统基因:flhD, motA 和 motB突变可以引起弗氏枸橼酸杆菌的游动性的缺陷[14]。由于flhDC操纵子控制鞭毛生物合成,所以flhD缺失突变导致无鞭毛产生[14]。此外,motA 和 motB可以形成转移质子动力来驱动鞭毛的质子通道。虽然motA 和 motB缺失突变株可以产生鞭毛,但是是无功能的鞭毛[14]。上述数据表明弗氏枸橼酸杆菌的游动性依赖于鞭毛系统。本研究发现FliS作为鞭毛蛋白的胞浆输出伴侣蛋白,它的突变株可以引起弗氏枸橼酸杆菌CF74失去游动性。Capdevila S等也已经报道在荧光假单胞杆菌中,缺失突变fliS可以引起该菌无游动性[15]。这表明FliS蛋白影响细菌的游动性。
FliS 作为鞭毛蛋白特异的胞浆伴侣蛋白,帮助FliC分泌和有助于鞭毛蛋白亚基在聚合过程中的稳定性[13,15]。fliS缺失突变株可以引起多数FliC蛋白堆积在细胞质形成包涵体而不能分泌出去;也可以导致FliC错误聚合或不能形成稳定的聚合体,从而影响正常的鞭毛丝的形成,电镜下表现为鞭毛的又短又细[15]。本研究中发现,弗氏枸橼酸杆菌CF74fliS缺失突变株可以引起FliC蛋白分泌的减少。此外,弗氏枸橼酸杆菌CF74fliS缺失突变株可以导致巨噬细胞的粘附性减弱和细胞毒性下降。已有文献报道,FliC参与病原菌的粘附和细胞毒作用[16]。上述结果表明FliS通过调控FliC分泌,而间接的影响对宿主细胞的粘附和细胞毒作用。
病原菌鞭毛系统介导的游动性有利于增加病原菌与宿主细胞接触的机率,进而促进其粘附和定植,从而引起对宿主细胞的感染。所以游动性是细菌鞭毛系统参与致病性的重要因素之一。已有文献报道,鼠伤寒沙门氏菌(Salmonellatyphimurium)对兔盲肠的定植[17],霍乱弧菌(Vibriocholerae)对小肠粘膜的定植[18]以及假单胞菌(Pseudomonasaeruginosa)引起的烫伤感染的模型[19],都依赖于细菌的游动性。本研究中,fliS缺失突变株没有游动性,从而导致该菌对巨噬细胞的粘附性和细胞毒性的减弱。所以游动性是病原菌引起感染的重要原因之一。
总之,FliS蛋白影响弗氏枸橼酸杆菌CF74的游动性,并参与其对宿主细胞的粘附和细胞毒作用。
[1]Deal EN, Micek ST, Ritchie DJ, et al. Predictors of in-hospital mortality for bloodstream infections caused byEnterobacterspecies orCitrobacterfreundii[J]. Pharmacotherapy, 2007, 27: 191-199.
[2]Liu CP, Weng LC, Tseng HK, et al. Cefotaxime-resistantCitrobacterfreundiiin isolates from blood in a tertiary teaching hospital in Northern Taiwan[J]. J Infect, 2007, 55: 363-368.
[3]Dervisoglu E, Yumuk Z, Yegenaga I.Citrobacterfreundiiperitonitis and tunnel infection in a patient on continuous ambμlatory peritoneal dialysis[J]. J Med Microbiol, 2008, 57: 125-127.
[4]Bai L, Xia SL, Lan RT, et al. Isolation and characterization of cytotoxic, aggregativeCitrobacterfreundii[J]. PLoS One, 2012, 7 (3): e33054. DOI: 10.1371/journal.pone.0033054
[5]Pereira AL, Silva TN, Gomes AC, et al. Diarrhea-associated biofilm formed by enteroaggregativeEscherichiacoliand aggregativeCitrobacterfreundii: a consortium mediated by putative F pili[J]. BMC Microbiol, 2010, 10: 57. DOI: 10.1186/1471-2180-10-57
[6]Miao EA, Andersen-Nissen E, Warren SE, et al. TLR5 and Ipaf: dual sensors of bacterial flagellin in the innate immune system[J]. Semin Immunopathol, 2007, 29 (3): 275-288.
[7]Vijay-Kumar M, Gewirtz AT. Flagellin: key target of mucosal innate immunity[J]. Mucosal Immunol, 2009, 2 (3): 197-205. DOI: 10.1038/mi.2009.9
[8]Simon R, Samuel CE. Interleukin-1 beta secretion is activated comparably by FliC and FljB flagellins but differentially by wild-type and DNA adenine methylase-deficient salmonella[J]. J Interferon Cytokine Res, 2008, 28 (11): 661-666. DOI: 10.1089/jir.2008.0022
[9]He Y, Xu T, Fossheim LE, et al. FliC, a flagellin protein, is essential for the growth and virulence of fish pathogenEdwardsiellatarda[J]. PLoS One, 2012, 7 (9): e45070.
[10]Badea L, Beatson SA, Kaparakis M, et al. Secretion of flagellin by the LEE-encoded type III secretion system of enteropathogenicEscherichiacoli[J]. BMC Microbiol, 2009, 9: 30. DOI: 10.1186/1471-2180-9-30
[11]Uchiya K, Nikai T. Salmonella virulence factor SpiC is involved in expression of flagellin protein and mediates activation of the signal transduction pathways in macrophages[J]. Microbiology, 2008, 154 (Pt 11): 3491-3502. DOI: 10.1099/mic.0.2008/021667-0
[12]Rogers TJ, Paton JC, Wang H, et al. Reduced virulence of an fliC mutant of Shiga-toxigenic Escherichia coli O113:H21[J]. Infect Immun, 2006, 74 (3): 1962-1966.
[13]Auvray F, Thomas J, Fraser GM, et al. Flagellin polymerisation control by a cytosolic export chaperone[J]. J Mol Biol, 2001, 308(2): 221-229.
[14]Cong Y, Wang J, Chen Z, et al. Characterization of swarming motility inCitrobacterfreundii[J]. FEMS Microbiol Lett, 2011, 317(2): 160-171. DOI: 10.1111/j.1574-6968.2011.02225.x
[15]Capdevila S, Martinez-Granero FM, Sanchez-Contreras M, et al. Analysis ofPseudomonasfluorescensF113 genes implicated in flagellar filament synthesis and their role in competitive root colonization[J]. Microbiology, 2004, 150(Pt 11): 3889-3897.
[16]Olsen JE, Hoegh-Andersen KH, Casadesus J, et al. The role of flagella and chemotaxis genes in host pathogen interaction of the host adaptedSalmonellaentericaserovar Dublin compared to the broad host range serovarS.typhimurium[J]. BMC Microbiol, 2013, 13: 67. DOI: 10.1186/1471-2180-13-67
[17]Marchetti M, Sirard JC, Sansonetti PJ, et al. Interaction of pathogenic bacteria with rabbit appendix M cells:Bacterial motility is a key feature in vivo[J]. Microbes Infect, 2004, 6(6): 521-528.
[18]Krukonis ES, Rita VJ. From motility to virulence: Sensing and responding to environmental signals inVibriocholerae[J]. Curr Opin Microbiol, 2003, 6(2): 186-190.
[19]Arora SK, Neely AN, Blair B, et al. Role of motility and flagellin glycosylation in the pathogenesis ofPseudomonasaeruginosabum wound infections[J]. Infect Immun, 2005, 73(7): 4395-4398.
FliS function inC.freundiistrain CF74
LIU Li-yun1,HAO Shuai2,SUN Hui1
(1.StateKeyLaboratoryforCommunicableDiseasePreventionandControl,InstituteforCommunicableDiseasePreventionandControl,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China; 2.KeyLaboratoryofCellProliferationandRegulationBiologyMinistryofEducation,BeijingNormalUniversity,UniversitiesConfederatedInstituteofProteomics,Beijing100875,China)
FliS as an export chaperone contributes to stabilization of flagellin subunit interactions during polymerisation. ThefliSmutant leads to most of the FliC protein being accumulated in inclusion bodies formed inside the cell cytoplasm.C.freundiistrain CF74 has a complete flagellar system. To analyze FliS function in CF74, we constructed deletion mutant offliSand complementation in CF74 and analysed its effects on the swimming motility, adherence and cytotoxicity. CF74ΔfliSmutant was found to be no motile, and motility was restored by CF74pfliS. Moreover, CF74ΔfliSmutant was defective in adhesion and cytotoxicity to THP1 cells and restored upon complementation. Significant differences between wild type and CF74△fliSmutant were shown withP<0.01. The band of FliC in CF74ΔfliSmutant was weak by immunoblot analysis of FliC protein in the culture supernatant prepared from CF74 and CF74ΔfliSmutant grown in LB. These results suggested that the FliS in CF74 enhances motility, involves in the adherence to host cells, and induces cytotoxicity to host cells.
C.freundii; CF74ΔfliS; motility; adhesion; cytotoxicity
国家自然基金项目(No.81301401);传染病预防控制国家重点实验室面上项目(No.2011SKLID209)联合资助
1.中国疾病预防控制中心传染病预防控制所,传染病预防控制国家重点实验室,北京 102206; 2.北京师范大学细胞增殖与调控教育部重点实验室,高等学校蛋白质组学研究院,北京 100875; Email:liuliyun@icdc.cn
Supported by grants from the National Natural Science Foundation of China (No. 81301401) and the Project of State Key Laboratory for Infectious Disease Prevention and Control (No. 2011SKLID209)
10.3969/cjz.j.issn.1002-2694.2015.06.003
R378.2
A
1002-2694(2015)06-0506-05
2014-10-08;
2014-11-28
