云南省猪戊型肝炎病毒全基因组扩增及进化分析
2015-05-04杨臣臣龙飞燕毕艳红李云龙禹文海井申荣
杨臣臣,龙飞燕,毕艳红,李云龙,王 珏,禹文海,井申荣,黄 芬
云南省猪戊型肝炎病毒全基因组扩增及进化分析
杨臣臣,龙飞燕,毕艳红,李云龙,王 珏,禹文海,井申荣,黄 芬
目的 对猪戊型肝炎病毒全长基因组进行扩增,分析其进化关系,为HEV的感染性克隆研究奠定基础。方法 利用巢式逆转录聚合酶链反应(RT-nPCR)和RACE技术对猪粪便中HEV样品进行全基因组扩增,利用DNAStar和MEGA4.0软件进行同源性比较和进化树分析。结果 RT-nPCR方法扩增出HEV的 5段目的基因序列和RACE技术扩增出HEV的 5′和3′端,序列比对结果正确,HEV全长扩增成功。同源性分析显示其与新疆株(GU119961)同源性较高(96.1%)。系统进化树显示该病毒属于基因4型h亚型猪HEV。结论 HEV全基因组序列扩增成功,为深入研究HEV奠定基础。
猪戊型肝炎病毒;巢式逆转录PCR;全长基因组分析
戊型肝炎病毒(hepatitis E virus, HEV),是一种经肠道传播,严重危害人类健康的病毒性肝炎病原体[1]。HEV主要经过粪-口途径传播,食用HEV污染的水源和食物是导致HEV暴发流行的主要原因[2-3]。戊型肝炎病毒对孕妇和胎儿危害尤为严重,极易造成胎儿早产、流产和死胎,妊娠晚期感染HEV后死亡率高达25%[4-7]。我国1986-1988年新疆地区HEV大流行造成20多万人发病,死亡707人(孕妇414人),是迄今为止世界上最大的HEV流行[8]。
根据HEV基因组全序列的差异,可以将戊型肝炎病毒不同毒株分为4个主要的基因型:基因1型、基因2型、基因3型和基因4型[9-10]。新发现的禽HEV与其他4种基因型差异较大,成为一种新的基因型,命名为禽HEV[11]。2009年Zhao等在家兔上分离到的HEV株与已知的4种HEV基因型和禽HEV同源性均较低,是一种能感染兔子的新HEV基因型[12]。而鼠HEV是在德国挪威大鼠体内分离得到[13-14]。
云南省以旅游产业为主,流动人口较大,卫生条件相对落后,至今还保留着生食猪肉的风俗,并且很多地方仍直接饮用不经消毒处理的露天生水,这增加HEV的流行暴发的可能。但是到目前为止,关于云南省HEV的分子流行调查较少,仅有2009年李文贵等对昆明地区屠宰场猪肉产品中HEV的感染情况进行过初步的调查[[15]。在2010年,我们对云南省农村猪群中HEV的流行情况进行了调查,发现在猪群中存在较高的HEV感染率(阳性率为10.26%)[[16]。本文通过选取其中一株阳性HEV样本,进行HEV的全基因组扩增,并对其同源性和进化关系进行分析,为后续HEV研究奠定基础。
1 材料和方法
1.1 样品采集与处理 猪HEV粪便样本,采用0.1% DEPC处理的PBS缓冲液(PBS缓冲液,NaCl 137 mmol/L,KCl 2.7 mmol/L,Na2HPO410 mmol/L,KH2PO42 mmol/L,pH7.2~7.4)重悬粪便样本,离心力12 000 g离心15 min,收集上清,-80 ℃保存。
1.2 RT-nPCR法检测HEV RNA 利用Trizol(Invitrogen)RNA提取试剂盒提取粪便上清总RNA,并进行逆转录合成cDNA链。逆转录试剂采用TaKaRa公司AMV逆转录试剂盒,操作按试剂盒说明书进行。RT-nPCR引物序列为人和猪HEV的兼并引物,可以扩增人和猪HEV的所有序列,引物序列如表1[[17]。反应参数为:42 ℃ 30 min,95 ℃ 5 min。利用合成cDNA进行巢式PCR,扩增HEV衣壳蛋白ORF2区域部分片段(348 bp)。PCR产物用1%琼脂糖凝胶电泳检测目的条带。
1.3 HEV基因序列全长扩增 利用QIAamp Viral RNA Mini Kit(QIAGEN)试剂盒提取HEV阳性样品(27#)总RNA,利用PrimeScriptTMOne Step RT-PCR Kit Ver.2试剂盒扩增HEV的全基因组序列。全基因组序列分为5段进行扩增,F1片段大小为1 285 bp,F2片段大小为1 603 bp,F3片段大小为1 339 bp,F4片段大小为1 236 bp,F5片段大小为1 932 bp,引物序列如表1[1]。PCR反应参数为:50 ℃ 30 min,95 ℃ 3 min,95 ℃ 30 s,50 ℃ 30 s,72 ℃ 3 min。PCR循环参数:35循环。HEV 5′和3′端分别采用5′-Full RACE Kit with ATP和3′-Full RACE Core set with PrimeScriptTMRTase试剂盒进行扩增,5′和3′端片段大小分别为501 bp和936 bp,反应条件参照说明书。具体为:外套95 ℃ 3 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min;PCR循环参数:20循环;72 ℃延伸10 min。内套:95 ℃ 3 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min;PCR循环参数:25循环;72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳检测目的条带。目的条带胶回收纯化后进行克隆和测序。

cPrimersequence(5′⁃3′)ProductLength/bpReferenceS11AGGCTCCTGGCRTYACTACTGF11285[17]A12GCGGCACTGGGCRTAAAACTHEV⁃A3GAAAAGTCTGGCCGTGATTACF21603ThisstudyHEV⁃B2TCCTCAGTAATAGTAAGGGCHEV⁃C3GCCAGCCATAGCTTGGTTTGAAGF31339ThisstudyD3RCTGGAAGAATGTTATACGAGACACD4FATGGTGGAGAAAGGCCAGGATF41236ThisstudyER2GAAGGGGTTGGTTGGATGAATEF1TTTCTGGGGTGACCGGGTTGATTF51932ThisstudyHEV31CAGGGAGCGCGGAACGCAGAAAAGA5′Race⁃A1GCAGTGARTARAGYGCAAYCCCHGTCT5′RACE501[17]5"Race⁃A2CGRGCCATYGCCTCNGCRACATC3′Race⁃S1ACYACNACTGCTGCYACACGBTTYATGA3′RACE9363′Race⁃S2CTYTGTTYAAYCTTGCTGAYACGCTKCTCHEV1AATTATGCC(T)CAGTAC(T)CGG(A)GTTGHEVdetection348[16]HEV2CCCTTA(G)TCC(T)TGCTGA(C)GCATTCTCHEV3GTT(A)ATGCTT(C)TGCATA(T)CATGGCTHEV4AGCCGACGAAATCAATTCTGTC
1.4 HEV同源性和进化分析 采用SeqMan软件对HEV的5个片段和5′和3′RACE进行拼接,HEV全基因组序列进行Blast核苷酸序列比对分析,并提交GeneBank数据库(KJ155502)。采用DNAStar软件和Megalign软件对其分别进行同源性分析和系统进化分析。HEV基因型分析所采用的参照序列为:基因1型为NC001434和M80581;基因2型为M74506;基因3型为JN906975和AB089824;基因4型为GU206559。其中基因4型亚型分析采用的参照序列为:a亚型为AF117275和AJ344171;b亚型为AB124818和AJ344186;c亚型为AB082545;d亚型为AJ344181和AY596308;e亚型为AF324501;g亚型为AB108537;h亚型为JN542514和KF703731。
2 结 果
2.1 猪HEV RT-nPCR检测 PCR产物经1%琼脂糖凝胶电泳分析,如图1,目的片段和理论大小348 bp相一致。PCR产物连接 pMD18-T载体,进行序列测定,Blast分析显示该病毒属于基因4型猪HEV。

1~5:样品编号;6:阴性对照;M:DL2000 marker
1-5: number of samples; 6: negative control; M: DNA Marker DL2000.
图1 RT-nested PCR产物电泳结果
Fig.1 Agarose gel electrophoresis of HEV gene fragment amplified by RT-nested PCR
2.2 猪HEV全长基因组序列扩增及分析 HEV全基因组序列分为5部分进行PCR扩增,取产物经1%琼脂糖凝胶电泳分析,5个目的片段和理论大小相一致,结果如图2。HEV 5′和3′端扩增结果与理论大小一致,如图3。PCR产物连接pMD18-T载体,进行序列测定,经Blast分析显示结果正确,猪HEV全长扩增成功。HEV全基因组序列提交GenBank数据库,序列号为KJ155502。
本实验分离的HEV病毒株基因组全长为7 240 bp(除去Pol(A)部分),GC含量为55%。5′端为1 bp-26 bp,开放阅读框1(ORF1)为27 bp-5 150 bp,开放阅读框2(ORF2)为5 147 bp-7 171 bp,开放阅读框3(ORF3)为5 175 bp-5 519 bp,3′端为7 172 bp-7 264 bp,其ORF1和ORF2有3个碱基的重叠, ORF3与和ORF2完全重叠。
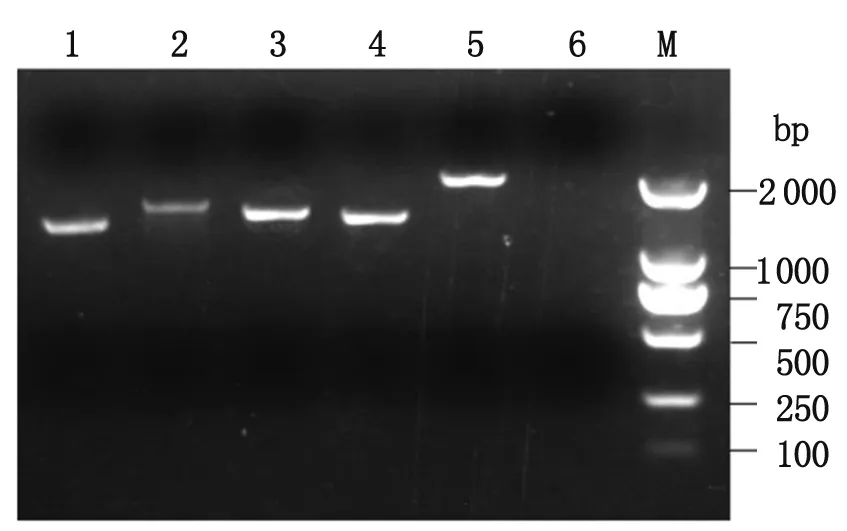
1:F1片段2:F2片段3:F3片段4:F4片段;5:F5片段;6:阴性对照;M:DL2000 marker
1: F1 fragment; 2: F2 fragment; 3: F3 fragment; 4: F4 fragment; 5: F5 fragment; 6: negative control; M: DNA Marker DL2000.
图2 猪HEV全长基因组序列PCR扩增
Fig.2 Agarose gel electrophoresis of HEV complete sequences fragment amplified by PCR

1:5′RACE PCR;2:3′RACE PCR 3:阴性对照;M:DL2000 marker
1: 5′RACE PCR; 2: 3′RACE PCR; 3: negative control; M: DL2000 marker.
图3 猪HEV基因组5′RACE和3′RACE PCR扩增
Fig.3 Agarose gel electrophoresis of HEV 5′RACE and 3′RACE sequences fragment amplified by PCR
2.3 猪HEV全长基因组序列同源性和系统进化分析 全长基因组同源性分析显示,该毒株与HEV 1型、2型、3型和4型的同源性为39.1%~96.1%。与2009年分离自新疆(GU119961)、武汉(GU188851)和2011年分离自南京(JQ740781)的同源性最高分别为96.1%、95.7%和95.5%;与1993年分离自墨西哥的人HEV(M74506,基因2型)同源性最低(39.1%),如图4。
基于HEV ORF2部分序列(348 bp)的系统进化分析显示,本实验分离毒株(KJ155502)属于基因4型h亚型猪HEV,与2011年分离自云南的猪HEV(JN613156)、2009年分离自新疆的猪HEV(GU119961)、2009年分离自武汉的猪HEV(GU188851)和2011年分离自南京的人HEV(JQ740781)亲缘关系较近,如图5。

图4 HEV全基因组序列同源性分析(%)
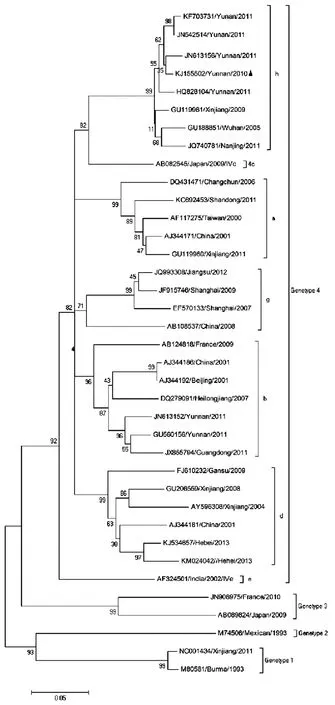
图5 HEV部分ORF2序列系统进化分析
Fig.5 Phylogenetic analysis base on HEV ORF2 partial sequence
3 讨 论
猪HEV病毒是一种人兽共患病毒,猪是HEV的主要宿主,不卫生的饮食习惯和人畜相互接触都会引起HEV的传播感染。近几年,在中国,基因4型HEV已经代替基因1型成为优势基因型[21]。本实验中分离的HEV病毒株全长核苷酸序列与基因4型猪HEV的同源性最高,为84.4%~96.1%。该毒株与2011李文贵等分离自云南的基因4型h亚型猪HEV毒株(JN613156)同源性较最高[20]。同时李文贵等在云南猪群中还分离到HEV基因4型b亚型(JN613152),这说明在云南地区至少存在b和h两种亚型。本实验分离的猪HEV毒株与新疆、武汉和南京等地的HEV同源关系较近,同属于h亚型,这可能与云南省是一个旅游大省有关。因此,一旦出现HEV污染水源或食物,将可能会导致HEV的暴发流行。本次实验初步分析了云南省昆明地区猪HEV的序列特征,丰富了HEV进化和分子流行病学的内容,为HEV防治及HEV感染性克隆研究奠定基础。
[1]Radha Krishna Y, Saraswat VA, Das K, et al. Clinical features and predictors of outcome in acute hepatitis A and hepatitis E virus hepatitis on cirrhosis[J]. Liver Int, 2009, 29(3): 392-398. DOI: 10.1111/j.1478-3231.2008.01887.x
[2]Banks M, Martelli F, Grierson S, et al. Hepatitis E virus in retail pig livers[J]. Vet Rec, 2010, 166(1): 29. DOI: 10.1136/vr.b5602
[3]Feagins AR, Opriessnig T, Guenette DK, et al. Detection and characterization of infectious Hepatitis E virus from commercial pig livers sold in local grocery stores in the USA[J]. J Gen Virol, 2007, 88(Pt 3): 912-917. DOI: 10.1099/vir.0.82613-0
[4]Xu J, Wu F, Tian D, et al. Open reading frame 3 of genotype 1 hepatitis E virus inhibits nuclear factor-kappaappa B signaling induced by tumor necrosis factor-alpha in human A549 lung epithelial cells[J]. PLoS One, 2014, 9(6): e100787. DOI: 10.1371/journal.pone.0100787
[5]Kumar A, Beniwal M, Kar P, et al. Hepatitis E in pregnancy[J]. Int J Gynaecol Obstet, 2004, 85(3): 240-244. DOI: 10.1016/j.ijgo.2003.11.018
[6]Devhare PB, Chatterjee SN, Arankalle VA, et al. Analysis of antiviral response in human epithelial cells infected with hepatitis E virus[J]. PLoS One, 2013, 8(5): e63793. DOI: 10.1371/journal.pone.0063793
[7]Chandra V, Holla P, Ghosh D, et al. The hepatitis E virus ORF3 protein regulates the expression of liver-specific genes by modulating localization of hepatocyte nuclear factor 4[J]. PLoS One, 2011, 6(7): e22412. DOI: 10.1371/journal.pone.0022412
[8]Huang RT, Li DR, Wei J, et al. Isolation and identification of hepatitis E virus in Xinjiang, China[J]. J Gen Virol, 1992, 73(Pt 5): 1143-1148. DOI: 10.1099/0022-1317-73-5-1143
[9]Okamoto H. Hepatitis E virus cell culture models[J]. Virus Res, 2011, 161(1): 65-77. DOI: 10.1016/j.virusres.2011.01.015
[10]Aggarwal R, Jameel S. Hepatitis E[J]. Hepatology,2011, 54(6): 2218-2226. DOI: 10.1002/hep.24674
[11]Haqshenas G, Shivaprasad HL, Woolcock PR, et al. Genetic identification and characterization of a novel virus related to human hepatitis E virus from chickens with hepatitis-splenomegaly syndrome in the United States[J]. J Gen Virol, 2001, 82(Pt 10): 2449-2462.
[12]Geng J, Wang L, Wang X, et al. Study on prevalence and genotype of hepatitis E virus isolated from Rex Rabbits in Beijing, China[J]. J Viral Hepat, 2011, 18(9): 661-667. DOI: 10.1111/j.1365-2893.2010.01341.x
[13]Zhang W, Shen Q, Hua X, et al. Novel hepatitis E virus genotype in Norway rats, Germany[J]. Emerg Infect Dis, 2011, 17(10): 1981-1983. DOI: 10.3201/eid1710.101399
[14]Johne R, Heckel G, Plenge-Bonig A, et al. Novel hepatitis E virus genotype in Norway rats, Germany[J]. Emerg Infect Dis, 2010, 16(9): 1452-1455. DOI: 10.3201/eid1609.100444
[15]Li WG, She RP, Li RW, et al. Investigation of swine hepatitis E virus infection in the slaughtered swine in Kunming of Yunnan Province[J]. China Vet Sci, 2010, 40(6): 636-641. (in Chinese) 李文贵,佘锐萍,李睿文,等. 昆明屠宰猪戊型肝炎病毒感染情况的调查[J].中国兽医科学,2010, 40(6): 636-641.
[16]Huang F, Yun WH, Ma TW, et al. Molecular epidemiology of swine hepatitis E virus in a village of Yunnan[J]. Chin J Zoonoses, 2012, 28(3): 274-277. (in Chinese) 黄芬,禹文海,马天武,等.云南省某农村猪戊型肝炎病毒分子流行病学调查[J].中国人兽共患病学报, 2012, 28(3): 274-277.
[17]Huang, FF, Haqshenas G, Guenette, DK, et al. Detection by reverse transcription-PCR and genetic characterization of field isolates of swine hepatitis E virus from pigs in different geographic regions of the United States[J]. J Clin Microbiol, 2002, 40: 1326-1332. DOI: 10.1128/JCM.40.4.1326-1332.2002
[18]Fu H, Wang L, Zhu Y, et al. Analysing complete genome sequence of swine hepatitis E virus (HEV), strain CHN-XJ-SW13 isolated from Xinjiang, China: putative host range, and disease severity determinants in HEV[J]. Infect Genet Evol, 2011, 11(3): 618-623. DOI: 10.1016/j.meegid.2011.01.018
[19]Liang JR, Wei XF, Xue C, et al. Genotype and subgenotype of swine HEV[J]. Chin J Microbiol Immunol, 2007, 27(8): 747-750. (in Chinese) 梁靖瑞,韦献飞,薛城,等.猪HEV基因型和亚型的研究[J].中华微生物学和免疫学杂志, 2007, 27(8):747-750.
[20]Shu X, Duan X, Song C, et al. Genetic heterogeneity of swine hepatitis E virus isolates from Yunnan province[J]. Virol J, 2014, 11: 162. DOI: 10.1186/1743-422X-11-162
[21]Zhang W, He Y, Wang H, et al. Hepatitis E virus genotype diversity in eastern China[J]. Emerg Infect Dis, 2010, 16: 1630-1632. DOI: 10.3201/eid1610.100873
Huang Fen, Email: huangfen6789@163.com
Amplification and evolution analysis on full-length genome of swine hepatitis E virus
YANG Chen-chen,LONG Fei-yan,BI Yan-hong,LI Yun-long, WANG Jue,YU Wen-hai,JING Shen-rong,HUANG Fen
(MedicalFaculty,KunmingUniversityofScienceandTechnology,Kunming650500,China)
To analyze the evolution trend and make a foundation for researching the infectious clone of swine Hepatitis E Virus (HEV), complete genome sequences of swine HEV was amplified by Reverse transcription nested PCR (RT-PCR). The homology and phylogenetic tree were analyzed by DNAStar and MEGA4.0 software, respectively. Results indicated that the full-length genome of swine HEV was successfully amplified by RT-nPCR and RACE. The homology analysis indicated that the swine HEV shared the highest homologies (96.1%) with swine HEV isolated from Xinjiang (GU119961). The phylogenetic tree suggested that this isolate belonged to swine HEV 4h sub-genotype.
swine hepatitis E virus; RT-nPCR; complete genome sequences analysis
国家自然科学基金资助(No.31360619);云南省自然科学基金(No.2013FB032,2011FZ068);中国博士后科学基金(No.2014M562672)资助,杨臣臣和龙飞燕同等贡献。
黄芬,Email:huangfen6789@163.com
昆明理工大学医学院,昆明 650500
Supported by the Natural Science Foundation of China (No. 31360619), the Natural Science Foundation of Yunnan Province in China (Nos. 2011FZ068 and 2013FB032), and the China Postdoctoral Science Foundation(No. 2014M562672)
10.3969/cjz.j.issn.1002-2694.2015.06.011
R373.2
A
1002-2694(2015)06-0547-05
2015-01-29;
2015-03-30
