鸡传染性法氏囊病病毒BC6/85株VP2基因的原核表达、纯化及鉴定
2015-04-27刘丹杨承槐吴华伟李启红高金源陈建郎洪武
刘丹,杨承槐,吴华伟,李启红,高金源,陈建,郎洪武
(中国兽医药品监察所,北京100081)
鸡传染性法氏囊病病毒BC6/85株VP2基因的原核表达、纯化及鉴定
刘丹,杨承槐,吴华伟,李启红,高金源,陈建,郎洪武∗
(中国兽医药品监察所,北京100081)
为获得可用于鸡传染性法氏囊病病毒(IBDV)抗体检测的重组抗原VP2蛋白,根据GenBank中发表的IBDV VP2序列设计一对特异性引物,应用RT-PCR技术克隆IBDV经典标准攻毒株(BC6/85株)的VP2基因,插入质粒pET-32a中构建重组表达质粒pET-32a-VP2,经IPTG诱导后获得了以包涵体形式表达的重组蛋白。重组蛋白纯化后,Western-blot检测表明具有良好的反应原性。本研究为下步建立IBDV抗体的间接ELISA方法及新型疫苗的研制奠定了基础。
鸡传染性法氏囊病病毒;VP2基因;克隆;原核表达
鸡传染性法氏囊病病毒(Infectious Bursal Disease Virus,IBDV)属于双RNA病毒科,其基因组由A和B两个双链RNA片段组成,编码5种病毒蛋白,分别为VP1、VP2、VP3、VP4和VP5[1]。其中VP2是IBDV的主要结构蛋白和宿主保护性抗原,含有能诱导中和抗体的抗原决定簇,其诱导产生的中和抗体能被动地保护宿主免受IBDV的感染[2-3],VP2还与病毒毒力、病毒抗原变异及细胞凋亡等有关[4-5],已成为近年来众多学者研究的热点。
众多研究人员利用VP2的免疫原性研究抗IBD的基因工程疫苗,已经在大肠杆菌、重组杆状病毒、酵母等诸多表达系统中,成功表达VP2蛋白[6-8]。这些表达系统表达的VP2蛋白都能诱导产生较高的中和抗体,并且国内已有商品化的基因工程亚单位疫苗[9],但利用VP2建立相关检测方法的研究却甚少。为了建立监测IBDV抗体的ELISA方法和研究VP2蛋白的免疫原性,本试验对IBDV经典标准攻毒株(BC6/85株)的VP2基因进行克隆并构建其原核重组表达载体,进行诱导表达、纯化和鉴定,旨在获得可用于IBDV抗体检测的重组抗原VP2蛋白,为IBDV抗体检测方法的建立和基因工程疫苗的研究提供基础。
1 材料与方法
1.1 材料
1.1.1 病毒、细菌和载体 IBDV BC6/85株,由中国兽医药品监察所菌种保藏中心提供;E.coli TOP10感受态细胞,购于天根生化科技有限公司;Rosetta(DE3)感受态细胞,购于康为世纪生物科技有限公司;pMD18-T载体,购于大连宝生物工程有限公司;pET-32a载体由本实验室保存。
1.1.2 主要试剂 Ex Taq DNA聚合酶、dNTPs、EcoR Ι、Xho Ι、Marker DL2000、Marker DL15000,2×SDS-PAGE loading buffer,蛋白Marker,均购自大连宝生物工程有限公司;质粒提取试剂盒、胶回收试剂盒、Trizol®Reagent试剂盒均购自天根生化科技有限公司;Donkey anti-chicken IgY购自康为世纪生物科技有限公司;IPTG为Sigma公司产品。其他化学试剂均为分析纯级试剂。
1.2 方法
1.2.1 引物的设计与合成 根据GenBank中发表的IBDV基因组序列,利用引物设计软件Primer 5.0设计一对特异性引物,由北京Invitrogen公司合成。上游引物P1:CGAATTCATGACAAACCTG⁃CAAGAT,下游引物P2:CCGCTCGAGTCACCT⁃ TAGGGCCCGGATTAT,为方便目的基因的克隆及表达,在上、下游引物的5’端分别引入EcoR Ι和Xho Ι酶切位点(以下划线指示),VP2基因的扩增长度约为1356 bp。
1.2.2 IBDV总RNA的提取 按照Trizol®Reagent试剂盒说明书提取病毒总RNA。
1.2.3 IBDV VP2基因的RT-PCR扩增 按照反转录试剂盒说明书进行第一链cDNA的合成。以cDNA为模板,进行PCR扩增,反应体系如下:10×PCR buffer 5 μL,dNTPs(2.5 mmol/L each)4 μL,P1和P2引物(浓度均为10 μmol/L)各1 μL,cDNA模板5 μL,Ex Taq DNA聚合酶0.5 μL,补加ddH2O至50 μL。反应条件为:95℃预变性5 min;94℃30 s,52℃45 s,72℃45 s,共30个循环;72℃10 min。反应结束后取5 μL进行琼脂糖凝胶电泳,观察扩增结果。PCR产物经琼脂糖凝胶电泳后,用DNA回收试剂盒回收预期的目的片段。
1.2.4 IBDV VP2基因的克隆与鉴定 将回收的目的片段连接到pMD18-T载体上,转化TOP10感受态细胞,获得重组质粒pMD18T-VP2。将PCR和酶切鉴定均正确的重组质粒送Invitrogen公司测序。
1.2.5 原核表达载体的构建与鉴定 将阳性重组质粒pMD18T-VP2用EcoR Ι和Xho Ι双酶切后回收并纯化,与同样双酶切的原核载体pET-32a进行连接,得到重组原核表达载体pET-32a-VP2,经PCR和酶切鉴定正确后,送Invitrogen公司测序。
1.2.6 pET-32a-VP2的诱导表达与条件优化 将重组质粒pET-32a-VP2转化至表达菌株Rosetta(DE3),挑取单个菌落接种含Amp+的LB培养基中,37℃培养至OD600=0.8时,加入IPTG至终浓度为1 mmol/L,在诱导后1、2、3、4、5、6 h分别取出1 mL,离心2 min收集菌体,用PBS重悬沉淀,加入等体积2×SDS上样缓冲液,水浴煮沸10 min,进行SDS-PAGE凝胶电泳以确定IPTG的最佳诱导时间。
分别取1 mL培养物5份,加入IPTG至终浓度分别为0.1、0.5、1.0、2.0、4.0 mmol/L,按上法进行诱导表达和处理,SDS-PAGE检测表达情况,以确定IPTG的最佳诱导浓度;在IPTG浓度为1 mmol/L时,在25℃、30℃和37℃分别对重组菌进行诱导表达,诱导时间为5 h,以确定最佳诱导温度。
1.2.7 重组蛋白的纯化和鉴定 重组菌按优化好的条件进行诱导表达后,离心收集菌体,超声波裂解菌体,分别收集上清及沉淀进行SDS-PAGE蛋白电泳,确定表达产物是可溶性蛋白还是包涵体蛋白。对重组蛋白进行过柱纯化,纯化步骤参考王倩倩等方法[10]。应用Western-blot鉴定纯化的重组蛋白,步骤如下:将纯化的蛋白进行SDS-PAGE电泳,转印2 h,封闭2 h;PBST洗涤3次,加入PBS稀释的鸡传染性法氏囊病阳性血清(1∶500稀释)或His单抗,作用1 h;PBST洗涤3次,加入1∶10000稀释的Donkey anti-chicken IgY或HRP标记的羊抗鼠二抗,作用1 h;PBST洗涤3次,用TMB显色试剂盒进行显色,观察结果。
2 结果
2.1 VP2基因的RT-PCR扩增 应用所设计的特异性引物对IBDV BC6/85株的VP2基因进行RT-PCR扩增,得到一条长度约为1356 bp的目的条带(图1),与预期片段大小一致。
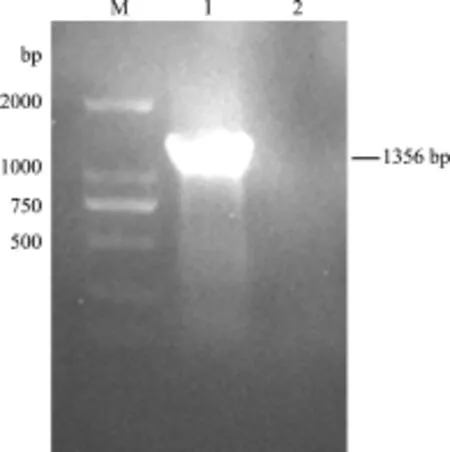
图1 IBDV BC6/85株VP2基因的RT-PCR扩增
2.2 pMD18T-VP2的PCR和酶切鉴定 将重组质粒pMD18T-VP2进行PCR鉴定,可扩增出1356 bp大小的特异片段;经EcoR Ι和Xho Ι双酶切鉴定,可获得与预期大小一致的片段(图2)。将PCR和酶切鉴定正确的重组质粒送Invitrogen公司测序,测序结果表明,成功构建了pMD18T-VP2重组质粒。

图2 pMD18T-VP2的PCR和酶切鉴定
2.3 VP2基因原核表达载体的构建与鉴定 将经PCR初步鉴定为阳性的重组原核表达载体pET-32a-VP2,再以EcoR Ι和Xho Ι对其进行双酶切鉴定,结果显示出现两条条带,一条为约5900 bp的载体片段,一条约为1356 bp大小的目的基因片段(图3),对重组质粒的测序结果表明原核重组表达质粒构建成功。

图3 pET-32a-VP2的PCR和酶切鉴定
2.4 pET-32a-VP2的诱导表达与条件优化
2.4.1 最佳诱导时间的确定 将重组质粒pET-32a-VP2转化至表达菌株Rosetta(DE3),进行诱导表达,SDS-PAGE结果表明,诱导5 h时表达量最高(图4)。
2.4.2 IPTG诱导浓度的确定 由图5可知,IPTG浓度在1 mmol/L时,表达量最高,故确定该浓度为最佳诱导浓度。
2.4.3 最佳诱导温度的确定 在25、30和37℃分别对重组菌进行诱导表达,SDS-PAGE结果显示在37℃时表达量最高,确定为最佳的诱导温度(图6)。
2.5 重组蛋白纯化及鉴定
2.5.1 重组蛋白可溶性分析结果 重组菌在37℃、1 mmol/L IPTG诱导表达5 h,离心收集菌体,超声波裂解菌体,分别收集上清及沉淀进行SDS-PAGE蛋白电泳,由图7可以看出,在上清中未见预期蛋白条带,在沉淀中可见预期的蛋白条带,说明表达的蛋白主要以包涵体形式存在。
2.5.2 重组蛋白的纯化和Western-blot鉴定 用SDS-PAGE电泳鉴定纯化后的表达产物,在65 kD处得到单一的条带,与预期大小相符,表明纯化的产物为VP2蛋白(图8)。纯化的蛋白,经SDS-PAGE后,转移至硝酸纤维素膜,进行Western-blot鉴定,如图9所示,复性蛋白能分别被抗His单克隆抗体和鸡传染性法氏囊病阳性血清特异性识别,表明纯化的VP2蛋白具有良好的反应原性。
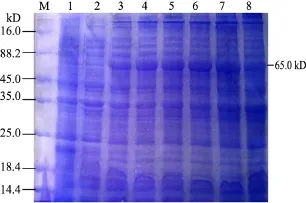
图4 pET-32a-VP2 IPTG最佳诱导时间的确定
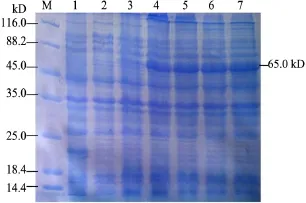
图5 pET-32a-VP2 IPTG最佳诱导浓度的确定

图6 pET-32a-VP2 IPTG最佳诱导温度的确定
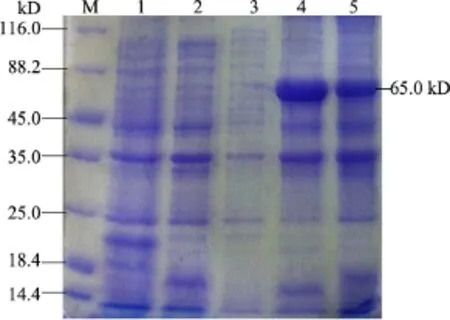
图7 pET-32a-VP2表达形式的确定
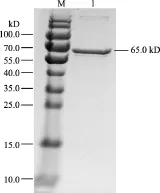
图8 纯化的VP2蛋白SDS-PAGE电泳鉴定图

图9 纯化的VP2蛋白的Western-blot鉴定图
3 讨论
血清学方法检测鸡群的IBD感染情况和鸡群免疫后的抗体水平,有利于建立免疫监测体系、进行疫苗的免疫效力评估和制定合理的免疫程序。国外已有商品化的IBDV抗体ELISA检测试剂盒,但价格昂贵不利于推广应用,国内商品化试剂盒大多以全病毒作为包被抗原,进行ELISA检测时有较强的背景反应和非特异性反应,所以利用表达的蛋白作为包被抗原,建立相关检测方法,具有广阔的应用前景。
VP2不仅是IBDV的主要结构蛋白,还是宿主保护性抗原,与中和抗体产生、病毒毒力变异及抗原漂变等有关[11],因此利用VP2来研发基因工程疫苗成为近年来的研究热点,先后研制了不同表达系统的VP2亚单位疫苗[12-14]。但利用VP2建立ELISA抗体检测方法的研究却甚少,为获得可用于IBDV抗体检测的重组抗原VP2蛋白,本研究利用大肠杆菌表达系统表达IBDV的VP2蛋白,关键问题是选择合适的表达载体和大肠杆菌表达菌株。最初构建原核表达载体,选择了pET-28a载体,转化BL21(DE3)表达菌,SDS-PAGE结果显示,表达量很低,且表达的目的条带大小与载体上条带接近,不利于区分目的条带。然后考虑使用pET-32a载体,诱导后发现在BL21(DE3)中不表达,改用表达菌株Rosetta(DE3),表达量明显提高,这可能是由于Rosetta能提供稀有密码子AUA,AGG,AGA,CUA,CCC和GGA所需的tRNA,从而提高包含稀有密码子的基因片段的表达量。
VP2蛋白表达后可观察到约65 kD的条带,与预期大小一致,这也与国内其他学者原核表达的vp2蛋白大小一致[15-16]。将表达的目的蛋白纯化后,用Western blot检测目的蛋白,一抗为鸡传染性法氏囊病阳性血清,二抗为驴抗鸡IgY,结果显示目的蛋白处出现一条特异性条带,而空载体对照则没有,进一步表明表达的目的蛋白是VP2蛋白,并且表达的重组蛋白具有良好的反应原性。本研究为下步研究VP2的免疫原性和建立IBDV抗体检测方法奠定了基础。
[1] Muller H,Islam M R,Raue R.Research on infectious bursal disease--the past,the present and the future[J].Vet Microbiol,2003,97(1/2):153-165.
[2] Fahey K J,Erny K,Crooks J.A conformational immunogen on VP-2 of infectious bursal disease virus that induces virusneutralizing antibodies that passively protect chickens[J].J Gen Virol,1989,70(6):1473-1481.
[3] Heine H G,Haritou M,Failla P,et al.Sequence analysis and expression of the host-protective immunogen VP2 of a variant strain of infectious bursal disease virus which can circumvent vaccination with standard type I strains[J].J Gen Virol,1991,72(8):1835-1843.
[4] Cao Y C,Yeung W S,Law M,et al.Molecular characterization of seven Chinese isolates of infectious bursal disease virus:classical,very virulent,and variant strains[J].Avian Dis,1998,42(2):340-351.
[5] Ona A,Luque D,Abaitua F,et al.The C-terminal domain of the pVP2 precursor is essential for the interaction between VP2 and VP3,the capsid polypeptides of infectious bursal disease virus[J].Virology,2004,322(1):135-142.
[6] Jagadish M N,Vaughan P R,Irving R A,et al.Expression and characterization of infectious bursal disease virus polyprotein in yeast[J].Gene,1990,95(2):179-186.
[7] Heine H G,Boyle D B.Infectious bursal disease virus structural protein VP2 expressed by a fowlpox virus recombinant confers protection against disease in chickens[J].Arch Virol,1993,131(3/4):277-292.
[8] 单学强,李明义,高轩.传染性法氏囊病病毒VP2基因原核表达及抗原性分析[J].动物医学进展,2012,33(5):18-21.
[9] 农业部公告第865号.鸡传染性法氏囊病基因工程亚单位疫苗[Z].
[10]王倩倩,张改平,王选年,等.IBDV VP2蛋白P22表位多肽的原核表达及初步鉴定[J].河南农业科学,2012,41(5):150-153.
[11]Brown M D,Green P,Skinner M A.VP2 sequences of recent European‘very virulent’isolates of infectious bursal disease virusare closely related to each other but are distinct from those of‘classical’strains[J].J Gen Virol,1994,75(Pt3):675-680.
[12]Macreadie I G,Vaughan P R,Chapman A J,et al.Passive protection against infectious bursal disease virus by viral VP2 expressed in yeast[J].Vaccine,1990,8(6):549-552.
[13]Francois A,Chevalier C,Delmas B,et al.Avian adenovirus CELO recombinants expressing VP2 of infectious bursal disease virus induce protectionagainstbursaldiseaseinchickens[J].Vaccine,2004,22(17/18):2351-2360.
[14]Kim S J,Sung H W,Han J H,et al.Protection against very virulent infectious bursal disease virus in chickens immunized with DNA vaccines[J].Vet Microbiol,2004,101(1):39-51.
[15]杜冬华,周静,王爱华,等.传染性法氏囊病病毒HB株VP2蛋白的表达及免疫原性测定[J].动物医学进展,2013,34(2):71-74.
[16]高玉龙,高宏雷,邓小芸,等.鸡传染性法氏囊病毒VP2基因的原核表达与抗原性分析[J].中国生物制品学杂志,2006,19(2):143-145.
(编辑:李文平)
Prokaryotic Expression,Purification and Identification of VP2 Gene of Infectious Bursal Disease Virus BC6/85 Strain
LIU Dan,YANG Cheng-huai,WU Hua-wei,LI Qi-hong,GAO Jin-yuan,CHEN Jian,LANG Hong-wu∗
(China Institute of Veterinary Drug Control,Beijing 100081,China)
In order to obtain recombinant VP2 antigen for chicken infectious bursal disease virus(IBDV)antibody detection,a pair of specific primers were designed according to the published sequence of IBDV VP2 gene.The VP2 gene was amplified by RT-PCR from IBDV BC6/85 strain and cloned into pET-32a vector,the recombinant plasmid pET-32a-VP2 was induced by IPTG to get the recombinant protein expressed in inclusion body forms.After the recombinant protein was purified,Western blot detection showed that the expressed protein had good antigenicity and could be used for IBDV antibody detection.The research provides a foundation for IBDV antibody detection research and development of new vaccines.
infectious bursal disease virus;BC6/85Strain;VP2 gene;prokaryotic expression
2014-11-25
A
1002-1280(2015)05-0017-05
S858.31
中国兽医药品监察所所级课题(201421)
刘丹,助理研究员,从事猪用疫苗检验及相关研究工作。
郎洪武,E-mail:langhongwu@ivdc.org.cn
