PRRSV HEB-2013株的分离与全基因序列分析
2015-04-27张东东刘灿龚文芝宁宜宝范学政张金亚
张东东,刘灿,龚文芝,宁宜宝∗,范学政,张金亚
(1.中国兽医药品监察所国家猪瘟参考实验室,北京100081;2.中国农业大学动物医学院,北京100193)
PRRSV HEB-2013株的分离与全基因序列分析
张东东1,刘灿2,龚文芝1,宁宜宝1∗,范学政1,张金亚1
(1.中国兽医药品监察所国家猪瘟参考实验室,北京100081;2.中国农业大学动物医学院,北京100193)
2013年9月从河北某发病猪场分离到1株猪繁殖与呼吸综合征病毒(PRRSV),将该毒株命名为HEB-2013株,在进行全基因组测序后发现,HEB-2013株基因组全长为15336 nt,包含9个开放阅读框,其中5’UTR长189 nt,3’URT长165 nt;随后将该毒株的全基因序列与NCBI上可查的历年华北地区PRRSV基因组序列进行了比对分析,发现其与2006年分离的TJ株同源性最高,为99.80%,而与2000年分离的BJ-4株同源性最低,仅为88.39%,进一步综合NSP2、GP3和GP5的氨基酸序列比对结果,系统分析了潜在毒力位点与病毒致病性的关系,并且提出了5个新的有可能与病毒致病性相关的潜在毒力位点。
猪繁殖与呼吸综合征病毒;分离;全基因序列分析;分子特征
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的猪的一种繁殖障碍和呼吸系统的传染病[1]。其特征为厌食、发热,怀孕后期发生流产,产死胎和木乃伊胎;幼龄仔猪发生呼吸系统疾病和大量死亡[2],给养猪业造成巨大的经济损失。PRRSV归属于动脉炎病毒科(Arteriviridae)动脉炎病毒属(Arterivirus),PRRSV基因组全长约为15 kb,含有至少9个开放阅读框架(ORFs),其中PRRSV的ORF1a和ORF1b编码病毒的非结构蛋白,ORF2-ORF7编码病毒的结构蛋白[3]。根据PRRSV基因的变异程度将其分为两个地理群或者基因型,即以欧洲原型病毒LV株为代表的欧洲基因型(简称Ⅰ型)和以美国原型病毒ATCC VR-2332为代表的美国基因型(简称Ⅱ型),两型病毒均具有典型的免疫抑制特性[4]。欧洲和北美分离的毒株在形态和理化性状上相似,但是用多克隆猪抗体和小鼠单克隆抗体进行血清学试验证实在抗原性上有差异[5]。PRRSV给中国的养猪业带来了巨大损失,在1996年与2006年的两次暴发尤其严重[6],之后疫情虽已获得稳定控制,但田间的流行情况仍然不容忽视。2013年河北某猪场出现不同怀孕时期的母猪大量流产,产死胎与弱胎,弱胎表现体温升高、呼吸困难以及大面积皮肤红斑,实验室诊断确诊为猪繁殖与呼吸综合征,并分离获得一株PRRSV,命名为HEB-2013株,该毒株基因组的NSP2蛋白基因中存在30个氨基酸缺失,而该基因标志广泛存在于2006年及之后中国大陆流行的高致病性PRRSV[7]。
NSP2氨基酸序列在北美洲株(VR2332)和欧洲株(LV)之间的同源性仅为32%,而且NSP2基因中含有B细胞表位免疫的优势基因;GP3是PRRSV各毒株间保守性最差的蛋白之一,在欧、美型毒株间推导氨基酸的同源率为54%~60%,而且多数变异发生在N末端;GP5为糖基化的囊膜(E)蛋白,含4个糖基化位点和一段31个氨基酸的信号肽。PRRSV不同毒株的毒力有较大差异,但毒力基因尚不十分清楚,Allende等报道PRRSV不同ORFs上有9个毒力相关的氨基酸残基[8]。
为了进一步揭示我国华北地区流行的PRRSV的基因特征和变异规律,本研究对该分离株进行了鉴定与基因组测序,并与华北地区2000年至今的27株PRRSV的基因组进行了比对分析,以期查明华北地区流行PRRSV的遗传变异特征,为防控PRRS提供有益的参考。
1 材料和方法
1.1 材料
1.1.1 细胞、病毒 Marc-145细胞由本实验室保存,病毒HEB-2013株分离于发病猪的肺脏,该研究中序列比对所用的毒株信息见表1。

表1 使用的毒株信息
1.1.2 主要试剂 RNA提取试剂盒、PrimeSTAR HS DNA Polymerase、Primescript RT Master Mix、Premix Taq HS、各种限制性内切酶、pMD18-T载体,均购自宝生物工程(大连)有限公司;凝胶回收试剂盒与质粒提取试剂盒购自OMEGA公司;研究中所用引物均由英潍捷基(上海)贸易有限公司合成;DMEM培养液与胎牛血清购自GIBCO公司。
1.2 方法
1.2.1 引物设计 参照已发表的猪繁殖与呼吸综合征病毒GD株的基因序列,设计9对扩增基因组内部片段的引物(表2),应用RACE技术对HEB-2013株的5’末端和3’末端UTR进行扩增、测序。

表2 引物及在GD株全基因序列位置
1.2.2 病毒核酸的提取与反转录 取病毒培养液,按RNA提取试剂盒使用说明书的操作方法进行病毒RNA的提取;然后把RNA反转录为cDNA。
1.2.3 目的基因分段扩增 PCR扩增体系为25 μL,Premix Taq HS 12.5 μL、dH2O 8.5 μL、上游引物1 μL、下游引物1 μL、cDNA模板2 μL,PCR循环参数为98℃10 s、52~56℃30 s、72℃1 min 30 s;72℃延伸10 min。取10 μL PCR产物进行1%琼脂糖凝胶电泳观察。
1.2.4 基因序列测定 取PCR产物进行电泳,经过纯化后连接到pMD18-T载体,经验证有目的基因插入后,送英潍捷基公司测序。
1.2.5 序列比较与分析 通过对分段完成测序的基因序列进行拼接获得PRRSV HEB-2013毒株的全基因组序列。利用DNASTAR软件将HEB-2013与华北地区2000-2010年的代表毒株进行全序列比对分析以及NSP2、GP3与GP5氨基酸比对分析,并利用MEGA软件对GenBank上收录的近年来我国华北地区PRRSV(表1)全基因序列构建遗传进化树。
2 结果
2.1 全序列测定 将测序结果拼接后获得HEB-2013株全基因序列,全长15336 bp,包含9个ORFs,5’UTR长189 nt,3’URT长165 nt。
2.2 序列同源性比较分析 HEB-2013株所有非结构蛋白和结构蛋白氨基酸序列与GeneBank收录的近年来华北地区PRRSV毒株BJ、BJ-4、HEB1、NM1、TJ、SX2007、SX-09、SX2009、09BJ、09HEB、10-10BJ-1、10-10HEB-1的同源性比较和分析,结果见表3。

表3 HEB-2013株与华北地区其他部分毒株基因组结构基因与非结构基因同源性比较

续表
2.3 遗传进化分析结果 我国华北地区近年来流行的27株PRRSV的全序列基因组进化树,如图1。

图1 我国华北地区近年来流行的PRRSV毒株系统进化树
2.4 NSP2、GP3、GP5基因氨基酸序列的比对分析
对HEB-2013株与其他毒株的NSP2基因氨基酸进行比较分析,发现近年来华北地区分离的高致病性PRRSV变异毒株在482位和第534~562位氨基酸均发生了缺失。HEB-2013株和这些高致病性毒株相同,在482位和第534~562位氨基酸也发生了缺失(图2)。GP5、GP3、基因氨基酸序列与近年来华北地区其他毒株比对结果见图3和图4。

图2 HEB-2013株与华北地区其他部分毒株Nsp2基因氨基酸序列的比较

图3 HEB-2013株与华北地区其他部分毒株GP5基因氨基酸序列的比较

图4 4 HEB-2013株与华北地区其他部分毒株GP3基因氨基酸序列的比较
2.5 毒力相关氨基酸的推测与变异分析 毒力相关氨基酸的推测结果显示9,个潜在的毒力相关氨基酸位点处,该研究所分离的HEB-2013株与华北地区近年来流行的大部分毒株完全相同,可以发现它们已经趋与稳定遗传,而这些毒株与经典强毒株BJ-4株有较大差异,9个毒力相关氨基酸中只有3个与BJ-4保持一致,见表4。
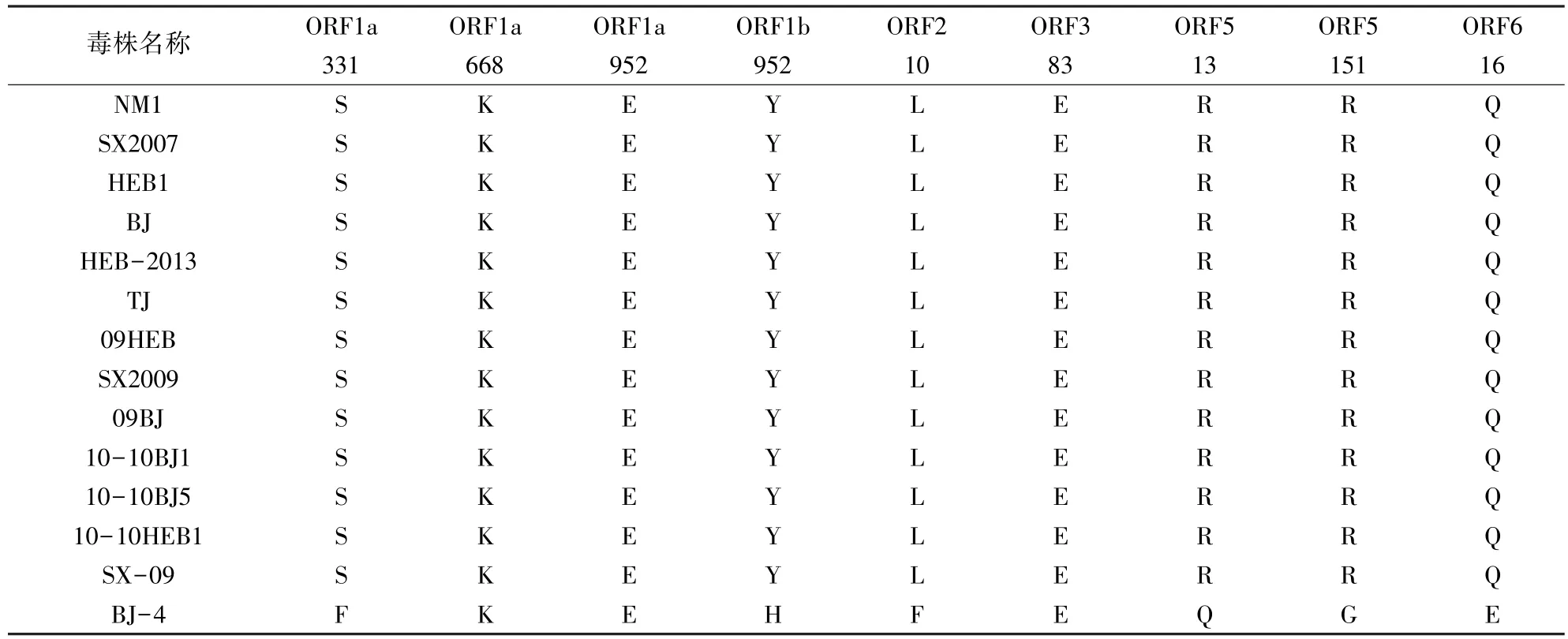
表4 毒力相关氨基酸的推测与变异分析
3 讨论
猪繁殖与呼吸综合征病毒的毒力基因尚不清楚,Byungjoon等报道,NSP3-NSP8以及ORF5是病毒毒力的主要决定区,NSP1-NSP3、NSP10-NSP12以及ORF2可能也与病毒毒力相关[11]。NSP2基因中30个氨基酸的缺失之前被猜测为该类变异的高致病性PRRSV毒力变强的原因,该研究分离的PRRSV HEB-2013株属于美洲型毒株,经过分析其全序列发现,在NSP2基因区段缺失30个氨基酸,这与近年来发现的高致病性毒株相同。但是,Zhou等通过反向遗传学的操作对推测的与毒力相关的基因进行缺失或互换,结果发现致病性PRRSV变异毒株NSP2区段中缺失的30个氨基酸与毒株的毒力无关[12]。安同庆等曾对24株PRRSV病毒的全基因组的开放阅读框逐个进行翻译比对,发现高致病性PRRSV变异株之间氨基酸同源性很高,并且遗传特征相同,推测高致病性PRRSV变异毒株来源于同一个祖先[13-14]。
此次分离到的HEB-2013株具备了和高致病性PRRSV变异株比较相似的基因特征,根据华北地区近年来流行的PRRSV全序列基因组进化树以及NSP2、GP3、GP5基因氨基酸序列比较发现,近年来我国华北地区流行的PRRSV,可以分为两个亚群,为了便于分析,我们称之为亚群1和亚群2,这两个亚群中的毒株均为高致病性毒株,分析发现,亚群1中的毒株大部分是2009年以前所分离到的,而亚群2中大部分毒株是2009年以后分离到的,该研究中分离的HEB-2013株位于亚群1,说明在我国PRRSV新的变异株不断出现的同时,其变异之前的毒株并没有消失,这对本来就很不乐观的PRRSV防控更加增添了难度。但是更进一步分析发现这两个亚群之间的差异很小,HEB-2013株与与TJ株最为相似,同源性为99.23%,与SX2009株差异最大,同源性为98.39%,所以这也从另一方面说明近年来华北地区流行的PRRSV的突变率并不是很高。
对HEB-2013株与其他毒株的NSP2、GP3、GP5三个蛋白氨基酸序列进行详细比对分析之后,发现亚群1与亚群2在三个蛋白中都有一定差别,在NSP2蛋白中,亚群1和亚群2均有482位和534-562位的缺失,在495位亚群1为P,亚群2为L,在509位亚群1为R,亚群2为Q,在510位亚群1为R,亚群2为F,在519位亚群1为S,亚群2为I;GP3蛋白中,在66位亚群1为I,亚群2为T;GP5蛋白中,在29位亚群1为V,亚群2为A,在34位亚群1为N,亚群2为S。由于亚群1和亚群2均为高致病性毒株,因此我们推测这些变异位点可能与PRRSV的毒力基因相关。根据亚群1和亚群2的这些差异,我们可以直接对新发现的毒株进行亚型分类,这个特点对于研究PRRSV的遗传进化分析具有重要的意义。
毒力相关氨基酸的推测与变异分析结果显示,该研究所分离的HEB-2013株与华北地区近年来流行的毒株内的9个潜在毒力相关氨基酸位点[14]完全相同,而且其亲缘关系又十分接近,说明近年来华北地区PRRSV流行毒株在遗传变异方面趋于稳定,但是这些毒株的毒力相关氨基酸与经典株BJ-4有较大差异,9个毒力相关氨基酸中只有3个与BJ-4株保持一致,另外6个潜在毒力相关氨基酸位点与BJ-4株不同,这6个发生突变的位点分别是ORF1a(331)、ORF1b(952)、ORF2(10)、ORF5(13)、ORF5(151)、ORF6(16),结合马平等对CH-1a、VR2332、HUN4、JXA1、GD3毒株毒力相关氨基酸的推测与分析结果,我们可以进一步证明PRRSV的毒力基因与这6个潜在毒力相关氨基酸相关。在对HEB-2013株与其他毒株的NSP2、GP3、GP5三个蛋白氨基酸序列进行详细比对分析中,也发现了除了前人提到过的9个潜在毒力相关氨基酸之外,还存在一些氨基酸变异,这些变异位点在高致病性毒株与弱毒株BJ-4株相比有差异,例如在GP3蛋白氨基酸序列中,第64位,高致病性毒株均为A,而BJ-4为T;在GP5蛋白氨基酸序列中,第3位,高致病性毒株均为G,而BJ-4为E,第24位,高致病性毒株为Y,BJ-4为C,第39位,高致病性毒株为I,BJ-4为L,第137位,高致病性毒株为S,BJ-4为A。笔者认为,这些在高致病性毒株中相同而与BJ-4又不同的位点有可能是研究者还没发现的潜在毒力相关氨基酸位点,因此下一步研究将对这些位点进行验证分析,以确定它们是否与PRRSV的毒力相关。
由于PRRSV变异速度快,PRRSV基因序列的进化率(10-2/位/年)明显高于其他RNA病毒(10-3~10-5/位/年),而且PRRSV的变异分布于整个基因组,以NSP2基因和GP5基因变异最大。这使得猪繁殖与呼吸综合征的防控十分困难,因此研制出针对不同变异株均有效的疫苗变得至关重要,该研究通过对华北地区近年来流行的PRRSV毒株进行了遗传变异分析,为我国PRRSV的防控提供了重要的参考数据。
[1] Conzelmann K K,Visser N,Van Woensel P,et al.Molecular characterization of porcine reprocuctive and respiratory syndrome virus,a member of the arterivirus group[J].Virology,1993,193(1):329-339.
[2] Key K F,Haqshenas G,Guenette D K,et al.Genetic variation and phylogenetic analyses of the ORF5 gene of acute porcine reproductive and respiratory syndrome virus isolates[J].Vet Microbiol,2001,83:249-263.
[3] Wensvoort G,De Kluyver E P,Pol J M,et al.Lelystad virus the cause of porcine epidemic abortion and respiratory syndrome:a review of mystery swine disease research at Lelystad[J].Vet Microbiol,1992,33:185-193.
[4] Conzelmann K K,Visser N,Van Woensel P,et al.Molecular characterization of porcine reproductive and respiratory syndrome virus,a member of the arterivirus group[J].Virology,1993,193:329-339.
[5] Kapur V,Elam M R,Pawlovich T M,et al.Genetic variation in porcine reproductive and respiratory syndrome virus isolates in the Midwestern United States[J].J Gen Virol,1996,77:1271-1276.
[6] Zhou Y,Hao X,Tong G,et al.Highly virulent porcine reproductive and respiratory syndrome virus emerged in China[J].Emerg Infect Dis,2008,55(3):152-164.
[7] Bin Li,Liurong Fang,Suyan Liu,et al.The genomic diversity of Chinese porcine reproductive and respiratory syndrome virus isolates from 1996 to 2009[J].Veterinary Microbiology,2010,146:226-237.
[8] Allende R,Kutish G F,Laegreid W,et al.Mutaions in thegenome of porcine reproductive and respiratory ayndrome virus responsible for the attenuation phenotype[J].Arch Virol,2000,145:1149-1161.
[9] Nanhua Chen,Zhen Cao,Xiμling Yu,et al.Emergence of novel European genotype porcine reproductive and respiratory syndrome virus in mainland China[J].Journal of General Virology,2011,92:880-892.
[10]郭宝清,陈章水,刘文兴,等.从疑似PRRS流产胎儿分离PRRSV的研究[J].中国预防兽医学报,1996,2(87):1-5.
[11]Kwon B,Ansari I H,Osorio F A,et al.Identification of virulence determinants of porcine reproductive and respiratory syndrome virus through construction of chimeric clones[J].Virology,2008,380(2):371-378.
[12]Zhou L,Zhang J L,Yang H C,et al.The 30 Amino acid deletion in the Nsp2 of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China is not related to its virulence[J].J Virol,2009,83(10):5156-5167.
[13]安同庆.猪繁殖与呼吸综合征病毒与宿主细胞受体之间相互作用的研究及病毒遗传变异分析[D].北京:中国农业科学院,2007.
[14]Allende R,Kutish G F,Laegreid W,et al.Mutations in the genome of porcine reproductive and respiratory syndrome virus responsible for the attenuation phenotype[J].Arch Virol,2000,145:1149-1161.
(编辑:李文平)
Isolation and Sequence Analysis of PRRSV HEB-2013 Strain Isolated in China
ZHANG Dong-dong1,LIU Can2,GONG Wen-zhi1,NING Yi-bao1∗,FAN Xue-zheng1,ZHANG Jin-ya1
(1.National Classical Swine Fever Reference Laboratory,China Institute of Veterinary Drug Control,Beijing 100081,China;2.College of Veterinary Medicine,China Agricultural University,Beijing 100193,China)
In september 2013,we isolated a strain of PRRSV from a farm of Hebei province,named HEB-2013.After sequenced the whole genome,The results showed that the complete genome of HEB-2013 strain is 15336 nt,containing nine open reading frames(ORFs)with 189 nt in the 5’UTR and 165 nt in the 3’UTR.Then we compared the whole genome of this strain and complete nucleotide sequence of PRRSV isolated in Northern China which inquried on the NCBI.The results showed that the highest nucleotide homology is TJ strain isolated in 2006,the lowest is BJ-4 strain isolated in 2000,respectively is 99.80%and 88.39%.According to the amino acid sequence alignment results of NSP2,GP3 and GP5,we make a systematic analysis of the relation ship between the potential virulence sites and pathogenicity of the virus,and we have found five new likely sites related to the pathogenicity of virus.
porcine reproductive and respiratory syndrome virus(PRRSV);virus isolation;complete genome sequence analysis;the molecular characteristics
2014-12-03
A
1002-1280(2015)05-0005-07
S858.28
948项目(2130106)
张东东,硕士研究生,从事分子病毒学研究。
宁宜宝。E-mail:ningyibao@ivdc.org.cn
