国产与进口坎地沙坦酯胶囊人体生物等效性评价
2015-03-24强烈应毕京峰魏振满
郭 喆,强烈应,朱 哲,王 惠,毕京峰,魏振满
国产与进口坎地沙坦酯胶囊人体生物等效性评价
郭 喆1,强烈应1,朱 哲1,王 惠1,毕京峰2,魏振满2
目的 评价坎地沙坦酯胶囊(受试制剂)与原研药品坎地沙坦酯片(商品名:必洛斯)(参比制剂)是否具有健康人体生物等效性。方法 采取双交叉设计方法,22名健康男性志愿者随机口服国产坎地沙坦酯胶囊及进口坎地沙坦酯片8 mg 后,采用高效液相色谱串联质谱法测定不同时刻血浆中坎地沙坦的浓度,用DAS2.1.1 统计软件计算药代动力学参数,并评价其生物等效性。结果 受试制剂和参比制剂的Cmax分别为(79.62±29.99)ng/ml 和(77.74±28.46)ng/ml,AUC0-t 分别为(850.17±249.52)ng/(ml·h) 和(837.26±243.26)ng/(ml·h),AUC0-∞分别为(908.96±249.64)ng/(ml·h)和(896.94±241.53)ng/(ml·h)。AUC0-t的90%的置信区间为88.9%~109.5%,AUC0-∞的90% 的置信区间为89.2%~109.2%,Cmax90%的置信区间为参比制剂的86.2%~112.0%,均拒绝生物不等效假设,且双单侧t检验均有统计学意义。结论 国产坎地沙坦酯胶囊与进口坎地沙坦酯片在健康人体内具有生物等效性。
坎地沙坦;生物等效性;药动学参数
坎地沙坦酯是由日本武田药品工业株式会社研制的抗高血压药,后阿斯利康公司加入进行联合开发。1997-12首次在瑞典上市,商品名为坎地沙坦酯,上市剂型为片剂,规格为4、8、16、32 mg,1998-04在加拿大上市,同年6月于美国上市。国内也有由武田药品株式会社进口的片剂,商品名blopress(必洛斯)[1]。坎地沙坦酯胶囊是我国某制药公司在原研发药基础上的仿制品种,与原研发药剂型不同,但具有相同的活性成分。依据《药品注册管理办法》,本课题拟通过健康人体相对生物利用度和生物等效性研究,为科学阐明该仿制药物与原研药物的生物等效性提供依据。
1 材料与方法
1.1 药品、试剂与仪器
1.1.1 药品 受试制剂:坎地沙坦酯胶囊,由云南龙海天然植物药业有限公司生产,规格8 mg/粒,生产批号20120701,药检结果为合格,含量97.2%。参比制剂:坎地沙坦西酯片(商品名:必洛斯),规格8 mg/片,生产批号026B,药检结果为合格,含量96.3%。
1.1.2 仪器 安捷伦1290 infinity高效液相色谱仪,配备G4426A1290 SAMPLE高性能自动进样器,G4220A1290Bin pump高效二元切换泵,G1316A温控箱,美国agilent technologies 公司;安捷伦6410B 三重四级杆串联质谱仪,配有ESI电喷雾离子化源以及masshunter B 04.00定量和定性数据处理软件,美国agilent technologies 公司;QB-600型高速震荡混匀器,海门市其林贝尔仪器制造有限公司;Thermo R21 高速台式离心机,美国Thermo公司;SC-3616台式低速离心机,科大创新股份有限公司中佳分公司;梅特勒司1/10万天平。
1.1.3 试剂 坎地沙坦对照品(纯度99.8%),购于Toronto Research Chemicals Inc,批号4-APR-147-1,cat# C175575;对乙酰氨基酚对照品,购于中国食品药品检定研究院,批号100018-20040;甲酸为HPLC级(dikma公司),乙腈为色谱纯(fisher公司),空白血浆由解放军302医院血站提供。
1.2 受试者例数 根据文献[6,7],坎地沙坦酯胶囊各药代动力学参数的变异性较小,本研究的样本量参考中国CFDA《化学药物制剂人体生物利用度和生物等效性研究技术指导原则》[8]确定,计划完成受试者例数为22例。
1.3 受试者选择
1.3.1 纳入标准 (1)签署知情同意书;(2)男性, 18~40岁,体重指数(BMI)19~24 kg/m2,体重>50 kg;(3)生命体征及体格检查、实验室检查正常,12导联心电图、胸部X线检查合格。
1.3.2 排除标准 (1)因脑功能不全、精神发育障碍或言语等问题,不能与医护合作或交流;(2)有心血管、肝、肾、消化道、神经、内分泌系统等既往病史;(3)嗜酒或在用药前48 h内饮酒;(4)试验前14 d内用过任何药物;(5)试验前3个月内曾有过失血或献血达200 ml、参加过其他药物临床试验。
1.4 分组、给药及样本采集 采用SAS 9.1软件生成随机表,依据受试者入组顺序将受试者随机分为2组,每组各11人,第一组先服用受试制剂,1周后服用参比制剂;第二组先服用参比制剂,1周后服用受试制剂,剂量均为8 mg。参考文献[1]结果,应用静脉留置针采集血样,受试者于两次用药前和用药后0.5、1、2、3、4、5、6、8、10、12、24、36、和48 h于上肢静脉取血约4 ml,离心(3000 r/min)10 min,取血浆,立即置于-70 ℃冰箱中保存备测。
1.5 血浆样本的处理
1.5.1 标准系列溶液的配置 精密称取10.8 mg坎地沙坦对照品,放置于25 ml容量瓶中,加乙腈水(7∶3,v/v)溶解,并稀释至刻度,配置成相当于坎地沙坦0.432 mg/ml的储备溶液,即432 μg/ml,用乙腈水(7∶3,v/v)稀释成4320 ng/ml的母液,在分别用乙腈水(7∶3,v/v)稀释至16.875、33.75、67.5、270、540、1080、2160 ng/ml的坎地沙坦储备液。
1.5.2 质控(QC)溶液的配置 取配置好的坎地沙坦储备液(浓度为4320 ng/ml),分别用乙腈水(7∶3,v/v)稀释至33.75、270、1728 ng/ml,配置低、中、高3个浓度的QC溶液。
1.5.3 内标溶液的配置 精密称取对乙酰氨基酚25.5 mg对照品,放置于10 ml容量瓶中,加乙腈水(7∶3,v/v)溶解,并稀释至刻度,配置成1.02 mg/ml的对乙酰氨基酚储备液,取储备液适量,用乙腈水(7∶3,v/v)稀释至1020 ng/ml。
1.5.4 质控样本的配置 用空白人血浆,制备含坎地沙坦低、中、高三个浓度(分别是6.75、54、345.6 ng/ml)的血浆QC样本。
1.5.5 血浆样本处理 取200 μl血浆,分别加入50 μl内标液,50 μl乙腈-水(40∶60, v/v),涡旋1 min,混匀,然后再加入800 μl乙腈沉淀蛋白,涡旋震荡10 min,14 000 r/min离心10 min,取上清液转移至进样瓶中,待进行LC-MS/MS分析。
1.6 血浆样本的测定条件
1.6.1 色谱条件 色谱柱:agilent ZORBAX ECLIPSE Plus C18,rapid resolution HD 2.1×100 mm, 1.8 μm粒径,美国agilent公司。流动相为乙腈-0.2%甲酸水溶液(40∶60,v/v);流速0.4 ml/min;柱温30 ℃;进样量5.0 μl。
1.6.2 质谱条件 离子源为ESI源;Gas Temp为350 ℃,Gas Flow(N2)10 ml/min, Nebulizer 35 psi,正离子检测模式。Positive capillary 4000 V;扫描方式为多重反应监测(MRM)。用于定量分析的离子反应分别为:(1) 0→1.5 min 对乙酰氨基酚;母离子 152→子离子 110;驻留时间500 ms,毛细管电压106 V,碰撞能16 eV;碰撞池加速电压3 eV;(2) 1.6→4.0 min 坎地沙坦:母离子 441.2→子离子 263;驻留时间500 ms, 毛细管电压116 V, 碰撞能8 ev;碰撞池加速电压3 eV。
1.7 分析方法确证
1.7.1 特异性 分别取6名受试者的血浆各200 μl,分别加入50 μl乙腈,50 μl乙腈-水(40∶60, v/v),其余步骤按“血浆样本处理”项下操作。结果表明空白血浆中的内源性物质并不干扰坎地沙坦的测定。取空白血浆200 μl,分别加入50 μl内标液,50 μl乙腈-水(40∶60, v/v),其余步骤按“血浆样本处理”项下操作,得到质谱图,结果表明血浆中,内标物出峰未被干扰。
1.7.2 基质效应 取18份空白血浆(6个不同来源的)各200 μl, 加入800 μl乙腈沉淀蛋白,涡旋1 min,震荡10 min,然后加入50 μl内标液,50 μl低、中、高三个浓度(33.75、270、1728 ng/ml)的QC溶液,每个浓度6个样本,涡旋1 min,涡旋震荡10 min,然后14 000 r/min离心10 min,取上清液转移至进样瓶中进行LC-MS/MS分析,每个浓度样本6份,获得坎地沙坦和对乙酰氨基酚的峰面积,记录为M1。同样的方法,用18份200 μl流动相代替空白血浆,三个浓度的样本各6个,涡旋震荡后14 000 r/min离心10 min,取上清液转移至进样瓶中进行LC-MS/MS分析,获得流动相配置的样本中坎地沙坦和对乙酰氨基酚的峰面积,记录为M2。以下列公式计算基质效应:基质效应=M1/M2×100%。结果低、中、高三个血浆样本中坎地沙坦的基质效应均值分别为:97.29%、100.65%、98.87%,且低、中、高浓度的基质效应的相对标准差(RSD)均小于15%。对乙酰氨基酚的基质效应均值为100.52%,其基质效应的相对标准差(RSD)<15%。
1.7.3 标准曲线 取200 μl空白血浆,加入坎地沙坦系列标准溶液,其余步骤按照“血浆样本处理”项下操作,配制成含坎地沙坦的浓度分别为3.375、6.75、13.5、27、54、108、216、432 ng/ml的血浆样本系列,以血浆中待测物质浓度为横坐标,待测物质与内标物的峰面积比值为纵坐标,用加权(W=1/X2)最小二乘法进行回归分析,求得线性回归方程,即标准曲线。每个分析批次均建立一条标准曲线。坎地沙坦的线性范围为:3.375~432 ng/ml,定量下限为3.375 ng/ml。
1.7.4 定量下限(LLOQ) 定量下限能满足测定3~5个t1/2时样本中的药物浓度,由至少6个标准样本测试结果证明,其RE应在±20%内,相对标准差(RSD)应小于20%。
1.7.5 精密度和准确度 按照“血浆样本处理”项下进行操作,用空白人血浆,制备含坎地沙坦低、中、高3个浓度(分别是6.75、54.0、345.6 ng/ml)的血浆QC样本。每个浓度6个样本,连续测定3个分析批次,以同一批次的标准曲线计算QC样本的浓度,根据QC样本结果计算本方法的精密度与准确度。结果显示,批间、批内精密度均在±15%以内。
1.7.6 提取回收率 取18份空白血浆(6个不同来源的)各200 μl,加入800 μl乙腈沉淀蛋白,涡旋1 min,震荡5 min,然后加入50 μl内标液,50 μl低、中、高3个浓度(33.75、270、1728 ng/ml)的溶液,每个浓度6个样本,涡旋1mins,震荡10 min,然后14 000 r/min离心10 min,取上清液转移至进样瓶中进行LC-MS/MS分析,每个浓度样本6份,获得坎地沙坦和对乙酰氨基酚的峰面积,记录为b1。同样的方法,用18份200 μl空白血浆,分别加入50 μl内标液和50 μl低、中、高3个浓度(33、660、5280 ng/ml)的溶液,每个浓度的样本各6个,涡旋震荡后14 000 r/min离心10 min,取上清液转移至进样瓶中进行LC-MS/MS分析,获得流动相配置的样本中坎地沙坦和对乙酰氨基酚的峰面积,记录为b2。以下列公式计算提取回收率:提取回收率=b2/b1×100%。结果表明,低、中、高3个血浆样本中坎地沙坦的提取回收率分别为94.69%、93.48%、96.47%,血浆样本中对乙酰氨基酚的提取回收率均值应为:100.76%(以峰面积计算)。
1.7.7 样本稳定性 取坎地沙坦配制好的低、中、高3个浓度的溶液,每个浓度6个样本,分别测定室温放置稳定性、处理后放置进样器中稳定性、反复冻融稳定,以及冻存4个月稳定性,结果表明样本的RE均在15%以内。
1.8 统计学处理 用DAS 2.1.1软件处理血浆中坎地沙坦的浓度-时间数据,用非房室模型方法计算药动学参数。相对生物利用度(F)=(AUC受试制剂/AUC参比制剂)×100%,分别以AUC0-t和AUC0-∞计算受试制剂的相对生物利用度F0-t和F0-∞。AUC0-t、AUC0-∞和Cmax对数转换后进行显著性检验,然后用双向单侧t检验和90%置信区间的方法评价和判断药物间是否具有生物等效性。
2 结 果
2.1 血药浓度-时间曲线及药动学参数 口服单剂量受试制剂和参比制剂后血浆中坎地沙坦浓度平均浓度-时间曲线见图1,各时间点浓度接近,受试制剂的F0-t和F0-∞分别为(102.4±27.6)%、(102.4±27.9)%。主要药动学参数见表1。

图1 22名受试者口服单剂量受试制剂和参比制剂后血浆中坎地沙坦平均浓度-时间曲线
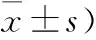
(n=22;
2.2 生物等效性评价 见表2、3。两制剂间、周期间参数无统计学差异,但个体间及服药顺序间存在统计学差异(P<0.05)。双向单侧t检验结果表明受试制剂没有超过规定的参比制剂的高限和低限(P<0.01);90%置信区间计算结果表明受试制剂均数在高方向没有大于或等于参比制剂均数的125%(P<0.01) ,在低方向也没有小于或等于参比制剂均数的80%(P<0.05)。试验药的药动学参数AUC0-t、AUC0-∞和Cmax均符合生物等效的判定标准。

表2 受试制剂和参比制剂的AUC0-t、AUC0-∞、Cmax对数转化后方差分析的P值情况

表3 受试制剂和参比制剂的AUC0-t、AUC0-∞、Cmax对数转化后双向单侧t检验和[1-2α]置信区间
3 讨 论
坎地沙坦酯是非肽类血管紧张素Ⅱ(AⅡ)受体拮抗药[4],通过与受体1(AT1)的特异性结合来阻断AT1收缩血管和促进醛固酮释放的效应,可松弛血管平滑肌,增加盐排泄,降低血压而不改变心率或心输出[5]。坎地沙坦的特点是和AⅡ的受体结合较紧密,优于其他AT1受体阻滞药,且持续时间长,不会因AT2浓度增加而受到影响,能够发挥长效降压的作用[6]。另外,坎地沙坦在降低血压的同时,能有效地阻止高血压患者的心脏重构,避免肾素-血管紧张素对心、脑、肾及血管内膜的损害,同时可阻断血管神经收缩并通过抑制肾上腺分泌醛固酮而发挥一定的降压作用[7,8]。长期有效降压可减少心血管疾病的危险[9]。目前已被列为一线降压药。
本试验建立了LC-MS/MS法测定人血浆中的坎地沙坦浓度的方法,样本经乙腈沉淀蛋白处理后,用MRM扫描方式,以坎地沙坦准分子离子[M+H]+为母离子(m/z 441),利用其产生的主要碎片离子(m/z 263.1)进行定量分析,血浆中的内源性物质不干扰待测物的测定。血浆中坎地沙坦的线性范围为3.375~432 ng/ml, 定量下限为3.375 μg/ml。本方法具有快速、专属、准确、灵敏度高的特点,适合人体血浆样本中坎地沙坦浓度的分析测定。
本研究中,测得参比药品必洛斯的Tmax为4.38 h,t1/2为9.54 h,与文献 [10-12]研究相符。测得受试制剂和参比制剂的药代动力学参数十分相似。与参比制剂相比,受试制剂中坎地沙坦的相对生物利用度F0-t和F0-∞为(102.4±27.6)%、(102.4±27.9)%。对受试制剂和参比制剂的AUC0-t、AUC0-∞和Cmax进行生物等效性比较,结果表明受试制剂与参比制剂间的差异无统计学意义。说明国产坎地沙坦胶囊和日本武田药品工业株式会社原研药品必洛斯在人体的吸收速度和程度相当,具有生物等效性。
[1] 朱余兵,邹建军,钱 薇,等.健康受试者口服复方坎地沙坦酯片后坎地沙坦的药代动力学研究[J].中国临床药理学与治疗学, 2007, 12(4): 474-477.
[2] 俞 佳,马 珂,祁金文,等.坎地沙坦酯片和胶囊在健康人体的药代动力学和生物等效性[J]. 中国临床药理学与治疗学, 2009,14(7):794-798.
[3] 化学药物制剂人体生物利用度和生物等效性研究技术指导原则课题研究组. 化学药物制剂人体生物利用度和生物等效性研究技术指导原则[EB/OL]. [2012-11-14].
[4] 刘梅讯,雷枫琴. 坎地沙坦对高血压合并2型糖尿病患者血浆尾加压素Ⅱ和脂联素的影响[J]. 中国循证心血管医学杂志, 2013,5(5):470-472.
[5] 陈 凌,潘静蔽,秦永文,等.坎地沙坦酯治疗轻中度高血压患者的疗效及安全性[J]. 药学服务与研究, 2004, 2(4): 139-141.
[6] 李卫华. 坎地沙坦联合其他抗高血压药物治疗原发性高血压的疗效观察[J]. 临床合理用药, 2014,7(5):56-57.
[7] 段元青.坎地沙坦酯片治疗原发性高血压的成本效果分析[J].泰山医学院学报,2014,35(10):1029-1031.[8] 邓智建,袁 宇,曹冬梅.坎地沙坦西酯治疗慢性心力衰竭40例[J].中国药师,2008,11(9):1087-1089.
[9] 丁玉林,马小虎,冶明星. 美托洛尔联合坎地沙坦酯片治疗老年中重度高血压58例[J].中国药业,2013,22(19):97-98.
[10] 朱燕妮, 傅潞仙, 徐飞瑶, 等. 高效液相色谱法对坎地沙坦酯固体分散体颗粒溶出度的测定[J].中国医药导报, 2013, 10(3): 127-129.
[11] 朱余兵, 于翠霞, 程俊霖, 等. 复方坎地沙坦酯片在健康受试者体内的生物等效性研究[J]. 中国药师,2011,14(6):775-778.
[12] 徐 戎, 斯陆勤, 顾世芬, 等. 国产和进口坎地沙坦酯片人体生物等效性评价[J]. 中国药学杂志, 2008, 43(6): 455-458.
(2015-02-12收稿 2015-06-19修回)
(责任编辑 武建虎)
Bioequivalence of oral candesartan cilexetil capsules in healthy volunteers
GUO Zhe1, QIANG LieYing1, ZHU Zhe1, WANG Hui1,BI Jingfeng1,and WEI Zhenman2.
1. Department of Pharmacy, Second Hospital of Beijing Municipal Corps; Chinese People’s Armed Police Force, Beijing 100037, China;2. The Center of New Drug Clinical Trial, No.302 Hospital of PLA, Beijing 100039, China
Objective To study the bioequivalence of the tested and reference oral candesartan Cilexetil in healthy male volunteers. Methods According to the crossover design,each volunteer was orally given 8 mg candesartan cilexetil capsules or tablets. Their plasma concentrations were determined by LC/MS/MS. Pharmacokinetic parameters were obtained using DAS program. Results Cmaxwere(79.62±29.99) ng/ml and (77.74±28.46) ng/ml,AUC0-twere (850.17±249.52) ng/(ml· h)and (837.26±243.26)ng/(ml· h),AUC0-∞were (908.96±249.64) ng/(ml· h) and(896.94±241.53) ng/(ml· h),respectively. Two-way unilateralt-test results showed that the test preparation did not exceed the prescribed upper limit and lower limit of the reference preparation, rejected null hypothesis (P<0.05). The 90% confidence intervals of Cmax,AUC0-tand AUC0-∞were between the standard of reference tablets (80%-125%). Conclusions Candesartan cilexetil capsules and candesartan cilexetil tablets are bioequivalent.
candesartan cilexetil; bioequivalence; pharmacokinetic parameters
郭 喆,本科学历,主任药师,E-mail:guozhegg@sina.com
1.100037,武警北京总队第二医院药剂科;2.100039 北京,解放军第302医院新药临床试验中心
R917
