HPLC法测定阿齐沙坦片的溶出度
2015-03-22戴根来
李 瑛,张 腾,戴根来
(合肥久诺医药科技有限公司,安徽合肥 230088)
用于治疗高血压疾病的阿齐沙坦(azilsartan,图1)[1-2]是一代新型的选择性 AT1亚型血管紧张素II受体拮抗剂(ARBs)类抗高血压药[3-4],由日本武田药品工业株式会社研究与开发,2012年1月开始在日本获批上市,片剂剂型。目前,我国尚未上市。阿齐沙坦属于低溶解性药物,难溶解于水中。中国药典2010版二部要求,难溶性的药物均需要作溶出度的检查,所以从质量控制上说,溶出度是其重要的一项指标。本文采用HPLC法,对三批自制阿齐沙坦片和一批市售片进行溶出度测定,并运用方法学进行考察[5-6]。
1 仪器与材料
1.1 仪器 美国科学系统公司SSI高效液相色谱仪(SSI Series 500 PUMP,Series 500紫外检测器,Anastar色谱工作站)、AB135-S分析天平(托利多梅特勒)、RCZ-8A智能药物溶出仪(天津市鑫洲科技有限公司)。
1.2 试药 阿齐沙坦对照品(合肥久诺医药科技有限公司,批号:D111001),阿齐沙坦片,规格20 mg(合肥久诺医药科技有限公司,批号:120702、120703、120704;日本武田药品工业株式会社,批号:O002),甲醇为色谱纯,水为超纯水,其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件与系统适应性 色谱柱:Agilent C18(250 mm ×4.6 mm,5.0 μm);流动相为水—乙腈—冰醋酸(43∶57∶1);检测波长为254 nm,柱温30℃,流速1.0 mL·min-1,进样量20 μL。按双酰化物峰计算理论板数应不低于3 000。
2.2 配制对照品溶液 取约20 mg阿齐沙坦对照品,精密称定,置100 mL量瓶中。加适量甲醇使其溶解,再加溶出介质(1.7 g磷酸氢二钾和4.475 g十二水磷酸氢二钠溶于1 000 mL水中),稀释至刻度后摇匀。精密量取5 mL至50 mL量瓶中,加溶出介质,稀释至刻度,并作为对照品溶液使用。
2.3 配制供试品溶液 按照溶出度测定法(中国药典2010年版二部附录X C第二法),取阿齐沙坦片,以1 000 mL磷酸盐缓冲液(1.7 g磷酸氢二钾和4.475 g十二水磷酸氢二钠溶于1 000 mL水)为溶出介质,转速为50 r·min-1。45 min时,取适量溶液滤过(0.45μm微孔滤膜)。取续滤液作供试品溶液使用。
2.4 测试空白溶液 取溶出介质进样。结果表明空白溶液没有干扰[7],如图2所示。
2.4.1 线性考察 取适量阿齐沙坦对照品,进行精密称定,加适量甲醇将其溶解,用溶出介质定量稀释成为每1 mL中约含0.35 mg的溶液,使其作为阿齐沙坦的对照品贮备液;分别精密量取1、2、3、4、5 mL贮备液至50 mL量瓶中,用溶出介质将其稀释至刻度后摇匀。分别量取20μL上述溶液,按“2.1”项条件测定,记录峰面积,以浓度C对阿齐沙坦峰面积A进行线性回归分析,有回归方程A=29 643C+12 312,r=0.999 7。结果显示,在 6.82 ~34.10 mg·L-1浓度范围内,阿齐沙坦具有良好的线性关系。
2.4.2 精密度试验 取20.46 mg·L-1上述对照品溶液,进行6次重复进样并进行测定,记录其峰面积。结果得出,RSD=0.71%。
2.4.3 稳定性试验 取20.46 mg·L-1上述对照品溶液,0、1、2、4、8 h 分别进行测定,记录其峰面积,结果得出,RSD=1.21%。结果表明,在8 h内阿齐沙坦溶液最为稳定。
2.4.4 重复性试验 取20片同一批样品(批号:120702),精密称定后研细。精密称取6份适量(约相当于阿齐沙坦20 mg),分别置于100 mL量瓶中,加适量甲醇,并运用超声处理使其溶解。使用溶出介质使其稀释至刻度,摇匀,滤过。精密量取5 mL续滤液,置于25 mL量瓶中,使用溶出介质稀释至刻度,摇匀。精密量取20μL,按照“2.1”项条件测定,记录其峰面积。另取适量阿齐沙坦对照品,精密称定,加适量甲醇将其溶解,再用溶出介质定量稀释成为每1 mL中约含20μg阿齐沙坦的溶液,作为对照品溶液,使用相同方法进行测定。结果得出,RSD=0.33%,说明该方法具有良好的重现性。
2.4.5 回收率试验 分别精密称取10、16、20 mg阿齐沙坦对照品及3份处方配比量的辅料,置于1 000 mL量瓶中,加溶出介质使其稀释至刻度,摇匀,滤过,作为供试品溶液使用;另取约20 mg阿齐沙坦对照品,精密称定,置于100 mL量瓶中,加适量甲醇将其溶解,另加pH 6.8磷酸盐缓冲液稀释至刻度,摇匀。精密量取5 mL,置于50 mL量瓶中,加溶出介质将其稀释至刻度,摇匀,作为对照品溶液使用。分别取对照品溶液和供试品溶液,按“2.1”项条件测定,并计算加样回收率,结果得出,平均回收率为(99.9±0.74)%,RSD 为0.74%,如表1 所示。
2.5 溶出度测定 按照溶出度测定法(中国药典2010年版二部附录X C第二法),取阿齐沙坦片,用1 000 mL pH 6.8磷酸盐缓冲液作为溶出介质,50 r·min-1转速。45 min时,取适量溶液后滤过,取续滤液作为供试品溶液使用。另取适量阿齐沙坦对照品,精密称定,加入甲醇适量将其溶解。将溶出介质定量稀释为每1 mL中约含20μg阿齐沙坦的溶液,作对照品溶液使用。分别量取对照品溶液与供试品溶液,按“2.1”项条件测定,计算溶出度,批号为 120702、120703、120704、0002 的样品溶出度分别为 99.4%、99.4%、99.8%、99.6%。
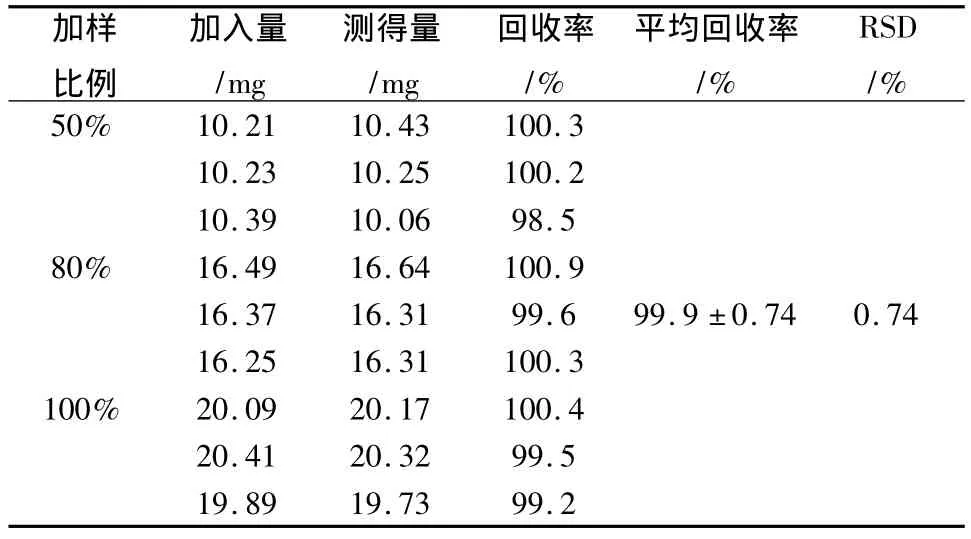
表1 阿齐沙坦回收率试验结果
3 讨论
本文使用HPLC法对阿齐沙坦片进行溶出度测定,具有良好的重现性、高度的准确性。以阿齐沙坦最大吸收波长254 nm为检测波长进行紫外检测,主峰保留时间为5 min以内,并具有良好的分离度。
阿齐沙坦难溶于水[8-9],本文建立的 HPLC 法对阿齐沙坦片溶出度进行直接测定,可在同一色谱条件下与含量同时进行测定,准确简单,省时省力。
[1] 张亚安,傅志贤,张征林.抗高血压新药选择性AT1压型血管紧张素Ⅱ受体拮抗剂-阿齐沙坦酯[J].药学与临床研究,2011,19(3):262 -264.
[2] 杨君义.新型降压药阿奇沙坦酯[J].医药导报,2013,32(5):644-645.
[3] 赵春艳,王京晶,刘 洋,等.心血管疾病新药阿齐沙坦酯的药理与临床评价[J].中国新药杂志,2011,20(19):1831 -1834.
[4] 高 越,邱 彤,郗砚彬,等.复方阿齐沙坦酯/氯噻酮药理作用研究进展[J].国际药学研究杂志,2013,40(5):557 -559,583.
[5] 张 敏,霍立茹,公晓伟,等.HPLC法测定阿齐沙坦片含量[J].中国药房,2014,25(41):81 -82.
[6] 张树文,徐 伟,杨 彬,等.阿齐沙坦的合成[J].化工中间体,2014,10(4):39 -41.
[7] Jie Z,Wenjuan P,Nan S,et aL.Separation of four-lol drugs by HPLCwith new bonded chiral stationary column[J].Chinese Science Bulletin,2013,58(11):1267 -1273.
[8] 国家药典委员会.中国药典(二部)[S].北京:中国医药科技出版社,2010:附录85 -87.
[9] 唐了平,产运霞,郭银汉,等.阿齐沙坦片国产品溶出度试验方法的建立及与原研品体外溶出行为比较[J].中国药房,2014,25(17):1609-1611.
