TRPM7在胆管癌组织中的表达及其与预后的关系*
2015-03-18曹玉文吴何兴王其昆唐景霞彭心宇张示杰杨宏强
李 立,曹玉文,吴何兴,王其昆,楚 啸,杨 林,唐景霞,彭心宇,张示杰,杨宏强,2△
(1.石河子大学医学院第一附属医院肝胆外科,新疆石河子832008;2.徐州中心医院肿瘤外科,江苏徐州221009)
瞬时受体电位离子通道(transient receptor potential melastatin 7,TRPM7)是近年来发现的一种具有离子通道和蛋白激酶双重结构的双功能蛋白,也是新近发现的与肿瘤细胞增殖、凋亡和侵袭转移相关的基因蛋白,但目前有关TRPM7在胆管癌中的表达及其与胆管癌生物学行为的关系国内外尚未见报道。本研究采用免疫组织化学染色方法检测TRPM7在胆管癌、胆管良性病变组织及癌旁正常胆管组织中的表达情况,探讨它与胆管癌临床病理因素和临床预后之间的关系,并对其临床意义进行分析讨论。
1 资料与方法
1.1 一般资料 收集本院2007年11月至2014年3月手术切除并经病理证实的行胆管癌根治术后的石蜡标本49例及胆管良性病变石蜡标本7例,并取其中36例患者的肿瘤癌旁正常胆管组织作对照,所有病例均通过本院伦理委员会批准同意。49例胆管癌患者中男25例,女24例;年龄24~80岁,中位年龄61岁;按WHO病理分级标准,高分化9例,中分化33例,低分化7例;按照国际抗癌联盟(UICC)TNM 分期系统Ⅰ+Ⅱ期16例,Ⅲ+Ⅳ期33例;切除标本中伴有淋巴结转移24例,无淋巴结转移者25例;伴有肝脏、胰十二指肠和网膜等其他脏器转移33例,无脏器转移者16例;有肝炎病毒携带者9例(全为乙型肝炎),无肝炎病毒携带者40例。患者术前均未行放射、化学治疗。所有病例全部切片均由2位高年资病理医师严格进行明确诊断复核。所有标本均经10%甲醛溶液固定,石蜡包埋,4μm厚连续切片。
1.2 方法
1.2.1 实验材料 山羊抗人TRPM7多克隆抗体(稀释度1∶25)购自美国abcam公司(ab729);SP试剂盒、DAB显色试剂盒均购自北京中杉金桥生物技术有限公司。
1.2.2 免疫组织化学方法 所有标本均行4μm连续切片,制备成石蜡切片,该步骤由本院病理科医生及技师完成。然后切片常规烤片、脱蜡脱水,PBS冲洗,用10mmol pH的柠檬酸盐抗原修复液进行高压加热抗原修复,室温下自然冷却,3%H2O2溶液浸泡10min,PBS冲洗,滴加一抗,4℃冰箱孵育过夜,第2天于室温放置30min,PBS冲洗,先滴加二抗试剂1,37℃温箱孵育30min,PBS冲洗,再加二抗试剂1,37℃温箱孵育30min,PBS冲洗,DAB显色,苏木素衬染,脱水透明封片。用已知的胆管癌阳性切片作为阳性对照,用PBS液替代一抗作为阴性对照。
1.2.3 结果判断标准 TRPM7蛋白阳性产物主要定位于细胞质和(或)细胞膜,表现为棕黄色颗粒。评分标准采用双评分半定量法[1],依据着色强度评分:无着色为0分,淡黄色为1分,棕黄色为2分,褐黄色为3分;依据显示细胞率评分:无着色为0分,≤25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。两者相加得综合评分:0分为(-),2~3分为(±),4~5分为(+),6~7分为(++)。最后(-)和(±)判为阴性,(+)和(++)判为阳性。
1.3 统计学处理 应用SPSS20.0统计软件进行统计学分析,对各种分组间表达阳性率的比较采用χ2检验(或Fisher确切概率法)。生存分析采用Kaplan-Meier曲线分析法。单因素分析采用Log Rank检验。多因素分析采用Cox多元回归法。以P<0.05为差异有统计学意义。
2 结 果
2.1 TRPM7在不同胆管组织中的表达 TRPM7在胆管癌组织、癌旁正常胆管组织及胆管良性病变组织中表达阳性率分别为是77.6%(38/49)、2.8%(1/36)及0(0/7),差异有统计学意义(P<0.01),见图1。

图1 TRPM7在胆管癌组织及正常胆管组织中的表达(SP,×200)
2.2 TRPM7在胆管癌中的表达与临床病理特征之间的关系
TRPM7蛋白的表达与患者性别、年龄、部位、分化程度和肝炎无相关性(P>0.05);而与肿瘤TNM分期、淋巴结转移、脏器转移等因素呈正相关(P<0.05)。见表1。
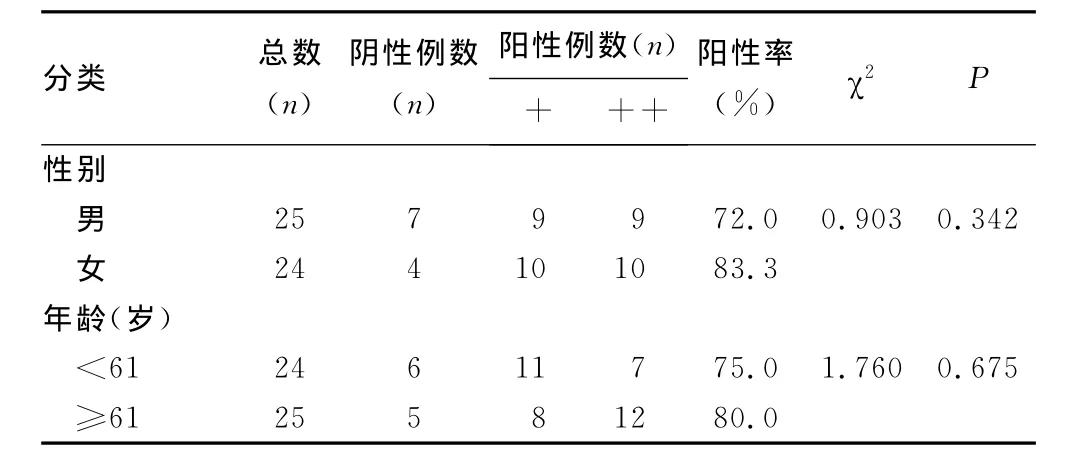
表1 TRPM7蛋白与临床病理因素的相关性
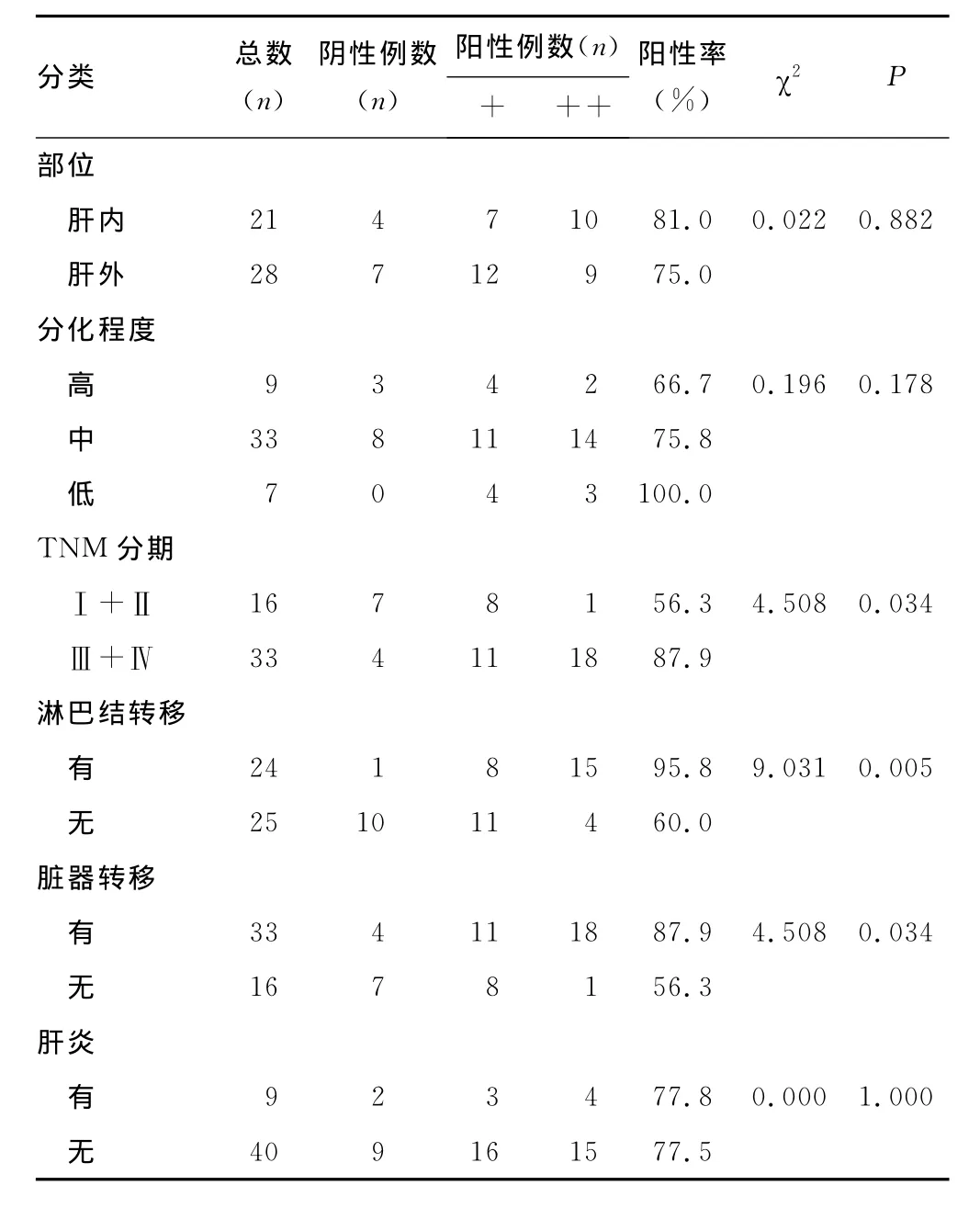
续表1 TRPM7蛋白与临床病理因素的相关性
2.3 TRPM7与胆管癌预后的关系 胆管癌患者及胆管良性病变患者的随访从术后开始,随访率100.0%,截止2014年8月31日,随访时间为1~81个月,其中胆管癌中位生存时间为20.0个月,胆管良性病变患者中位生存时间80.0个月。随访期间胆管癌患者死亡35例,胆管良性病变患者无死亡病例。胆管癌患者术后复发40例,其中发生远处转移31例。Kaplan-Meier单因素生存分析TRPM7阳性表达与阴性表达患者的平均生存期分别为15.7个月和42.5个月,总生存率分别为21.1%和45.5%,TRPM7阳性表达患者的生存时间明显低于阴性表达患者,经Log Rank检验,两者之间差异有统计学意义(χ2=8.396,P<0.01),见图2。Cox多元回归分析显示 TRPM7蛋白表达阳性与胆管癌低生存率呈正相关,与病死率呈正相关,是胆管癌预后差的独立危险因素,术前TNM分期和术后复发也是胆管癌患者死亡的独立预后因素,见表2。

图2 胆管癌患者TRPM7阳性及阴性表达的生存曲线
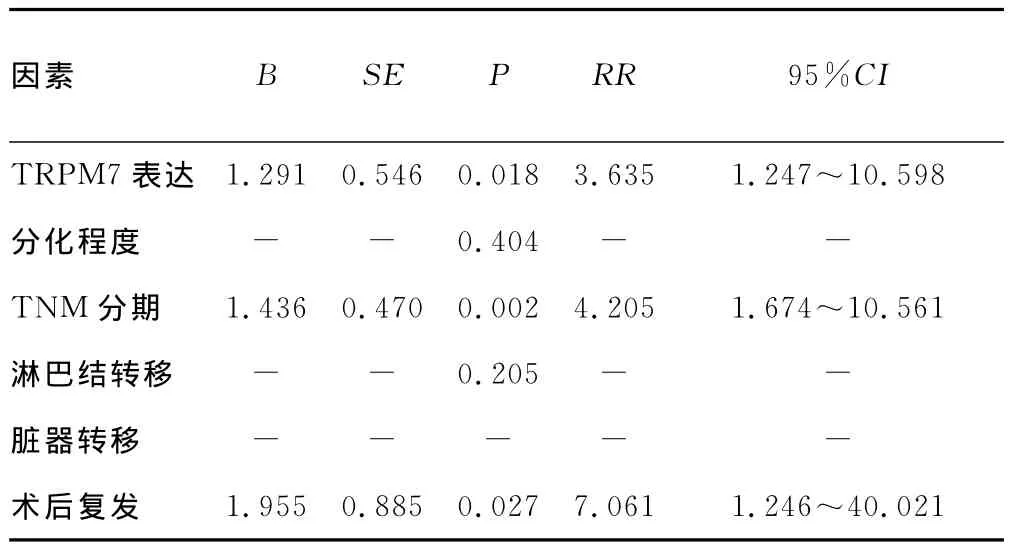
表2 胆管癌生存预后的Cox多元回归分析
3 讨 论
胆管癌是来源于胆管上皮细胞的高度恶性肿瘤,其有起病隐匿、诊断困难、恶性程度高、病死率高等特征,近年来,其发病率亦有逐年上升的趋势。胆管癌临床早期诊断困难,外科手术切除率低并易术后复发转移,对放射化学治疗不敏感,治疗效果不佳,预后较差,所有胆管癌患者的平均中位生存期不到24.0个月[1-2],因此,研究胆管癌的发生、发展及侵袭、转移等分子机制,寻找有效抗肿瘤的新途径已成为提高胆管癌患者生存率的重要手段。
随着对肿瘤研究的深入,发现TRPM7的表达在肿瘤侵袭和转移中发挥重要作用。TRPM7蛋白是TRPs家族成员之一,广泛存在于机体组织中,是具有阳离子通道和蛋白激酶双重结构的双功能膜蛋白,同时可使自身或底物磷酸化,因此也被称为“通道酶”[3-4],参与细胞的生长、增殖、迁移、凋亡甚至肿瘤的发生、转移等多种生理病理过程[5-7]。近年来,随着研究的不断深入,越来越多的证据表明TRPM7与肿瘤的生长、增殖、凋亡和侵袭转移有着密切的关系,在许多肿瘤中均有特异性表达,如在人头颈癌[8]、人喉鳞癌和甲状腺癌[9]、人下咽鳞状细胞癌[10]、人鼻 咽癌[11]、前列 腺癌[12]、肺癌[13]、肝 癌[14]、胃 癌[15]、胰腺癌[16]等,但在癌前病变或癌旁正常组织中表达较低或不表达,一旦肿瘤形成,TRPM7便在某些诱因的作用下开始表达,再通过其他各种途径参与肿瘤的进展。此外,Guilber等[17]证明乳腺肿瘤组织与相邻的非肿瘤组织相比时,TRPM7是明显过度表达的,同时发现TRPM7参与乳腺癌细胞的增殖与转移。因为各种肿瘤的癌旁组织中几乎不表达TRPM7,因此TRPM7可作为一个较为特异的肿瘤标志物虽不能用于早期诊断,但还是可以成为临床上对肿瘤最后确诊的一个有意义的辅助手段。这表明TRPM7可作为治疗癌症的一个潜在的有价值的作用靶点,与各种肿瘤的关系有待进一步研究,这在胆管癌中的研究国内外尚未见报道。
本研究结果显示,TRPM7在胆管癌组织中高度表达,而在胆管良性病变组织及癌旁正常胆管组织中几乎不表达,且与胆管癌TNM分期、淋巴结转移、脏器转移有关,提示TRPM7可能在胆管癌的发生、发展及转移中起重要作用,这与Guilbert等[17]在乳腺癌中的研究结果都是相一致的。有研究表明,TRPM7和m-钙激活蛋白酶(m-calpain)共存于细胞黏附复合体中,m-calpain可被钙离子通过TRPM7通道时激活使细胞黏附复合物解离,从而抑制细胞黏附[18],而增加钙蛋白酶活性又进一步降低E-cadherin的表达[19],从而导致细胞增殖、迁移和癌症的发展。E-cadherin主要作用为介导同型细胞之间的黏附,同时作为黏附连接的一部分在很多恶性肿瘤的侵袭及转移中都有研究[20]。而TRPM7通过直接或间接调节m-cal-pain及E-cadherin相关基因的表达促进癌症的侵袭及转移。TRPM7是否亦通过这一机制在胆管癌进展及转移中起作用,还有待于进一步研究证实。
通过对49例胆管癌患者1~81个月的随访发现,TRPM7高表达的胆管癌患者累计生存率显著低于其低表达的患者。经过分析发现TRPM7蛋白不仅是胆管癌预后的一个危险因素,而且是独立的危险因素,可作为预后的不良评估因子,提示TRPM7在胆管癌预后的判断中具有重要的参考价值,这与Wang等[21]在卵巢癌中的报道结果相一致;Middelbeek等[22]用小鼠移植瘤模型也证实高水平表达的TRPM7是乳腺癌预后较差的独立危险因素。因此TRPM7的异常表达,可能在肿瘤发生、发展及浸润转移过程中起到十分重要的作用,检测TRPM7的表达对胆管癌的预后判断具有重要价值,有望成为一个预测预后风险的独立指标。本研究初步说明TRPM7与胆管癌发生、发展、临床病理及预后有密切关系,有望成为胆管癌治疗的潜在靶点,通过抑制TRPM7的活性或沉默TRPM7的表达,干预其相关作用进而达到抑制胆管癌细胞侵袭转移的目的。TRPM7可作为一种新的特异肿瘤标志物和判断预后的指标之一,为胆管癌的靶向治疗提供全新的研究思路。
[1]郭鹏辉,杜燕蕾,聂玉强.miR-191在胃癌组织中的表达及其靶基因的预测[J].世界华人消化杂志,2012,20(25):2347-2352.
[2]Blechacz B,Gores GJ.Cholangiocarcinoma:advances in pathogenesis,diagnosis,and treatment[J].Hepatology,2008,48(1):308-321.
[3]Oancea E,Wolfe JT,Clapham DE.Functional TRPM7channels accumulate at the plasma membrane in response to fluid flow[J].Circ Res,2006,98(2):245-253.
[4]Inoue R,Jensen LJ,Shi J,et al.Transient receptor potential channels in cardiovascular function and disease[J].Circ Res,2006,99(2):119-131.
[5]Trapani V,Arduini D,Cittadini A,et al.From Magnesium to Magnesium transporters in cancer:TRPM7,a novel signature in tumour development[J].Magnes Res,2014,26(4):149-155.
[6]Yee NS,Zhou W,Liang IC.Transient receptor potential ion Channel Trpm7regulates exocrine pancreatic epithelial proliferation by Mg2+-sensitive Socs3asignaling in development and cancer[J].Dis Model Mech,2011,4(2):240-254.
[7]Chen HC,Xie J,Zhang Z,et al.Blockade of TRPM7Channel activity and cell death by inhibitors of 5-lipoxygenase[J].PLoS One,2010,5(6):e11161.
[8]Jiang J,Li MH,Inoue K,et al.Transient receptor potential melastatin 7-like current in human head and neck carcinoma cells:role in cell proliferation[J].Cancer Res,2007,67(22):10929-10938.
[9]Abed E,Moreau R.Importance of melastatin-like transient receptor potential 7and cations(Magnesium,Calcium)in human osteoblast-like cell proliferation[J].Cell Prolif,2007,40(6):849-865.
[10]Zhu W,Ou Y,Li Y,et al.A small-molecule triptolide suppresses angiogenesis and invasion of human anaplastic thyroid carcinoma cells via down-regulation of the nuclear factor-kappa B pathway[J].Mol Pharmacol,2009,75(4):812-819.
[11]Chen JP,Luan Y,You CX,et al.TRPM7regulates the migration of human nasopharyngeal carcinoma cell by mediating Ca(2+)influx[J].Cell Calcium,2010,47(5):425-432.
[12]Sun Y,Selvaraj S,Varma A,et al.Increase in serum Ca2+/Mg2+ratio promotes proliferation of prostate cancer cells by activating TRPM7channels[J].J Biol Chem,2013,288(1):255-263.
[13]Gao H,Chen X,Du X,et al.EGF enhances the migration of cancer cells by up-regulation of TRPM7[J].Cell Calcium,2011,50(6):559-568.
[14]Mishra R,Rao V,Ta R,et al.Mg2+-and MgATP-inhibited and Ca2+/calmodulin-sensitive TRPM7-like current in hepatoma and hepatocytes[J].Am J Physiol Gastrointest Liver Physiol,2009,297(4):G687-G694.
[15]Kim BJ,Park EJ,Lee JH,et al.Suppression of transient receptor potential melastatin 7Channel induces cell death in gastric cancer[J].Cancer Sci,2008,99(12):2502-2509.
[16]Yee NS,Zhou W,Lee M,et al.Targeted silencing of TRPM7ion Channel induces replicative senescence and pro-duces enhanced cytotoxicity with gemcitabine in pancreatic adenocarcinoma[J].Cancer Lett,2012,318(1):99-105.
[17]Guilbert A,Gautier M,Dhennin-Duthille I,et al.Evidence that TRPM7is required for breast cancer cell proliferation[J].Am J Physiol Cell Physiol,2009,297(3):C493-C502.
[18]Su LT,Agapito MA,Li M,et al.TRPM7regulates cell adhesion by controlling the calcium-dependent protease calpain[J].J Biol Chem,2006,281(16):11260-11270.
[19]Sun Y,Sukumaran P,Varma A,et al.Cholesterol-induced activation of TRPM7regulates cell proliferation,migration,and viability of human prostate cells[J].Biochim Biophys Acta,2014,1843(9):1839-1850.
[20]Canel M,Serrels A,Frame MC,et al.E-cadherin-integrin crosstalk in cancer invasion and metastasis[J].J Cell Sci,2013,126(2):393-401.
[21]Wang J,Xiao L,Luo CH,et al.Overexpression of TRPM7is associated with poor prognosis in human ovarian carcinoma[J].Asian Pac J Cancer Prev,2014,15(9):3955-3958.
[22]Middelbeek J,Kuipers AJ,Henneman L,et al.TRPM7is required for breast tumor cell metastasis[J].Cancer Res,2012,72(16):4250-4261.
