二氢杨梅素对胃癌细胞SGC7901生长活性及凋亡的影响
2015-03-18武彦芳路玉洁
武彦芳,路玉洁,鞠 境
(1.陕西省第四人民医院消化内科,西安710043;2.南京医科大学生物化学与分子生物学系 210029)
胃癌是目前全球范围内常见的恶性肿瘤之一。据WHO统计,在2012年,全球有72.3万人由于罹患胃癌而死亡。我国作为胃癌的高发区,其发病率占全球发病的40%,居恶性肿瘤的第3位,仅次于肺癌和肝癌。目前胃癌的治疗,多采用多种干预措施,如外科手术、放射治疗和化学治疗等,其中化学治疗以治愈疾病或显著延长生命并改善患者生活质量的效果而受到广泛关注。但是化学治疗药物本身具有较大的毒副作用,易对患者产生较大生理、心理负担[1],因此寻找高效低毒的化学治疗药物对胃癌的治疗具有重要意义。
藤茶(vine tea)又名“莓茶”,已鉴定出藤茶中含有19种人体必须的营养成分和微量元素。从藤茶的茎叶中可提取的一种二氢黄酮醇类化合物命名为二氢杨梅素(dihydromyricetin,DMY)[2],它具有抗菌、抗氧化、保肝、抗肿瘤、调节血糖血脂等多种生物活性,但其抗癌作用机制尚不明确。既往研究报道,DMY可联合丝裂霉素抑制胃癌细胞的生长[3],但是从藤茶中直接提取的DMY对胃癌细胞的作用未见报道。
本研究通过超声中性水浸提法提取藤茶中的活性成分DMY,经过反相高效液相色谱(RP-HPLC)分离纯化后的DMY的纯度达到99%以上;以人胃癌细胞SGC7901为研究对象,使用CCK-8比色法检测提取出来的DMY对胃癌细胞活性的抑制效应,并使用流式细胞术检测DMY促进细胞凋亡的能力,为将来进一步研发DMY作为胃癌化学治疗药物奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要材料 人胃癌细胞SGC7901购自中国科学院上海生命科学研究院细胞资源中心。细胞SGC7901培养于RPMI1640(添加碳酸氢钠1.5g/L,葡萄糖2.5g/L,丙酮酸钠0.11g/L)。培养基含10%胎牛血清,于37℃、5%CO2的培养箱中培养,2~3d传代。
1.1.2 试剂与仪器 野生藤茶购自湖南张家界旺盛商贸有限公司;DMY标准品购自成都曼斯特生物科技公司(纯度为98%),改良型RPMI1640(GIBCO公司,美国),胎牛血清(Hy-Clone公司,美国),CCK-8试剂盒(碧云天生物技术研究所),凋亡试剂盒(上海贝博生物)。ALPAAI-4LSC真空冷冻干燥机(Chris公司,德国),LC-20AD 高效液相色谱仪(HPLC,Shimadzu公司,日本),多功能酶标仪(Tecan公司,infinite M200)。
1.2 方法
1.2.1 提取与纯化 将藤茶样品放入粉碎机进行粉碎混匀,采用超声中性水浸提法提取藤茶中的DMY,其工艺参数为:超声功率100W,超声时间60min,液料比50∶1,提取温度90℃。将提取液真空冷冻干燥进行下一步纯化,将提取物的粉末配成25mg/mL的上样浓度,采用RP-HPLC分离纯化方法,HPLC系统:Shimadzu LC-6AD;色谱柱:Chromstar AQC18 250mm×10mm,5μm;检测器:SPD-M6A;检测波长:290 nm;进样量:5mL;洗脱液流速:5mL/min;洗脱条件如下:0~2min,0~15%甲醇;>2~4min,>15%~20%甲醇;>4~10 min,>20%~50%甲醇;>10~30min,>50%~80%甲醇;>30~50min,>80%~90%乙腈。将纯化后的提取物真空冷冻干燥,检测纯度,为细胞实验提供原材料。采用优化后的超声中性水浸提法提取藤茶中的活性成分DMY,DMY的提取率达72%,由于粗提物的纯度不能达到做细胞实验的要求,故在此基础上经过反向HPLC(RP-HPLC)进一步分离纯化。纯化后DMY的纯度达99%以上,可进行下一步的实验。
1.2.2 CCK-8比色法检测细胞活率将密度为(4~5)×103/mL的对数生长期细胞SGC7901接种在96孔板中,每孔90μL,于孵箱培养24h后,加入DMY(浓度分别为0.062 5、0.125 0、0.250 0、0.500 0、1.000 0mmoL)继续培养。干燥后的DMY用DMSO溶解,同时用1.000 0mmoL DMSO处理作为对照组。处理后每孔体积100μL,每个浓度设3个平行孔。加药后继续培养72h后,每孔分别加入10μL CCK-8试剂溶液,孵箱培养1h液体变黄后取出。用多功能酶标仪在490nm处记录吸光度(A490)。每次实验均重复3次。细胞存活率=[处理组(A490)/对照组(A490)]×100%
1.2.3 流式细胞术检测细胞凋亡 取对数生长期的细胞SGC7901,以2×105个/孔的密度接种在6孔板中,加入DMY进行处理,每组2个平行,加入DMSO作为对照组,48h后收集各组细胞和上清液,2 000r/min离心5min,弃上清液,加入PBS洗涤1次,以400μL 1×结合液重悬细胞,加入5μL Annexin V-FITC染色液,混匀后避光15min,再加入10μL PI,2~8℃避光孵育5min。流式细胞仪检测细胞凋亡。
1.3 统计学处理 采用SPSS11.0软件进行数据分析,计量资料以±s表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度DMY对胃癌细胞的杀伤效应 不同浓度的DMY处理胃癌细胞72h后,CCK-8比色法检测结果显示,DMY具有显著的体外抗肿瘤作用,并且随着处理浓度的增加,0.062 5mmoL及以上剂量实验组相对于对照组出现显著性差异。见图1。
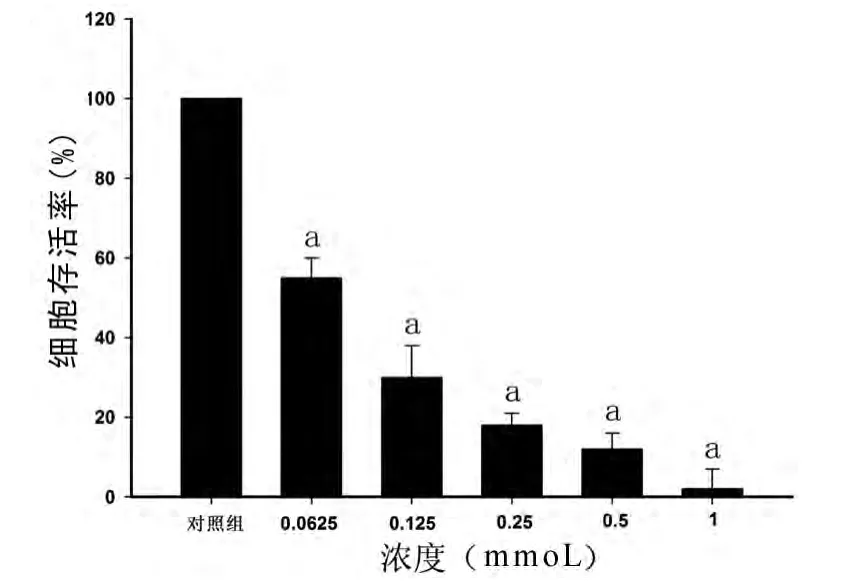
图1 DMY对细胞SGC7901的杀伤效应
2.2 DMY促进细胞SGC7901凋亡 运用流式细胞术检测细胞凋亡时,可将细胞划分为4个细胞亚群,分别为正常细胞、坏死细胞、早期凋亡细胞和晚期凋亡细胞。不同浓度的DMY处理48h后,由于在显微镜下观察到1.000 0mmoL DMY处理组的细胞呈悬浮碎片状,无法完成细胞的收集,其余浓度处理的细胞,均可观察到早期凋亡、晚期凋亡和总凋亡细胞百分比显著增加(P<0.05),见图2及表1。

图2 DMY对SGC7901细胞凋亡的影响
表1 DMY对SGC7901细胞凋亡的影响(±s,%)

表1 DMY对SGC7901细胞凋亡的影响(±s,%)
a:P<0.05,与对照组比较。
1.45±0.26 1.22±0.15 2.67±0.41 0.34±0.04 DMY处理组(mmol)0.062 5 3.36±0.46a 2.53±0.15a 4.95±0.2a 0.73±0.05 0.125 0 5.53±0.38a 3.75±0.13a 8.99±0.84a 1.23±0.11 0.250 0 7.72±0.25a 5.43±0.42a 12.59±0.39a 1.71±0.16 0.500 0 32.96±0.5a 13.01±0.48a 43.90±1.19a 1.95±0.12组别 早期凋亡细胞 晚期凋亡细胞 总凋亡细胞 坏死细胞对照组a
3 讨 论
细胞凋亡又叫做“程序性细胞死亡”,是细胞的一种生理性、主动性的“自觉自杀行为”,而非病理性死亡;并且凋亡作为机体清除损伤细胞的一种机制,有效保持机体自身发育、组织和器官的动态稳定。既往研究表明,肿瘤的发生与细胞凋亡的调节紊乱有密切关系[4]。细胞凋亡参与了癌症的起始过程,并对癌症的发生起负调控作用。癌前期细胞对细胞凋亡更为敏感,更易被清除,这是机体自我保护功能的表现[5]。实验证明,细胞凋亡与肝癌生长呈负相关。肝癌细胞组织培养显示,广泛轻微损伤或刺激可诱导试管内肝癌细胞的凋亡。Kelner等[6]指出,TGFβ-1可促进体外培养的肝癌细胞中DNA降解,并可通过受体连接使肝癌细胞发生凋亡,从而达到杀伤癌细胞的目的。
越来越多的证据表明,植物提取化合物通过细胞凋亡机制发挥抗肿瘤作用已经成为癌症治疗研究的一个新热点[7]。体外实验证明,DMY对多种癌细胞如白血病、肝癌、乳腺癌和黑色素瘤等 有 明 显 的 增 殖 抑 制 作 用[8-12]。Lin 等[13]报 道,DMY可通过激活 Cyt c、caspase-9and PARP诱导肝癌细胞凋亡。线粒体释放 Cyt c从而活化了caspase-9,而 PARP作为caspase-9的底物,在DNA损伤的修复、细胞死亡中起重要作用,它的活化是DNA损伤早期应答的指标。此外,有研究报道,DMY可显著上调P53的表达,在P53的介导下下调抗凋亡蛋白Bcl-2的表达水平,诱导细胞凋亡[14]。但是,关于DMY诱导胃癌细胞凋亡的研究尚未见报道。有研究显示,白藜芦醇可以通过对Survivin蛋白表达的调控从而诱导胃癌细胞凋亡,达到抑制肿瘤细胞生长的目的[15]。因此,推测与白藜芦醇均有相似生物活性的DMY可能也有类似的抗癌作用机制。
本研究首先使用超声中性水浸提法提取藤茶中的DMY,并将其纯化并且进行真空干燥使其可直接参与细胞实验。以胃癌SGC7901细胞为研究对象,用不同浓度的DMY进行处理,观察DMY对SGC7901细胞的存活率的影响,结果表明0.062 5~1.000 0mmol的 DMY均能不同程度地抑制肿瘤细胞增殖,并呈明显的浓度-效应关系。进一步用流式细胞术检测DMY处理过的细胞SGC7901,结果发现肿瘤细胞的早期凋亡、晚期凋亡和总凋亡细胞百分比都成明显上升趋势。由于肿瘤细胞中的细胞增殖与凋亡的平衡失调,细胞凋亡程序被扰乱,导致肿瘤细胞中这一机制失去作用,所以它能够肆意增殖[16]。促使肿瘤细胞凋亡已经作为一种治疗癌症的主要措施之一[17]。大量对肿瘤细胞凋亡的研究提供了一个令人信服的解释,即肿瘤并非死于DNA损伤而是重新诱发了凋亡程序,DNA损伤在凋亡诱导中也许十分重要,但是不可能直接杀死细胞,因此凋亡可能是诱导肿瘤死亡的机制[18]。既往研究表明,DMY能有效促进乳腺癌细胞 MDA-MB-231、肝癌细胞HepG2的凋亡,有助于细胞凋亡程序的修复和维持内环境稳定,细胞增殖和凋亡间的平衡对抑制肿瘤的持续发展可能具有重要意义。因此,本研究结果提示DMY促进肿瘤细胞凋亡的发生可能是其防治胃癌发生发展的重要机制之一。
综上所述,本实验以人胃癌细胞SGC7901为研究对象,利用超声中性水浸提法提取藤茶中的DMY,并观察DMY对肿瘤细胞生长活性的影响,结果发现DMY能够呈浓度依赖性地抑制肿瘤细胞的增殖能力,促进细胞凋亡。本研究明确了DMY促进胃癌细胞凋亡的作用,为进一步研究DMY抑制胃癌发生发展的分子机制提供了依据。
[1]石瑞馥.胃癌化学治疗患者的护理体会[J].中国医药指南,2011(27):318-319.
[2]Zhu H,Luo P,Fu Y,et al.Dihydromyricetin prevents cardiotoxicity and enhances anticancer activity induced by adriamycin[J].Oncotarget,2015,6(5):3254-3267.
[3]吴明彩,蒋明,毕富勇.二氢杨梅素联合丝裂霉素对胃癌细胞的生长抑制作用[J].中国病理生理杂志,2011,27(7):1424-1427.
[4]Wright SC,Zhong J,Larrick JW.Inhibition of apoptosis as a mechanism of tumor promotion[J].FASEB J,1994,8(9):654-660.
[5]Daniel D,Wilson NS.Tumor necrosis factor:Renaissance as a cancer therapeutic[J].Curr Cancer Drug Targets,2008,8(2):124-131.
[6]Kelner MJ,Mcmorris TC,Montoya MA,et al.Characterization of acylfulvene histiospecific toxicity in human tumor cell lines[J].Cancer Chemother Pharmacol,1998,41(3):237-242.
[7]Athar M,Back JH,Kopelovich L,et al.Multiple molecular targets of resveratrol:anti-carcinogenic mechanisms[J].Arch Biochem Biophys,2009,486(2):95-102.
[8]周防震,张晓元,孙奋勇,等.二氢杨梅素对人乳腺癌细胞MDA-MB-231的体外抗增殖作用[J].肿瘤防治研究,2012,39(1):95-97.
[9]周防震,张晓元,詹远京,等.二氢杨梅素抑制人乳腺癌细胞侵袭和下调 MMP-2/-9蛋白表达研究[J].生物化学与生物物理进展,2012(4):352-358.
[10]高倩倩,杨秀芬,欧敏.藤茶总黄酮和二氢杨梅素含药血清对肝癌HepG2细胞增殖及凋亡的影响[J].中国中药杂志,2011,36(4):500-503.
[11]Liu J,Shu Y,Zhang Q,et al.Dihydromyricetin induces apoptosis and inhibits proliferation in hepatocellular carcinoma cells[J].Oncol Lett,2014,8(4):1645-1651.
[12]Zeng G,Liu J,Chen H,et al.Dihydromyricetin induces cell cycle arrest and apoptosis in melanoma SK-MEL-28 cells[J].Oncol Rep,2014,31(6):2713-2719.
[13]Lin B,Tan X,Liang J,et al.A reduction in reactive Oxygen species contributes to dihydromyricetin-induced apoptosis in human hepatocellular carcinoma cells[J].Sci Rep,2014,4:7041.
[14]Wu S,Liu B,Zhang Q,et al.Dihydromyricetin reduced Bcl-2expression via p53in human hepatoma HepG2cells[J].PLoS One,2013,8(11):e76886.
[15]李洁,熊兴耀,曾建国,等.白藜芦醇的研究进展[J].中国现代中药,2013,15(2):100-108.
[16]Winter M,Sombroek D,Dauth I,et al.Control of HIPK2 stability by ubiquitin ligase Siah-1and checkpoint kinases ATM and ATR[J].Nat Cell Biol,2008,10(7):812-824.
[17]姬俊成,徐亮.胃癌靶向化疗及相关治疗的研究进展[J].现代诊断与治疗,2009,20(1):43-47.
[18]Haq R,Fisher DE.Improving apoptotic responses to targeted therapy[J].Oncotarget,2013,4(9):1331.
