趋化因子配体10及趋化因子受体3在膀胱癌中的表达及意义*
2015-03-18彭晓晖梁培育欧善际祖雄兵
彭晓晖,梁培育,欧善际,祖雄兵
(1.海南医学院附属医院泌尿外科,海口570102;2.中南大学湘雅医院泌尿外科,长沙410008)
膀胱癌是我国泌尿外科最常见的恶性肿瘤,其发病率及病死率在泌尿系统肿瘤中居首位[1]。膀胱癌的主要诊断方法为膀胱镜检查和尿细胞学检查。其中膀胱镜检查是有创检查,患者不易接受。而尿细胞学检查的特异度较高,但灵敏度略低。荧光膀胱镜检查可以发现普通膀胱镜不易发现的小肿瘤及原位癌,荧光膀胱镜的缺点是其诊断膀胱癌的特异度不高,膀胱炎症、膀胱癌电切术和膀胱灌注治疗均会导致假阳性结果的发生[2]。而趋化因子配体10(CXCL10)及趋化因子受体3(CXCR3)可能会成为膀胱癌检查及治疗的靶目标之一。CXCL10与CXCR3结合产生相应的效应,通过激活免疫系统或抑制肿瘤血管的形成抑制肿瘤生长;通过促进肿瘤细胞增殖,分泌产生蛋白水解酶,诱导血管生成从而促进肿瘤发展与转移。本文通过对检测膀胱癌患者血中CXCL10和外周血单一核细胞中CXCR3的表达,探讨CXCL10/CXCR3反应轴与膀胱癌发生、发展、转移的关系及临床意义。
1 资料与方法
1.1 一般资料 选取2012年6月至2013年6月于海南医学院附属医院泌尿外科收治的80例首次诊断原发性膀胱癌住院患者为试验组。试验组患者入选4周内未使用过任何药物,未接受化学治疗和放射治疗,肝、肾功能正常。排除并发感染性疾病、系统性慢性疾病、肝肾功能不全患者,以及近1个月使用过糖皮质激素、免疫抑制剂等药物的患者。试验组中男50例,女30例;年龄35~75岁,平均(51.20±8.78)岁;中高分化46例,低分化34例;Ta期22例,T1期14例,T2期15例,T3+4期29例;肿瘤直径小于2cm者45例,≥2cm者35例;其中有19例发生淋巴结转移。取33例健康体检者为对照组,男20例,女13例;平均年龄(49.52±9.15)岁。对照组均无既往病史,无使用糖皮质激素、免疫抑制剂等药物的记录。试验组及对照组间年龄及性别构成差异无统计学意义(P>0.05)。
1.2 标本收集 膀胱癌患者确诊后未给予任何治疗,于次日凌晨空腹抽取肘静脉血5mL,即刻进行高速离心,吸取上清液,于-70℃低温冰箱冷冻保存;采用相同方法收集对照组血清。
1.3 主要试验方法 ELISA法检测血清中CXCL10的水平,CXCL10鼠抗人单克隆抗体ELISA检测试剂盒,购自R&D公司。详细方法参照试剂盒及实验设备说明书进行。逆转录-聚合酶链反应(RT-PCR)测定外周血单一核细胞中CXCR3mRNA的表达量:外周血用乙二胺四乙酸(EDTA)抗凝,采用等体积Hanks液稀释,梯度离心,分离出外周血单一核细胞。采用RNA试剂盒(上海生工生物工程有限公司)严格按照说明书提取总RNA。RT-PCR采用一步法 RT-PCR试剂盒(Bio Basic公司提供)。引物序列:CXCR3上游引物为5′-CCA ACC ACA AGT GCC AAA GG-3′,下游引物为5′-CCA TAA TCG TAG GGA GAT GTG-3′,扩增片段172bp,内参β-actin引物序列:上游引物5′-GTG GAC ATC CGC AAA GAC-3′,下游引物5′-AAA GGG TGT AAC GCA ATC AA-3′,扩增片段为305bp。基因引物由上海生工生物工程技术有限公司合成。PCR反应步骤、反应体系等参照文献进行。
1.4 统计学处理 采用SPSS19.0软件进行数据分析处理,计量数据以±s表示,采用t检验,方差不齐则用t′检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组中CXCL10的表达及对比研究 CXCL10在试验组及对照组中的表达水平分别是(872.46±121.22)pg/L和(481.95±105.97)pg/L,差异有统计学意义(t=13.75,P<0.01)。
2.2 两组中CXCR3的表达及对比研究 以β-action mRNA为内参计算CXCR3mRNA的相对表达量,试验组及对照组外周血单一核细胞中CXCR3mRNA的拷贝数量分别为0.236±0.098、0.098±0.046,差异有统计学意义(t=7.187,P<0.01)。
2.3 试验组CXCL10与CXCR3的表达和膀胱癌临床各病理特征的关系 膀胱癌患者血清CXCL10及CXCR3mRNA的表达与年龄、病理分期、分化程度、肿瘤大小等均不存在相关性(P>0.05),其中,CXCL10及CXCR3mRNA的表达虽然与病理分期无明显相关性,但检测数据显示,随着病理分期的加重,CXCL10及CXCR3mRNA的表达有逐渐升高的趋势,但差异无统计学意义(P>0.05);膀胱癌患者血清CXCL10及CXCR3mRNA的表达均与有无淋巴结转移相关(P<0.05),见表1。
表1 膀胱癌中CXCL10与CXCR3的表达和临床各病理特征的关系(±s)
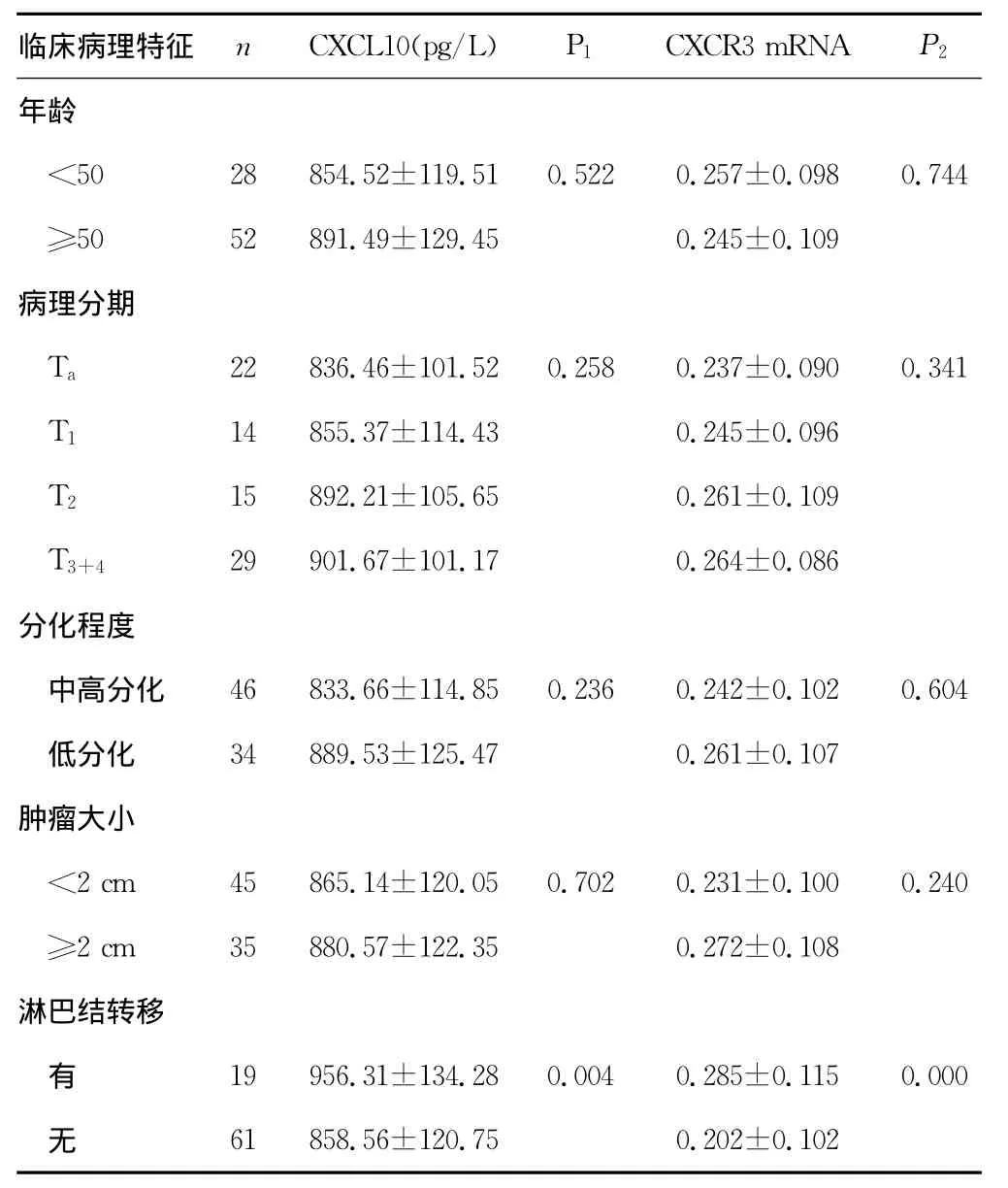
表1 膀胱癌中CXCL10与CXCR3的表达和临床各病理特征的关系(±s)
P1:CXCL10统计学处理P值;P2:CXCR3统计学处理P值。
临床病理特征 n CXCL10(pg/L) P1 CXCR3mRNA P2年龄<50 28 854.52±119.51 0.522 0.257±0.098 0.744≥50 52 891.49±129.45 0.245±0.109病理分期Ta 22 836.46±101.52 0.258 0.237±0.090 0.341 T1 14 855.37±114.43 0.245±0.096 T2 15 892.21±105.65 0.261±0.109 T3+4 29 901.67±101.17 0.264±0.086分化程度中高分化 46 833.66±114.85 0.236 0.242±0.102 0.604低分化 34 889.53±125.47 0.261±0.107肿瘤大小<2cm 45 865.14±120.05 0.702 0.231±0.100 0.240≥2cm 35 880.57±122.35 0.272±0.108淋巴结转移有19 956.31±134.28 0.004 0.285±0.115 0.000无61 858.56±120.75 0.202±0.102
3 讨 论
趋化因子是一类拥有诱导属性的促炎细胞因子,其受体是一组G耦联蛋白。根据其末端半胱氨酸序列的位置可分为4大类:C、CC、CXC和CXXXC。趋化因子作用广泛,在感染性疾病、炎症性疾病、自身免疫系统疾病、肿瘤、变态反应、移植排斥、新生血管形成、AIDS及淋巴细胞归巢等众多疾病过程及生理过程中均有趋化因子的参与[3]。趋化因子与靶细胞表面特异性受体相结合才能发挥其众多的病理生理效应[4]。在参与肿瘤的生物学效应中,一方面,趋化因子通过激活免疫活性细胞或抑制血管形成来抑制肿瘤的生长;而另一方面,趋化因子也可通过促进肿瘤细胞增殖,大量分泌蛋白水解酶,以及诱导血管生成从而促进肿瘤的发展和转移[5]。CXC趋化因子亚家族是一组与肿瘤的发展及转移密切相关的细胞因子。CXCR3及CXCL10在肿瘤发生、发展及转移中发挥着重要作用[6]。
本研究对80例膀胱癌患者及33例健康体检者进行了CXCL10及CXCR3的检测,膀胱癌患者外周血清中CXCL10及外周血单一核细胞中CXCR3mRNA的表达量均显著高于对照者,提示CXCL10及CXCR3在膀胱癌的发生过程中可能起到一定的作用。通过与临床各参数之间的检验分析得出CXCL10及CXCR3的表达与临床因素如膀胱癌患者年龄、分化程度、肿瘤大小、病理分期等因素没有明显的相关性,但数据显示,随着临床病理分期的加重,CXCL10及CXCR3的表达水平有升高的趋势,提示CXCL10与CXCR3的表达与膀胱癌的发展可能存在相关性,这有待于大样本临床资料的验证。CXCL10及CXCR3的高表达与肿瘤的侵袭和转移有关。Bedognetti等[7]研究显示,恶性黑色素瘤中CXCR3的表达与黑色素瘤大小、有无淋巴结转移及远端转移等密切相关。Hilborn等[8]研究发现,乳腺癌组织中CXCR3和CXCL10表达越高,转移的淋巴结也越多。Chaturvedi等[9]指出,CXCR3与肿瘤转移有关的机制可能是由于CXCR3高表达的恶性肿瘤细胞更容易迁徙至表达CXCR3配体的特异性靶器官。Kawada等[10]报道结肠癌中CXCR3的表达与淋巴结转移存在密切的关系,同时着重提示,在结肠癌常见的一些转移部位如肺、肝、淋巴结中可检测到CXCR3的配体CXCL10。本研究结果发现淋巴结转移组CXCL10和CXCR3的表达明显高于无淋巴结转移组,这表明CXCL10和CXCR3可能在膀胱癌的淋巴结转移过程中起作用。因此推断,对CXCL10/CXCR3与膀胱发病机制的深入研究有望为膀胱癌发病机制的研究及预后疗效判断等打下分子生物学理论基础;利用分子生物学手段,阻断CXCL10/CXCR3反应轴,可能会成为膀胱癌治疗的一个新靶点。本次实验因条件限制,未进行阻断CXCL10/CXCR3反应轴对膀胱癌治疗影响的相关研究,将在今后的研究中进一步探索。
[1]彭晓晖,梁培育,欧善际,等.GRIM-19的表达与膀胱癌组织临床特征的相关性研究[J].海南医学院学报,2013,19(10):1372-1374.
[2]Perlis N,Zlotta AR,Beyene J,et al.Immediate post-transurethral resection of bladder tumor intravesical chemotherapy prevents non-muscle-invasive bladder cancer recurrences:an updated meta-analysis on 2548patients and quality-of-evidence review[J].Eur Urol,2013,64(3):421-430.
[3]Jawa RS,Quist E,Boyer CW,et al.Mesenteric ischemiareperfusion injury up-regulates certain CC,CXC,and XC chemokines and results in multi-organ injury in a time-dependent manner[J].Eur Cytokine Netw,2014,24(4):148-156.
[4]Bernat V,Heinrich MR,Baumeister P,et al.Synthesis and application of the first radioligand targeting the allosteric binding pocket of chemokine receptor CXCR3 [J].ChemMedChem,2012,7(8):1481-1489.
[5]Singh AK,Arya RK,Trivedi AK,et al.Chemokine receptor trio:CXCR3,CXCR4and CXCR7crosstalk via CXCL11and CXCL12[J].Cytokine Growth Factor Rev,2013,24(1):41-49.
[6]Murakami T,Kawada K,Iwamoto M,et al.The role of CXCR3and CXCR4in colorectal cancer metastasis[J].Int J Cancer,2013,132(2):276-287.
[7]Bedognetti D,Spivey TL,Zhao Y,et al.CXCR3/CCR5pathways in metastatic melanoma patients treated with adoptive therapy and interleukin-2[J].Br J Cancer,2013,109(9):2412-2423.
[8]Hilborn E,Sivik T,Fornander T,et al.C-X-C ligand 10 and C-X-C receptor 3status can predict tamoxifen treatment response in breast cancer patients[J].Breast Cancer Res Treat,2014,145(1):73-82.
[9]Chaturvedi P,Gilkes DM,Wong CC,et al.Hypoxia-inducible factor-dependent breast cancer-mesenchymal stem cell bidirectional signaling promotes metastasis[J].J Clin Invest,2013,123(1):189-205.
[10]Kawada K,Taketo MM.Significance and mechanism of lymph node metastasis in cancer progression[J].Cancer Res,2011,71(4):1214-1218.
