脊髓损伤大鼠的学习记忆功能与海马病理改变
2015-03-04冯东亮南伟伍亚民王莉江龙周开升朱彦东汪静洪有建龙在云张海鸿
冯东亮,南伟,伍亚民,王莉,江龙,周开升,朱彦东,汪静,洪有建,龙在云,张海鸿
脊髓损伤大鼠的学习记忆功能与海马病理改变
冯东亮1,2,南伟1,2,伍亚民3,王莉3,江龙3,周开升1,2,朱彦东1,2,汪静1,2,洪有建3,龙在云3,张海鸿1,2
[摘要]目的探究脊髓损伤后大鼠学习记忆功能与海马病理变化特点及关系。方法36只成年雌性Sprague-Dawley大鼠随机分为假手术组(n=18)和损伤组(n=18)。用Allen法打击T10脊髓制备脊髓损伤模型,打击强度为10 g×25 mm。损伤后1 d、3 d及1~5周每周1次行BBB后肢功能评分;术后5周时检测运动诱发电位,行Morris水迷宫测试;术后1周、3周、5周各组分别取4只大鼠行HE染色,检测海马细胞形态变化。结果术后每个时间点,损伤组BBB评分均低于假手术组(P<0.05)。术后5周,损伤组运动诱发电位N1、P1波潜伏期显著长于假手术组(P<0.001),振幅显著低于假手术组(P<0.001)。Morris水迷宫测试,损伤组到达平台潜伏期显著长于假手术组(P<0.001),在目标象限的探索时间显著少于假手术组(P<0.001),且多以系统定位或环形定位方法寻找目标平台,而假手术组则以空间定位方法为主。HE染色显示,1周时,损伤组海马组织有少量细胞形态异常;随着时间延长,海马内形态异常细胞逐渐增多,存活细胞逐渐减少;假手术组HE染色基本正常。结论脊髓损伤可引起大鼠学习记忆功能障碍,可能与海马细胞损伤有关。
[关键词]脊髓损伤;学习记忆功能;海马;病理;大鼠
[本文著录格式]冯东亮,南伟,伍亚民,等.脊髓损伤大鼠的学习记忆功能与海马病理改变[J].中国康复理论与实践, 2015, 21(11): 1267-1272.
CITED AS: Feng DL, Nan W, Wu YM, et al. Learning and memory impairment and pathology in hippocampusin ratswith spinal cord injury [J]. Zhongguo Kangfu LilunYu Shijian, 2015, 21(11): 1267-1272.
脊髓损伤分为原发性和继发性脊髓损伤。原发性脊髓损伤主要为损伤后即刻发生的损伤;继发性损伤持续时间较长,包括一系列复杂的病理过程,是引起机体功能损伤的主要原因。关于脊髓损伤后脊髓自身发生的一系列病理变化过程已有大量研究。本文主要探究脊髓损伤后大脑海马结构的变化及其与认知功能障碍的关系。
1 材料与方法
1.1实验动物及分组
36只成年Sprague-Dawley大鼠,雌性,体质量200~230g,由第三军医大学大坪医院野战外科研究所动物中心提供(许可证号:SYXK(渝)2012-0010)。实验前1周,动物在实验室饲养,自然昼夜采光,自由饮水及饮食,室温25~28℃。动物饲养及实验过程均遵守实验动物管理及保护的有关规定。
将动物编号,随机数字法分为假手术组和损伤组,每组18只。
1.2主要仪器和试剂
HE染色试剂盒:北京索莱宝生物科技有限公司,批号G1120。戊巴比妥钠:德国进口分装,北京化学试剂公司,批号100808。ST-7立体定位仪:日本Narishige公司。多道生理记录仪:澳大利亚AD instruments公司,型号ML408。Allen打击器:美国新泽西州大学,型号RM2007。RM2000R石蜡切片机:LEICA公司。病理组织漂烘仪:中威PHY-111。
1.3模型建立
大鼠术前禁食12 h。1%戊巴比妥钠4 ml/kg腹腔注射,角膜反射消失表明麻醉成功。俯卧位固定于手术台上,剃去背部皮毛,碘伏及酒精术区皮肤消毒。定位T10,以T10为中心在背部正中切一长约2 cm的切口,钝性分离棘突上的肌肉,咬开T9-11椎板,显露脊髓(未损伤硬脊膜)。用Allen打击器打击T10脊髓,打击强度10g×25mm,打击后立即移开打击棒。造模成功的标准:打击后大鼠后肢发生不同程度抽搐之后瘫软,尾巴发生痉挛性摆动。假手术组仅咬开椎板,不打击。
逐层缝合肌肉和皮肤,放回笼中,置于25~28℃动物房内。术后予青霉素1.6×105U肌肉注射,连续3 d;每天3次按摩膀胱排尿,直至恢复自主排尿。
1.4检测指标
1.4.1行为学评分
造模后1 d、3 d、1周、2周、3周、4周、5周,采用Basso-Beattie-Bresnahan (BBB)评分法[1]评估大鼠后肢行为学功能。1 d、3 d评分时,偏离平均值2分以上者剔除,重新造模补充。评分由2名熟悉BBB评分方法的非本组实验人员进行,将大鼠逐一放入旷场内,观察其活动4min,评估其后肢功能。
1.4.2运动诱发电位
造模后5周检测各组大鼠的运动诱发电位(motor evoked potential, MEP)。刺激电极为直径约2 mm的单极银球电极。用脑立体定位仪固定大鼠头部,在矢状线旁3.5 mm,人字缝下2.5 mm处,用牙科钻开一直径约3 mm的小孔。微电极操纵器将银球电极推至大脑皮层运动区,与硬脑膜保持良好接触,但不损伤脑组织。圆盘银片置于硬腭下。刺激频率4 Hz,波宽0.2ms,强度5mV。
记录电极为双极银针,插入小腿腓肠肌,两极间距约5 mm。采集信号经放大器输送至电脑进行处理分析。放大器放大倍数10万倍,计算机叠加64次后平均。每只大鼠记录3次,取平均值。
1.4.3 Morris水迷宫检测
造模后5周行Morris水迷宫检测。在圆形水箱内加入自来水,水温(24±1)℃,水面超过平台约2 cm,加入墨汁使液面呈黑色增加对比度。先行航行训练,每天将每只老鼠从不同象限各训练1次,连续4 d,每天第1次训练时均从目标象限的对侧象限放入,一次一只,记录大鼠每天第1次找到平台的潜伏期[2]。第5天取出平台,将大鼠从对侧象限放入水迷宫内,行空间探索实验,记录其通过目标象限的时间及其探索目标象限的路线方式。
依据文献[3],搜索目标的定位方式分3种:①空间定位为直接朝向平台或目标象限游去,路线中不多于1个环形;②系统定位为主要在水箱中央往返运动,路线没有特殊形状,不能很快找到目标;③环形定位为主要围绕水桶边缘做密封的环形循环运动。统计5 d中大鼠运动的路线方式,计算每组大鼠每种运动形式的百分比。
全部数据用Smart 2.0软件(Panlab公司)分析。
1.4.4形态学检测
造模后1周、3周、5周时,每组各取4只动物,用0.01 mol/L PBS从左心室快速灌注,至右心耳流出液体变清亮后,改用4%多聚甲醛灌注固定。取出大脑组织,4%多聚甲醛灌后固定2 d。酒精梯度脱水,石蜡包埋,冠状面连续石蜡切片。每隔15片取1片,每只大鼠取5片,切片厚5 μm,脱蜡行HE染色,观察大鼠海马内病理变化情况。每张切片取不重复的5个视野计数存活细胞数目,计算所占比例。
1.5统计学分析
所有数据均用(xˉ±s)表示,采用SPSS19.0软件进行统计分析。BBB评分值和诱发电位潜伏期及波幅采用独立样本t检验,水迷宫数据、HE染色的细胞计数数据采用单因素方差分析(One-Way ANOVA)。显著性水平α=0.05。
2 结果
2.1一般情况
损伤组大鼠苏醒后,精神不佳,双下肢运动功能丧失,出现尿潴留;72 h内,部分大鼠出现血尿和腹部胀气现象,之后慢慢好转,1周左右基本恢复排尿。术后2周内,损伤组体质量下降10~15 g,之后逐渐恢复,部分大鼠后肢有轻微肌肉萎缩。假手术组大鼠苏醒后即可有部分运动,1周后基本恢复正常。
2.2BBB评分
损伤组3 d内所有大鼠评分均为0~3分;术后2~3周功能恢复最迅速,3周后功能恢复基本稳定。损伤组各时间点大鼠评分均低于假手术组(P<0.05)。见图1。
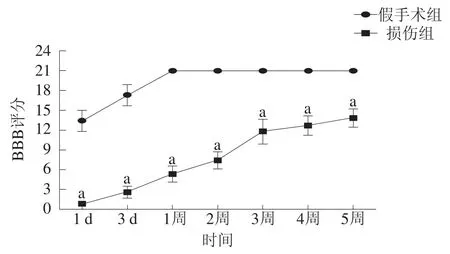
图1 术后两组各时间点BBB评分比较
2.3MEP
损伤组MEP的N1和P1波潜伏期均显著长于假手术组(P<0.001),振幅显著低于假手术组(P<0.001)。见图2、图3。
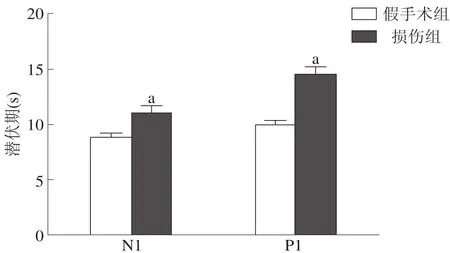
图2 两组大鼠MEPN1和P1波潜伏期比较
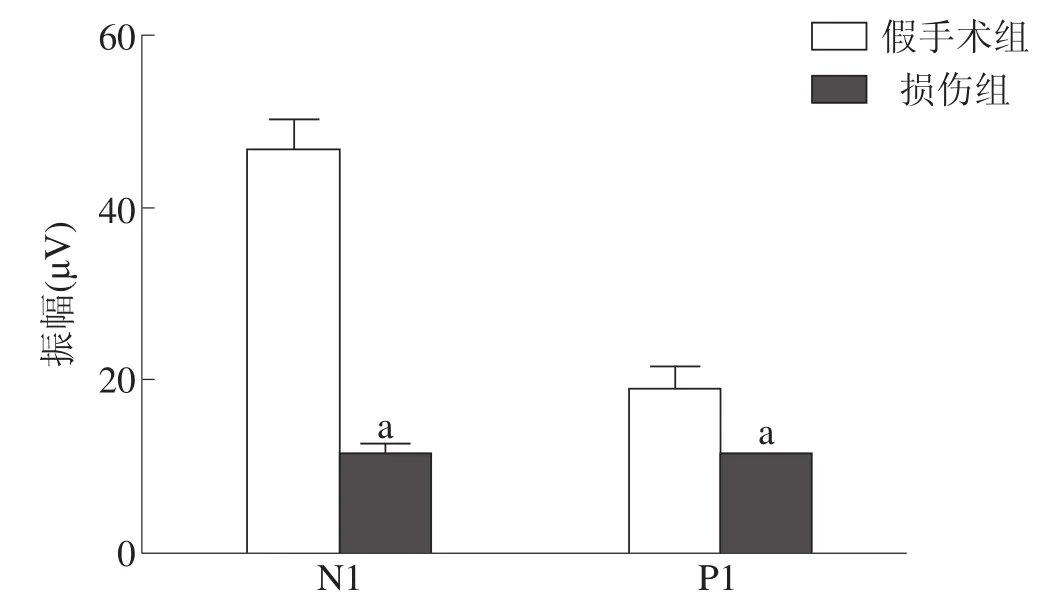
图3 两组大鼠MEPN1和P1波振幅比较
2.4Morris水迷宫
损伤组和假手术组找到平台的潜伏期均随着训练时间的增加而降低;各时间点损伤组的潜伏期显著长于假手术组(P<0.001)。见图4。
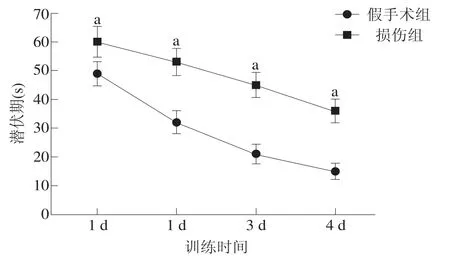
图4 两组大鼠到达平台潜伏期比较
探索实验时,损伤组经过目标象限的时间显著低于假手术组(P<0.001)。假手术组找寻平台的路线77%是空间定位,显著高于损伤组的48%。见图5、图6。
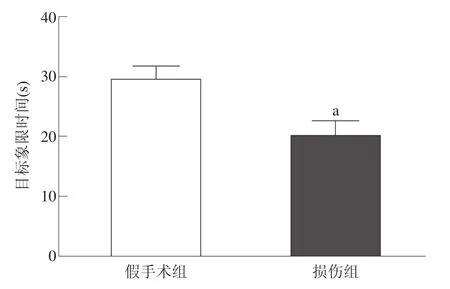
图5 两组大鼠经过目标象限时间比较
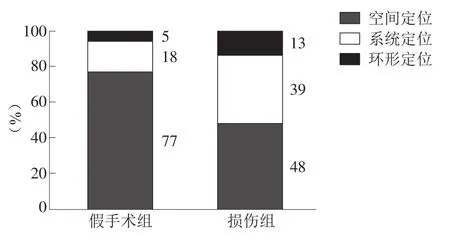
图6 两组大鼠搜寻平台方式比较
2.5海马病理
假手术组齿状回颗粒细胞排列整齐结构紧密,形态完整,细胞核饱满、核仁清晰。损伤组海马内病理变化主要以齿状回细胞为主:1周时可见齿状回颗粒细胞排列较稀疏、紊乱,有少量细胞形态不规则,呈三角形、胞膜皱缩、胞核固缩、破裂、浓染,核仁模糊或消失;3周、5周时细胞排列更稀疏,形态异常细胞逐渐增多,正常存活细胞逐渐减少。见图7。
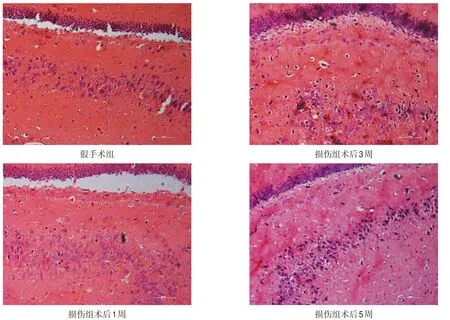
图7 不同时间点大鼠海马齿状回病理变化(HE染色,200×)
损伤组存活细胞比例少于假手术组(P<0.05),并随着时间推移逐渐减少。见图8。
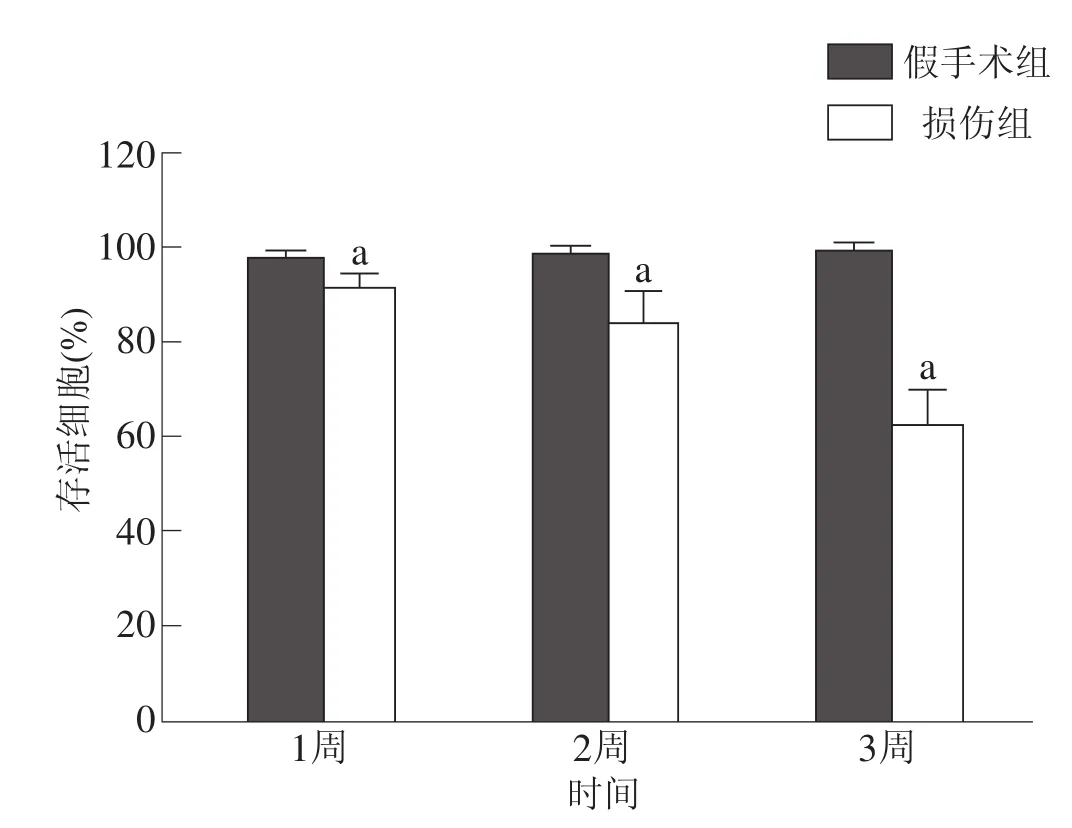
图8 术后两组各时间点海马齿状回存活细胞百分比比较
3 讨论
脊髓损伤的致瘫率极高,一直是神经科学领域研究的热点、难点。长期以来,人们主要关注脊髓本身或其传入和传出通路的研究,对脊髓损伤后脑部结构及功能变化的研究较少。随着研究进展,人们发现脊髓损伤后脑内重要组织的结构和功能也会发生改变。
脊髓损伤后几分钟内就可引起大脑皮质网络结构发生广泛改变,为早期大脑皮层萎缩与重塑的基础[4-5]。临床及基础研究均证实,脊髓损伤能够引起大脑皮层发生结构及功能重塑[6-7],可能为脊髓损伤后上行神经传导阻滞所致[8]。脊髓损伤早期补充外源性神经营养因子,可以减少大脑皮质萎缩,促进神经功能恢复与重塑[9]。
海马是脊髓损伤后最易损伤的脑部结构,可能与脊髓损伤能够选择性引起海马内脑源性神经营养因子(brain-derivedneurotrophicfactor, BDNF)变化有关[10-11]。
Morris水迷宫测试是大鼠学习记忆功能的常用方法之一[3]。分析找寻目标的路线方式,可以排除运动功能障碍对结果的影响,从而更客观地评价其空间记忆能力[12]。本研究没有评估通过平台次数、运动路程及速度等指标,也是为了降低运动功能障碍对实验结果的影响。本研究显示,脊髓损伤后大鼠的空间学习记忆功能受损。
MEP主要用来评估脑部到脊髓传导通路是否正常。运动皮层的前半部分控制上肢运动,后半部分控制下肢运动。波幅大小可以反映放电神经元的数量及功能状态,波幅下降说明神经元的兴奋性降低[13]。N1波潜伏期与神经传导速度及传导路径中所经历的突触数和突触延搁时间有关[14-16]。相同条件下,N1波潜伏期可以反映脑内细胞损伤的严重程度。本研究显示,脊髓损伤后,脑内重要结构发生损伤。
海马是参与学习、记忆等高级脑功能的重要结构成分,海马损伤严重影响学习记忆功能[17]。本研究显示,脊髓损伤后,海马齿状回细胞发生病理变化。成年海马齿状回的颗粒细胞存在再生功能,终生保持生成新神经元的能力,这种新生神经元对海马功能的维持至关重要[18]。在学习记忆时,主要依靠海马齿状回新生神经元形成新的突触联系,将不同的时间及空间信息连接起来。同时,齿状回新生神经元具有一定的可塑性,与海马突触的长时效应密切相关,也是学习记忆的重要机制。脊髓损伤后,海马齿状回颗粒细胞发生病理改变,可能引起其认知功能障碍。
引起海马病理改变的机制还不清楚。大鼠脊髓损伤后,可通过激活细胞周期蛋白活化小胶质细胞,从而引起脑内炎症反应,诱导海马结构及功能变化,导致其认知功能障碍[19-20]。脊髓损伤诱导脑内炎症反应的具体途径及机制推测可能与脑内神经递质变化或促炎细胞因子及神经毒素分子有关[21-22]。也有学者认为可能与慢性社会心理应激有关[23]。这些假设尚需进一步深入研究验证。
脊髓损伤可引起脑内重要组织发生结构及功能改变。这对于临床治疗脊髓损伤及进一步探究脊髓损伤的完整机制有指导意义。提示临床治疗脊髓损伤患者时,不能仅关注脊髓功能,也要对脑给予足够重视。
[参考文献]
[1] Basso DM, Beattie MS, Bresnahan JC. A sensitive and reliable locomotor rating scale for open field testing in rats [J]. J Neurotrauma, 1995, 12(1): 1-21.
[2]赵中兴,伍亚民.一种新的大鼠创伤后应激障碍模型的建立及其行为学检测[J].第三军医大学学报, 2012, 34(10): 928-932.
[3] Zhao Z, Loane DJ, Murray MG 2nd, et al. Comparing the predictive value of multiple cognitive, affective, and motor tasks after rodent traumatic brain injury [J]. JNeurotrauma, 2012, 29 (15): 2475-2489.
[4] Aguilar J, Valera DH, Calvino EA, et al. Spinal cord injury immediately changes the state of the brain [J]. J Neurosci, 2010, 30(22): 7528-7537.
[5] Zhu L, Wu G, Zhou X, et al. Altered spontaneousbrain activity inpatients with acute spinal cord injury revealed by resting-statefunctional MRI [J]. PLoSOne, 2015, 10(3): 1-11.
[6] Lau BY, Foldes AE, Alieva NO, et al. Increased synapsin expression and neurite sprouting in lamprey brain after spinalcordinjury [J]. Exp Neurol, 2011, 228(2): 283-293.
[7] Zhang K, Zhang J, Zhou Y, et al. Remodeling the dendritic spines in the hindlimb representation of the sensory cortex after spinal cord hemisection in mice[J]. PLoSOne, 2015, 10(7): 1-16.
[8] Freund P, Weiskopf N, Ward NS, et al. Disability, atrophy and cortical reorganization following spinal cord injury [J]. Brain, 2011, 134(Pt 6): 1610-1622.
[9] Ramu J, Bockhorst KH, Grill RJ, et al. Cortical reorganization in NT3-treated experimental spinal cord injury: functional magneticresonanceimaging[J]. Exp Neurol, 2007, 204(1): 58-65.
[10] Fumagalli F, Madaschi L, Caffino L, et al. Acute spinal cord injury reduces brain derived neurotrohic factor expression in rat hippocampus[J]. Neuroscience, 2009, 159(3): 936-939.
[11] Gomez-Pinilla F, Ying Z, Zhuang Y. Brain and spinal cord interaction: protectiveeffectsof exerciseprior to spinal cord injury [J]. PLoSOne, 2012, 7(2): 1-8.
[12] Wu JF, Stoica BA, Luo T, et al. Isolated spinal cord contusion in ratsinduceschronic brain neuroinflammation, neurodegeneration, and cognitive impairment [J]. Cell Cycle, 2014, 13(15): 2446-2458.
[13] Amorim A, Pereira L. Prosand consin theuseof SNPsin forensic kinship investigation: a comparative analysis with STRs[J]. Forensic Sci Int, 2005, 150(1): 17-21.
[14]孟素峰,李有清,王启明.体感诱发电位监测脊髓缺血再灌注损伤的实验研究[J].南方医科大学学报, 2010, 30(1): 76-83.
[15]伍亚民,王正国,朱佩芳.缺血损伤脊髓运动诱发电位的变化及其意义[J].中华物理医学与康复杂志, 2000, 22(5): 294-296.
[16] Lee KH, Kim UJ, Park YG, et al. Optical imaging of somatosensory evoked potentials in the rat cerebral cortex after spinal cordinjury [J]. JNeurotrauma, 2011, 28(5): 797-807.
[17] Meyers RA, ZavalaAR, Neisewander JL. Dorsal, but not ventral, hippocampal lesions disrupt cocaine place conditioning[J]. Neuroreport, 2003, 14(16): 2127-2131.
[18] Drapeau E, Mayo W,Aurousseau C, et al. Spatial memory performances of aged rats in the water maze predict levels of hippocampal neurogenesis [J]. PNAS, 2003, 100(24): 14385-14390.
[19] Wu JF, Zhao ZR, Stoica BA, et al. Spinal cord injury causes brain inflammation associated with cognitive and affective changes: role of cell cycle pathways [J]. J Neurosci, 2014, 34 (33): 10989-11006.
[20] Kumar A, Loane DJ. Neuroinflammation after traumatic brain injury: opportunities for therapeutic intervention [J]. Brain Behav Immun, 2012, 26(8): 1191-1201.
[21] Wecht JM, Bauman WA. Decentralized cardiovascular autonomic control and cognitive deficits in persons with spinal cordinjury [J]. JSpinal Cord Med, 2013, 36(2): 74-81.
[22] Zhang B, Huang Y, Su Z, et al. Neurological, functional, and biomechanical characteristics after high-velocity behind armor blunt trauma of the spine [J]. J Trauma, 2011, 71(6): 1680-1688.
[23] Dranovsky A, Hen R. Hippocampal neurogenesis: regulation by stress and antidepressants [J]. Biol Psychiatry, 2006, 59 (12): 1136-1143.
作者单位:1.兰州大学第二临床医学院骨科,甘肃兰州市730030;2.甘肃省骨关节疾病研究重点实验室,甘肃兰州市730030;3.第三军医大学大坪医院野战外科研究所三室,创伤烧伤与复合伤国家重点实验室,重庆市400042。作者简介:冯东亮(1989-),男,河南驻马店市人,硕士研究生,主要研究方向:脊柱脊髓损伤。通讯作者:张海鸿,主任医师,副教授,硕士研究生导师,主要研究方向:脊柱外科。E-mail: zhanghaihong1968@sina.com。
Learningand Memory Impairment and Pathologyin Hippocampusin Ratswith Spinal Cord Injury
FENG Dong-liang1,2, NAN Wei1,2, WU Ya-min3, WANG Li3, JIANG Long3, ZHOU Kai-sheng1,2, ZHU Yan-dong1,2, WANGJing1,2, HONGYou-jian3, LONGZai-yun3, ZHANGHai-hong1,2
1. Department of Orthopedics, Second Clinical Medical College of Lanzhou University, Lanzhou, Gansu 730030, China; 2. Key Laboratory of Orthopedics of Gansu Province, Lanzhou, Gansu 730030, China; 3. Department 3 of Research Instituteof Surgery, Daping Hospital, Third Military Medical University, State Key Laboratory of Trauma, Burns and Combined Injury, Chongqing400042, China
Abstract:Objective To explore the learning and memory impairment and pathology in hippocampus in rats after spinal cord contusion. Methods36 adult female Sprague-Dawley rats were randomly divided into sham group (n=18) and spinal cord injury group (n=18). Spinal cord injury model at T10was established with modified Allen's technique (10 g×25 mm). The hindlimbs behavior of rats was rated with Basso-Beattie-Bresnahan (BBB) scoresonceaweek for 5 weeks. They weretested with motor evoked potentials(MEP) and Morriswater maze5 weeksafter injury. Thepathology of hippocampuswasdetected with HE staining 1 week, 3 weeksand 5 weeksafter injury, 4 rats in agroup, repectively. ResultsTheBBB scoresweresignificantly lower in thespinal cord injury group than in thesham group at each time point (P<0.05). The latencies of both N1 and P1 wave of MEPwere significantly longer in the spinal cord injury group than in the sham group(P<0.001), whiletheamplitudesweresignificantly less(P<0.001). For theMorriswater maze, thelatency of arrival platformweresignificantly longer in the spinal cord injury group than in the sham group (P<0.001), and the time in target was significantly less (P<0.001), with moresystematic positioning or annular positioning, whilethesham group with morespace-based positioning. Morphologically abnormal cellsin hippocampusgradually increased sincethefirst week after injury, with thedecreaseof cellssurvival, whileit wasnormal in the sham group. Conclusion Spinal cord contusion can causelearning and memory impairment in rats, which may berelated to injury in hippocampus.
Keywords:spinal cordinjury; learningandmemory; hippocampus; pathology; rats
(收稿日期:2015-08-04修回日期:2015-08-28)
DOI:10.3969/j.issn.1006-9771.2015.11.007
[中图分类号]R651.2
[文献标识码]A
[文章编号]1006-9771(2015)11-1267-06
