莫诺苷对局灶性脑缺血再灌注大鼠血管内皮生长因子和成纤维生长因子-2表达的影响
2015-03-04郭德玉孙芳玲魏仁平刘婷婷程华艾厚喜田欣祝自新郑文荣王宇峰王文
郭德玉,孙芳玲,魏仁平,刘婷婷,程华,艾厚喜,田欣,祝自新,郑文荣,王宇峰,王文,3
莫诺苷对局灶性脑缺血再灌注大鼠血管内皮生长因子和成纤维生长因子-2表达的影响
郭德玉1,孙芳玲1,魏仁平2,刘婷婷1,程华1,艾厚喜1,田欣1,祝自新1,郑文荣1,王宇峰1,王文1,3
[摘要]目的观察莫诺苷对局灶性脑缺血再灌注大鼠皮层血管内皮生长因子(VEGF)和成纤维生长因子-2 (FGF-2)表达的影响。方法25只成年雄性Sprague-Dawley大鼠随机分为假手术组、模型组、莫诺苷小剂量组(30 mg/kg)、莫诺苷中剂量组(90 mg/ kg)和莫诺苷大剂量组(270mg/kg)。采用改良线栓法制备大鼠大脑中动脉栓塞(MCAO) 30min再灌注模型。再灌注7d后利用蛋白免疫印迹法检测梗死侧皮层VEGF和FGF-2蛋白表达。结果与假手术组相比,缺血再灌注7 d后,各组梗死侧大脑皮层VEGF、FGF-2的表达均有增加(P<0.05);莫诺苷小、中、大剂量组VEGF表达进一步增加(P<0.05);莫诺苷大剂量组FGF-2的表达进一步显著增加(P<0.001)。结论莫诺苷可以促进局灶性脑缺血再灌注后VEGF和FGF-2的表达,可能有助于促进缺血性脑损伤后的血管新生。
[关键词]脑缺血再灌注;莫诺苷;血管新生;血管内皮生长因子;成纤维生长因子-2;大鼠
[本文著录格式]郭德玉,孙芳玲,魏仁平,等.莫诺苷对局灶性脑缺血再灌注大鼠血管内皮生长因子和成纤维生长因子-2表达的影响[J].中国康复理论与实践, 2015, 21(11): 1241-1244.
CITED AS: Guo DY, Sun FL, Wei RP, et al. Effectsof morronisideon expression of vascular endothelial growth factor and fibroblast growthfactor-2inratsafter focal cerebral ischemia-reperfusion[J]. Zhongguo Kangfu LilunYu Shijian, 2015, 21(11): 1241-1244.
缺血性脑卒中有高发病率、高致残率、高死亡率的特点,严重危害着人类生命健康,一直以来是临床研究的焦点。动物实验证实,缺血性脑卒中后,神经血管的微环境改变可以诱导血管新生[1]。血管新生对脑卒中后期康复非常重要:新生的血管可为神经发生提供神经营养因子,并为新生的神经细胞迁移到缺血周边区域提供依附的支架,是梗死周边区域脑组织抗损伤和神经元修复的结构基础[2-3]。但脑损伤诱发的血管新生过程短暂而微弱,不足以恢复神经血管单元稳态。
血管内皮生长因子(vascular endothelial growthfactor, VEGF)是血管新生过程中最重要的丝裂原,参与微血管渗透性,以及内皮细胞的增殖、迁移和存活[4-5]。有研究表明,缺血后VEGF的表达上调可以对神经元起到保护作用,并且诱导血管新生[6];VEGF诱导的血管新生可以促进神经干细胞的增殖和分化[7]。
成纤维生长因子-2 (fibroblast growth factor-2, FGF-2)是较早发现的促血管新生因子之一,它能通过诱导VEGF合成,与VEGF和其他信号通路协同,促进血管新生[8]。通过外源性药物或其他手段提高缺血后VEGF与FGF-2的表达,将能更好地促进缺血性脑损伤的神经康复。
中药山茱萸为山茱萸科植物山茱萸(Cornusofficinalis Sieb. et Zucc.)的干燥成熟果实。本实验室对其有效成分山茱萸环烯醚萜苷进行进一步分离,得到单体化合物莫诺苷。我们的前期研究发现,莫诺苷能减小局灶性脑缺血再灌注大鼠脑梗死体积,增强皮层抗氧化、抗炎和抗凋亡能力,并促进内源性神经干细胞增殖,改善神经功能[9-13]。我们初步研究发现,莫诺苷能够促进大鼠脑缺血后梗死灶周边皮层区域血管密度增加。本研究探讨莫诺苷对VEGF和FGF-2表达的影响,为莫诺苷促进血管新生的作用机制提供依据。
1 材料与方法
1.1实验动物
SPF级雄性Sprague-Dawley大鼠25只,体质量260~280 g,购自斯贝福(北京)实验动物科技有限公司,合格证号:SCKK(京)2011-0004。饲养于宣武医院实验动物室(许可证号:SYXK(京)2010-0013),环境温度(24±2)℃,相对湿度(55±5)%,术前12 h禁食,不禁水。
1.2药物
莫诺苷由宣武医院药物研究室自行从山茱萸中提取制备,高效液相色谱分析纯度98.5%。使用前用蒸馏水溶解成所需浓度的药液。
1.3试剂和仪器
兔源性VEGF多克隆抗体、鼠源性FGF-2单克隆抗体:美国SANTA CRUZ公司。鼠源性β-actin单克隆抗体、辣根过氧化物酶标记山羊抗兔二抗、辣根过氧化物酶标记山羊抗鼠二抗:北京中杉金桥生物技术有限公司。RIPA裂解液:碧云天生物技术研究所。BCA法蛋白定量试剂盒:北京普利莱基因技术有限公司。ECL Western Blotting Kit:美国THERMO-PIERCE公司。
JY92-Ⅱ型超声波细胞破碎粉碎机:宁波市新芝科技研究所。Microfuge22R台式微量冷冻离心机:美国BECKMAN COULTER公司。Powerpac Basic电泳仪:美国BIO-RAD公司。ImageStation 4000R高分辨率多模式分子成像系统:美国CARESTREAM HEALTH公司。Multiskan Spectrum全波长酶标仪:美国THERMOFISHER公司。
1.4方法
1.4.1模型制备
参照Longa线栓法[14]制备大鼠大脑中动脉阻塞(middle cerebral artery occlusion, MCAO)模型。大鼠10%水合氯醛400 mg/kg腹腔注射麻醉。麻醉后大鼠仰卧置于手术操作台上,安尔碘颈部周围消毒。颈正中切口2 cm,分离肌肉及筋膜,注意避开甲状腺。暴露气管右侧及胸骨舌骨肌和胸锁乳突肌之间的三角区,钝性分离出右侧颈总动脉、颈内动脉和颈外动脉。结扎颈外动脉分叉处及颈总动脉近心端,动脉夹夹闭颈内动脉,在颈总动脉用眼科剪剪一个斜行细小切口,小心插入栓线,缓慢轻推栓线进入颈内动脉,直到产生阻挡感,说明栓线已经经过颈总动脉分叉处,通过颈内动脉进入大脑中动脉,到达大脑前动脉起始部。将栓线与颈内动脉一并结扎,松开动脉夹,记录开始时间。缝合肌肉,创口处涂少量青霉素,以预防伤口感染。30min后,用眼科镊缓慢拔出栓线。
假手术组进行相同手术操作,但不插栓线。
术后注意保温,大鼠未醒前置于温控毯上。
1.4.2分组与给药
大鼠清醒后,参照Longa5分法行神经功能损伤评分[15]:1分,提鼠尾离开地面约33 cm,不能充分伸展对侧前肢;2分,提鼠尾离开地面约33 cm,对侧前肢屈曲;3分,将大鼠置于地面,向对侧行走;4分,将大鼠置于地面,向对侧转圈,呈追尾状;5分,损伤严重,对侧肢体瘫痪。剔除1分和5分的大鼠。符合要求的动物按评分高低,分为假手术组,模型组,莫诺苷小、中、大剂量组,每组3只。
莫诺苷溶于蒸馏水,造模后3 h按30 mg/kg、90 mg/kg、270 mg/kg灌胃给药,每天1次,连续7 d。假手术组和模型组给予等体积蒸馏水。
1.4.3 Westernblotting
造模后7 d,大鼠10%水合氯醛400 mg/kg腹腔注射麻醉,迅速剥离大脑并将脑膜剥去,取出患侧皮层包入锡箔纸中,液氮冻存片刻,-80℃保存。
取出患侧皮层于5 ml EP管中称重,加入预冷的裂解液7 μl/mg、PMSF 10 μl/ml裂解液,冰上充分超声粉碎。4℃静止30 min,4℃12000 r/min离心30 min,取上清。BCA法定量蛋白浓度,加入用裂解液,调节各组总蛋白浓度一致。总蛋白加入5×上样缓冲液1∶4稀释,95℃变性10min。
VEGF和FGF-2采用10% SDS-PAGE分离胶,浓缩胶用5%SDS-PAGE。浓缩胶电压60 V,40min,分离胶电压90 V,90 min,电泳分离蛋白。0.45 μm NC膜转膜;条带在5%脱脂奶粉中封闭2 h;分别加兔多克隆VEGF抗体(1∶1000)、小鼠单克隆FGF-2抗体(1 ∶1000)和小鼠单克隆β-actin抗体(1∶1000),4℃冰箱孵育过夜。TBST缓冲液洗涤3次,每次10min。加相应辣根过氧化物酶(HRP)标记二抗室温孵育2 h,TBST缓冲液洗涤3次,每次10 min;ECL显色1 min,滤去显色液,凝胶成像仪拍片。Quanity One软件分析蛋白条带光密度值。
1.5统计学分析
实验数据采用SPSS13.0软件进行处理,结果以(xˉ±s)表示。组间均数比较采用单因素方差分析(ANOVA)。显著性水平α=0.05。
2 结果
2.1VEGF
模型组VEGF蛋白表达水平比假手术组升高(P< 0.05);与模型组相比,莫诺苷小、中、大剂量组VEGF蛋白表达水平均升高(P<0.05)。见表1。
2.2FGF-2
模型组FGF-2蛋白表达水平比假手术组升高(P< 0.05);与模型组相比,莫诺苷大剂量组FGF-2蛋白表达水平显著升高(P<0.001)。见表2。
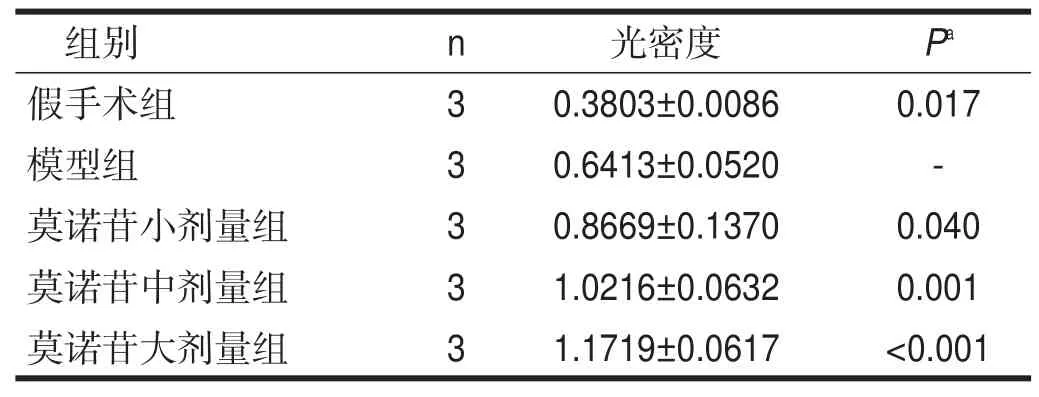
表1 各组造模后患侧皮层VEGF的表达
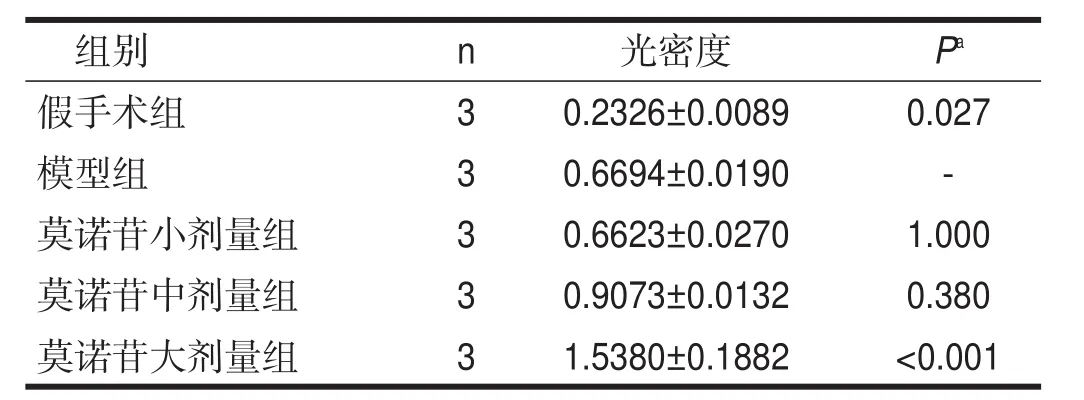
表2 各组造模后患侧皮层VEGF的表达
3 讨论
大脑缺血后的恢复是一个复杂、动态的过程,包括早期损伤后应激信号以及内源性自我修复系统的激活。对缺血后血管新生分子机制的研究表明,在血管新生过程中最重要的阶段是内皮祖细胞激活,这对血管稳态和修复至关重要[14-15]。
血管新生过程受血管生成因子VEGF/VEGFR系统调控。缺血后3 h,梗死侧大脑VEGF表达开始升高,并且可持续7 d。VEGF可以通过上调Notch的配体Delta-like4(Dll4),促进内皮细胞芽生过程中的顶端细胞增殖;给予外源性VEGF可以促进缺血半暗带的血管新生,并促进神经功能恢复[16-18]。
FGF-2是潜在的促血管生成因子,可以调节内皮细胞的迁移、增殖和代谢活动。Guo等证明,FGF-2能显著促进内皮细胞增殖、血管芽生;刺激纤维蛋白酶和内皮细胞胶原酶降解基底膜,使新生血管更容易向缺血区长入;诱导新生毛细血管管腔形成,进而增加卒中后缺血区域的脑血流量[19]。
本研究显示,缺血性脑损伤能刺激促血管生成因子的生成,激活血管新生的分子机制,诱发血管新生;给予莫诺苷治疗后,VEGF和FGF-2蛋白表达水平进一步增加,表明莫诺苷很可能通过调节VEGF和FGF-2的表达,改善脑内神经血管微环境,促进缺血性脑损伤后血管新生的修复过程。
[参考文献]
[1] Goldman SA, Chen Z. Perivascular instruction of cell genesis
and fate in the adult brain [J]. Nat Neurosci, 2011, 14(11):1382-1389.
[2] Ruan L, Wang B, Zhuge Q, et al. Coupling of neurogenesisand angiogenesis after ischemic stroke [J]. Brain Res, 2015, 1623: 166-173.
[3] Wang L, Chopp M, Gregg SR, et al. Neural progenitor cells treated with EPO induce angiogenesis through the production of VEGF [J]. J Cereb Blood Flow Metab, 2008, 28(7): 1361-1368.
[4] Short B. VEGF tips its hand in angiogenesis [J]. J Cell Biol, 2015, 209(4): 474.
[5] Sivaraj KK, Li R, Albarran-Juarez J, et al. Endothelial Gαq/11 isrequired for VEGF-induced vascular permeability and angiogenesis[J]. Cardiovasc Res, 2015, 108(1): 171-180.
[6] Manoonkitiwongsa PS, Schultz RL, Mc Creery DB, et al. Neuroprotection of ischemic brain by vascular endothelial growth factor is critically dependent on proper dosage and may be compromised by angiogenesis [J]. Cereb Blood Flow Metab, 2004, 24(6): 693-702.
[7] Sun JQ, Sha B, Zhou WH, et al. VEGF-mediated angiogenesis stimulates neural stem cell proliferation and differentiation in theprematurebrain [J]. Biochem Biophys Res Commun, 2010, 394(1): 146-152.
[8] Bai Y, Leng Y, Yin G, et al. Effectsof combinationsof BMP-2 with FGF-2 and/or VEGF on HUVECs angiogenesis in vitro and CAM angiogenesis in vivo [J]. Cell Tissue Res, 2014, 356 (1): 109-121.
[9] Sun FL, Wang W, Zuo W, et al. Promoting neurogenesis via Wnt/β-catenin signaling pathway accounts for the neurorestorative effects of morroniside against cerebral ischemia injury [J]. Eur JPharmacol, 2014, 738: 214-221.
[10] Wang W, Xu JD, Li L, et al. Neuroprotective effect of morroniside on focal cerebral ischemia in rats [J]. Brain Res Bull, 2010, 83(5): 196-201.
[11]刘婷婷,孙芳玲,程华,等.莫诺苷对局灶性脑缺血再灌注大鼠血管生成素1及其受体Tie-2的影响[J].中国康复理论与实践, 2015, 21(1): 9-11.
[12]侯虹丽,孙芳玲,艾厚喜,等.莫诺苷对脑缺血再灌注大鼠皮层梗死周边区基质金属蛋白酶表达的影响[J].中国康复理论与实践, 2015, 21(1): 5-8.
[13]艾厚喜,孙芳玲,侯虹丽,等.莫诺苷对大鼠脑缺血再灌注皮层Wnt信号通路转录因子表达的影响[J].中国康复理论与实践, 2015, 21(1): 1-4.
[14] Lo EH. A new penumbra: transitioning from injury into repair after stroke[J]. Nat Med, 2008, 14(5): 497-500.
[15] Dejana E, Tournier-Lasserve E, Weinstein BM. Thecontrol of vascular integrity by endothelial cell junctions: Molecular basis and pathological implications [J]. Dev Cell, 2009, 16(2): 209-221.
[16] Napp LC, Auqustynik M, Paesler F, et al. Extrinsic notch ligand delta- like 1 regulates tip cell selection and vascular branchingmorphogenesis[J]. Circ Res, 2012, 110(4): 530-535.
[17] Rosell A, Morancho A, Navarro-Sobrino M, et al. Factors secreted by endothelial progenitor cells enhance neurorepair responsesafter cerebral ischemiain mice[J]. PLoSOne, 2013, 8 (9): e73244.
[18] Hansen TM, Moss AJ, Brindle NP. Vascular endothelial growth factor and angiopoietins in neurovascular regeneration and protection following stroke[J]. Curr Neurovasc Res, 2008, 5(4): 236-245.
[19] Guo H, Huang L, Cheng M, et al. Serial measurement of serum basic fibroblast growth factor in patients with acute cerebral infarction[J]. Neurosci Lett, 2006, 393(1): 56-59.
作者单位:1.首都医科大学宣武医院实验动物室,北京市老年病医疗研究中心,北京市100053;2.河北北方学院,河北张家口市075000;3.北京市脑重大疾病研究院,北京市100069。作者简介:郭德玉(1960- ),男,汉族,北京市人,副主任技师,主要研究方向:人类疾病动物模型的制作。通讯作者:王文,男,博士,教授,研究员,主要研究方向:神经药理、中药药理。E-mail: lzwwang@163.com。
Effectsof Morronisideon Expression of Vascular Endothelial Growth Factor and Fibroblast Growth Factor-2 in Ratsafter Focal Cerebral Ischemia-reperfusion
GUO De-yu1, SUN Fang-ling1, WEI Ren-ping2, LIU Ting-ting1, CHENG hua1, AI Hou-xi1, TIAN Xin1, ZHU Zi-xin1, ZHENGWen-rong1, WANGYu-feng1, WANGWen1,3
1. Xuanwu Hospital, Capital Medical University, Beijing 100053, China; 2. Hebei North University, Zhangjiakou, Hebei 075000, China; 3. Beijing Institutefor Brain Disorders, Beijing100069, China
Abstract:Objective To investigate the effects of morroniside on the expression of vascular endothelial growth factor (VEGF) and fibroblast growth factor-2 (FGF-2) in rat cortex after focal cerebral ischemia-reperfusion. Methods30 male Sprague-Dawley rats were randomly divided into sham group, model group, morroniside-low group (30 mg/kg), morroniside-middle group (90 mg/kg) and morroniside-high group (270 mg/kg). Middle cerebral arteries of rats were occluded for 30 minutes with Longa's method and re-perfused. The expression of VEGF and FGF-2 in theischemic ipsilateral cortex wasdetected with Western blotting 7 daysafter reperfusion. ResultsTheexpression of both VEGF and FGF-2 increased in the ischemic ipsilateral cortexin in all the ischemic groups compared with the sham group (P<0.05). Theexpression of VEGF further increased in adose-dependent manner in all themorronisidegroupscompared with that of model group (P<0.05), and the expression of FGF-2 increased in the morroniside-high group (P<0.001). Conclusion Morroniside could increase theexpressionof VEGFand FGF-2after ischemia-reperfusion, whichmight promoteangiogenesis.
Key words:cerebral ischemia-reperfusion; morroniside; angiogenesis; vascular endothelial growth factor; fibroblast growth factor-2; rats
(收稿日期:2015-07-13修回日期:2015-09-06)
基金项目:1.“重大新药创制”科技重大专项(No.2012ZX09102201-106);2.国家自然科学基金项目(No. 81373994; No.81173575)。
DOI:10.3969/j.issn.1006-9771.2015.11.001
[中图分类号]R743.3
[文献标识码]A
[文章编号]1006-9771(2015)11-1241-04
