钙蛋白酶1与动物雄性生殖
2015-03-02崔晓慧,王秀革,李虹等
学科动态
钙蛋白酶1与动物雄性生殖
崔晓慧1,2,王秀革2,李虹1,2,杨春红2,仲跻峰2,侯明海2,尹苗1*,王长法2*
(1.山东师范大学 生命科学学院,山东 济南250014;2.山东省农业科学院奶牛研究中心,山东 济南 250100)
[摘要]钙蛋白酶1(calpain1,CAPN1)在动物各组织中普遍表达,广泛参与机体的信号传导、细胞凋亡和细胞周期调控等生理过程。钙蛋白酶1存在于精子的头部,参与精子发生和顶体反应等生理过程,对精子发挥正常功能具有重要的作用。本文主要阐述了钙蛋白酶1的结构、功能以及与雄性生殖相关性研究进展,为人们进一步研究该基因奠定基础。
[关键词]钙蛋白酶1;精子发生;遗传变异;分子调控
钙蛋白酶是在动物各组织中普遍表达的一类依赖于钙激活的半胱氨酸巯基内肽酶,广泛参与机体细胞水平的信号传导、细胞凋亡和细胞周期调控等生理过程[1]。自从Guroff等[2]在大鼠脑组织中首次发现这种可溶的钙离子依赖的中性蛋白酶以来,关于其研究久盛不衰。Ohnos等[3]第1次克隆了该酶的cDNA。1991年,该酶被正式命名为“钙蛋白酶”。在大多数哺乳类组织和细胞中,根据对Ca2+的敏感度不同,将两种钙蛋白酶分别命名为CAPN1和CAPN2,相对应需要较低和较高的Ca2+浓度。钙蛋白酶小亚基单位(calpainsmallsubmit1,CAPNS1)是CAPN1和CAPN2的共同调节亚单位[4]。Sivakumar等[5]研究表明,蛋白酶家族成员可直接参与半胱氨酸蛋白酶caspase家族成员的剪切,诱导细胞凋亡。为了确保配子的质量,精子发生过程中的细胞凋亡更加重要。钙蛋白酶是睾丸生殖细胞凋亡的主要感受器,当CAPN1 RNA表达水平增加、活力更高时,类caspase-3活力明显减弱,并且钙蛋白酶抑制剂E64d减少MTp53睾丸的原位末端标记(TUNEL)[6]。另外,通过全基因组关联分析发现,CAPN1基因与雄性弱精子活力相关[7]。因此,钙蛋白酶与雄性生殖相关,对CAPN蛋白和基因的研究可为雄性不育的治疗提供线索。本文主要阐述了雄性生殖过程中钙蛋白酶的功能与作用,为相关研究奠定基础。
1CAPN1的结构与功能
1.1 CAPN1的结构
牛钙蛋白酶1基因位于29号染色体上,全长36 854 bp,包括22个外显子,21个内含子,编码一条含716个氨基酸的肽链(图1)。CAPN1蛋白由大小两个亚基组成,其中大亚基由DV到DVI四个结构域组成,小亚基由DV(甘氨酸富集区)和DVI 两个结构域组成。大小亚基由不同的基因编码,大亚基的编码基因为CAPN1,小亚基的编码基因为CAPNS1[8]。大小亚基分别发挥催化和调控的功能,大亚基自身可以保持蛋白水解活力,而小亚基需要分子伴侣激活,通过与大亚基N端相互作用进而促进大亚基发生适当的折叠,从而发挥调控作用。CAPN家族都要经过 Ca2+诱导发生自体溶解,并且各种蛋白酶发生溶解的位点相似,但不完全相同。在牛CAPN1蛋白中,大亚基N端15个氨基酸首先被移除得到一个78 kDa大小的中间产物,然后进一步移除12个氨基酸,最终得到75 kDa大小的产物[9]。根据同源性建模,已经得出牛CAPN1大催化亚基的结构模型[9]。模型中牛CAPN1大亚基包含了大约700个氨基酸组成的复合位点(DV到DVI),并且在未被活化状态时在N端存在EF-手型结构和α-螺旋结构(图2a)[9]。图中为牛CAPN1和兔CAPN2分别在钙离子激活(b)和未激活(a)状态时的结构,两个蛋白酶的大亚基大小均为80 kDa,并且它们的结构非常相似。

图1 牛CAPN1基因结构图

图2 牛Calpain-1和兔Calpain-2分别在钙离子激活(b)和
1.2 CAPN1的功能
CAPN类蛋白酶代表近2%的全基因产物[10],属于钙离子依赖的半胱氨酸蛋白酶,当钙离子存在时,酶原被激活,能够水解底物蛋白氨基酸之间的α肽键。由于多方面的生理功能,CAPN及其内源性抑制蛋白calpastatin(CAST)已经成为医药和生物技术的研究重点。除此之外,由于在编码水平抑制CAPN亚型的功能障碍,它们发挥高活性状态或病理状态都与不同的疾病相关。蛋白酶聚集可能会引起活力的降低,并且可能引起炎症位点过度的免疫反应[11-12]。关于该钙蛋白酶最多的研究是与肉质嫩度相关,最新的研究表明CAPN1基因的多态性与鸡肉的嫩度密切相关[13]。此外,钙蛋白酶1也参与神经细胞凋亡的信号通路[14]。
CAPN1的激活原理和作用机制的调节过程非常复杂,其活性主要由一种特异的钙蛋白酶抑制蛋白(calpastatin)调控。Calpastatin仅由一个基因编码,唯一作用是抑制CAPN的活性,但却能运用不同位置的启动子以及选择性剪切模式产生十几种异构体,最后翻译成分子量为17~100 kDa不等的各种不同蛋白。人的睾丸特异calpastatin蛋白大小约为68 kDa,由一个由40个氨基酸组成的N端结构域与II、III和IV结构域组成,其中N端结构域为睾丸特异,其余结构域部分和其他体细胞calpastatin蛋白完全一样[15]。
2钙蛋白酶1与雄性生殖相关研究
2.1 CAPN1在雄性生殖系统中的定位
Rojas等[16]第一次在人类精子中发现CAPN1、CAPN2的分布,并且用免疫印记的方法获得了一条68 kDa大小的calpastatin蛋白条带;猕猴CAPN1和CAPN2同时在精子中表达,超微结构研究表明这两种钙蛋白酶位于细胞质膜和顶体外膜之间[9]。体细胞中的钙蛋白酶位于细胞质基质,最适pH为7.5。而精子细胞中的钙蛋白酶主要分布在皮层颗粒,发挥最大酶活力的pH为9.0~9.5。CAPN2主要存在于细胞质基质,而CAPN1主要存在于细胞质基质和皮层颗粒,但有活性的钙蛋白酶主要存在于皮层颗粒上。精子中钙蛋白酶发挥最大活力的pH相对体细胞较高,可能与精子的生理活性有关。在保持较低pH条件下,精子保持沉默状态;当pH>7.5时,精子被激活,新陈代谢迅速加快并获得与卵子结合的能力。在精子处于完全激活的状态时,钙蛋白酶的活力最大。
2.2 CAPN1在精子发生中的表达和作用
Sultana等[17]研究了钙蛋白酶在精子发育过程中的表达变化规律,发现在大鼠生长到20~25 d时,即精母细胞( spermatocytes)发生减数分裂的旺盛时期,睾丸中的CAPN1基因表达量显著升高,而CAPN2保持相对稳定,推测CAPN1在精子细胞发生过程中起重要作用。在小鼠中,精子发生的各个阶段都能检测到CAPN1和CAPN2的mRNA和蛋白的表达,但CAPN1在晚期的次级精母细胞( second spermatocytes) 和早期的精细胞( spermatids) 中表达量显著升高。
CAPN1主要参与精子发生中的细胞凋亡过程[18]。在成年动物个体中,细胞系要进行连续的细胞分化,进而要严格控制细胞系增殖和凋亡之间的平衡。除了自我平衡的控制外,为了确保配子的质量,精子发生过程中的细胞凋亡更加重要。在一个细胞凋亡缺陷的机体中,受损的细胞可以存活,并且可将突变性状传递给后代,这可以解释为什么成年雄性生殖细胞对细胞凋亡非常敏感。在正常的情况下,永久分化导致细胞死亡率高达50%。精子发生的开始伴随着精原细胞的有丝分裂,从精原细胞的二倍体到初级精母细胞四倍体的转变过程标志着进入了减数分裂。随后进入粗线期,初级精母细胞染色体减半形成二倍体的次级精母细胞。这标志着进入了精子形成和末端成熟过程,最终形成了单倍体的精子细胞(如图3)。在精细胞凋亡过程中,钙蛋白酶在睾丸局部缺血或者再灌注时可被激活[19]。在细胞内钙离子增加时,CAPN1和CAPN2是在体外普遍被激活的蛋白酶(分别仅需要微摩尔和毫摩尔钙离子浓度)[20]。在它们的底物中,一些是凋亡效应器:两种钙蛋白酶任意一个被激活,可以作为Bcl2家族成员;或者任意一个被灭活,可以相当于p53和caspase。在转基因(MTp53)雄性个体中,表达p53的次级精母细胞和精细胞要经受非半胱天冬酶依赖的细胞死亡;钙蛋白酶是细胞凋亡的主要效应器,尽管在正常精子形成过程中存在被激活的caspase-9和caspase-3的成分,但是钙蛋白酶仍是细胞凋亡的主要感受器。因此,钙蛋白酶对精子正常的发生具有十分重要的作用。
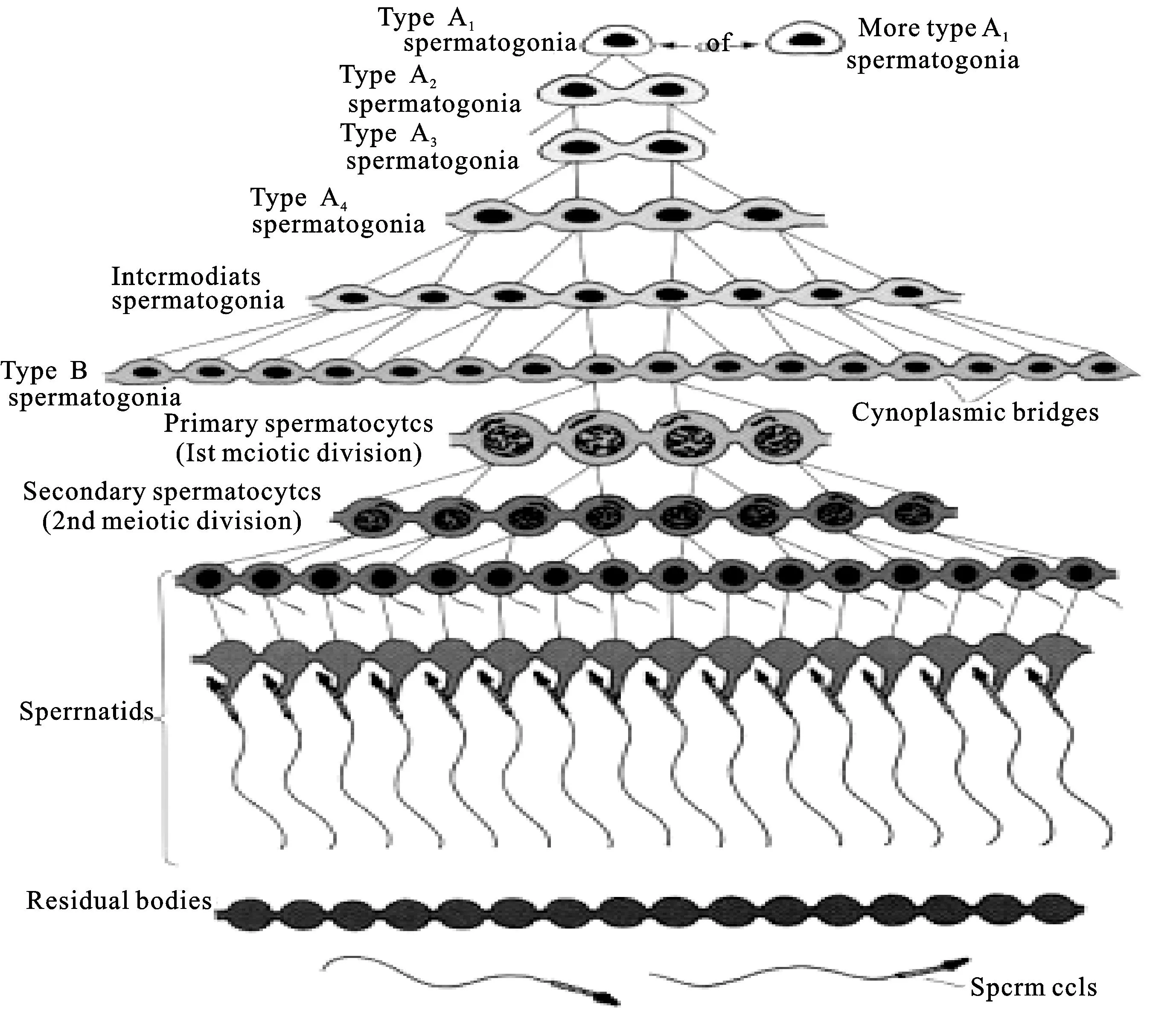
图3 哺乳动物精子发生过程(Dym 1994)
2.3 CAPN1在顶体反应中的作用
在受精过程中,精子与卵子透明带结合,并激活精子细胞膜G蛋白偶联的信号通路。Ca2+通过活化的G蛋白通路流入细胞内,引起胞内Ca2+浓度上升,进而诱发顶体反应。顶体反应能够使精子穿过透明带,与卵子发生受精作用[21]。在人类和其它脊椎动物中的受精作用研究证明,Ca2+在精子穿透卵母细胞的生物化学反应中具有重要作用,特别在精子细胞和卵母细胞膜的融合过程中具有最重要的作用。Ca2+作为小的信号传感器能够特异的调控精子和卵母细胞膜融合过程[22]。因此,获能精子在没有钙离子的条件下只能和卵细胞碰撞并附着,不能发生细胞膜的融合[23]。精子中的钙蛋白酶可被Ca2+激活,并且其蛋白水解活性能够有效的降低特异的钙蛋白酶抑制蛋白的活性。钙蛋白酶系统蛋白在顶体附近的分布以及其与Ca2+浓度的密切关系,说明该系统可能在顶体反应中发挥重要作用。
Rojas和Moretti-Rojas对calpain-calpastatin系统在顶体反应中的作用的研究发现,精子中加入CAPN的抑制因子(calpaininhibitor-I) 后,精子的渗入率显著降低,但是该抑制因子对精子活力以及卵母细胞没有明显作用。此外,加入CAPN1和CAPN2的抗体同样对顶体反应有抑制作用[24]。随后,大量研究表明CAPN的各种抑制剂有时也能不同程度的降低精子活力以及抑制顶体反应的发生[25-26]。
2.4 CAPN1基因多态性与精子活力的研究
生育力低下是指任何形式的生育能力下降和生殖能力下降[27]。对于广泛进行人工授精的奶牛遗传改良系统来说,公牛生育低下(即隐性不育公牛)可引起较大的经济损失。生育力低下的雄性,其病变的精液表现为数量减少和精子运动能力减弱,最终导致繁殖力低下[28]。隐性不育公牛的精液比完全不育公牛的精液对奶牛群影响更大,因为后者极易被发现,从而较早被淘汰。而前者可能在大面积使用后才被发现,此时已经给牛群造成重大的经济损失并且有损精子的分销和销售。弱精子活力公牛在牛AI行业逐渐变成了严重问题之一。在生产过程中,公牛精液中弱精子活力的比重逐渐增加。
Druet等[29]研究证实,精液品质受遗传因素影响,该研究报道了和牛精液质量相关的遗传参数。精液的一些生产特性,比如精液体积和浓度会适当的遗传,遗传力从0.15到0.30,但对于精液的一些质量特性来说,比如精子活力和畸形率,具有高度遗传力(接近0.6)。
影响精液品质的基因研究主要是鉴定影响雄性生育能力不足(精子减少症和精子活力不足症),在很多研究中发现单核苷酸多态性(SNP)影响与生育相关疾病[30]。许多研究应用全基因组相关性研究(GWAS)验证了上述观点[31-32]。在公牛精子中也有类似的研究[33]。在婆罗门牛X染色体上,有一大片区域都与精子质量相关[34],其中有一个单核苷酸多态性(SNP)影响精子的运动能力,且该SNP位点也位于X染色体上。此外,大量研究报道了许多与精子生产性能相关的SNP,这表明多态性与精子的质量有密切关系,但是单个SNP的影响较小,因而需要综合分析分散在几乎所有染色体上的SNP[31-32,35]。
利用GoldenHelix SVS7软件进行全基因组相关性分析来评估单核苷酸多态性(SNP)与弱精症的相关性发现,与弱精症相关性最高的SNP主要位于24号染色体的rs110876480位点、5号染色体上的rs110827324和rs29011704位点以及1号染色体上rs110596818位点。除此之外,位于29号染色体的CAPN1基因与精子的运动性和精液的生化反应密切相关。现有的研究结果表明,弱精症具有多基因遗传性,但是也有可能是由于多态性促进了分子标记辅助选择。鉴定与弱精子活力相关的基因组区域可以及时发现在人工授精过程中不适合的精子。
3钙蛋白酶系统与雄性生殖疾病的关系
雄性哺乳动物的睾丸扭转(Testicular torsion) 会导致睾丸内细胞的缺血并发生坏死或凋亡,细胞会产生大量的NO,同时CAPN蛋白的活性也显著升高,在此过程中如加入CAPN的抑制剂,则抑制CAPN的蛋白水解活性,可以抑制精原细胞的凋亡和坏死,说明抑制CAPN可以对睾丸扭转损伤的恢复有一定作用,因而CAPN蛋白可以作为治疗睾丸扭转一个药物靶点[36-37]。 Umemoto等[38]进一步研究了发生睾丸扭转过程中未发生损伤的细胞中CAPN蛋白的变化,发现当大鼠一侧的睾丸发生睾丸扭转损伤后,在另一侧睾丸的精母细胞核中发现了大量的CAPN1, 而CAPN2没有明显的变化;在未发生损伤的外周细胞中同样发现了凋亡的现象,而CAPN抑制剂也可以抑制这些细胞的凋亡。
钙蛋白酶系统在雄性生殖过程中具有重要的作用。随着对钙蛋白酶系统的进一步研究,其发挥作用的机制更加的清楚,在临床上可以作为药物的潜在靶位点,为治疗相关疾病提供新途径,还可以运用到动物生产领域,提高动物的繁殖力,更好的为人类服务。
参考文献:
[1]Santos D M, Xavier J M, Morgado A L,et al. Distinct regulatory functions of calpain 1 and 2 during neural stem cell self-renewal and differentiation[J]. PLoS One, 2012,7(3):e33468.
[2]Guroffg.A neutral, calcium-activated proteinase from the soluble fraction of rat brain[J]. Biol Chem,1964,239(1):49-55.
[3]Ohno S, Emori Y, Imajoh S,et al. Evolutionary origin of a calcium-dependent protease by fusion of genes for a thiol protease and a calcium-binding protein[J]. Nature,1984,312(5994):566-570.
[4]Kumar V, Everingham S, Hall C, et al.Calpains promote neutrophil recruitment and bacterial clearance in an acute bacterial peritonitis model [J].Eur J Immunol,2014,44(3):831-841.
[5]Sivakumar AS, Hwang I.Effects of Sunphenon and Polyphenon 60 on proteolytic pathways, inflammatory cytokines and myogenic markers in H2O2-treated C2C12 cells [J].J Biosci,2015,40(1):53-59.
[6]Coureuil M, Fouchet P, Prat M,et al.Caspase-independent death of meiotic and postmeiotic cells overexpressing p53: calpain involvement[J].Cell Death Differ,2006,13(11):1 927-1 937.
[7]Hering D M, Olenski K, Kaminski S. Genome-wide association study for poor sperm motility in Holstein-Friesian bulls[J]. Anim Reprod Sci, 2014,146(3/4):89-97.
[8]Campbell RL, Davies PL. Structure-function relationships in calpains[J].Biochem J, 2012,447(3):335-351.
[9]Chai H H, Lim D, Lee S H,et al. Homology modeling study of bovine μ-calpain inhibitor-binding domains[J]. Int J Mol Sci,2014,15(5):7897-938.
[10]Verspurten J, Gevaert K, Declercq W,et al. Sitepredicting the cleavage of proteinase substrates[J].Trends Biochem Sci,2009,34(7):319-323.
[11]Chennamsetty N, Voynov V, Kayser V,et al.Design of therapeutic proteins with enhanced stability[J].Proc Natl Acad Sci USA,2009,106(29):11 937-11 942.
[12]Hermeling S, Crommelin DJ, Schellekens H,et al.Structure-immunogenicity relationships of therapeutic proteins[J].Pharm Res,2004,21(6):897-903.
[13]Shu JT, Zhang M, Shan YJ,et al. Analysis of the genetic effects ofCAPN1 gene polymorphisms on chicken meat tenderness[J].Genet Mol Res,2015,14(1):1 393-1 403.
[14]Lu T H, Su C C, Tang F C,et al.Chloroacetic acid triggers apoptosis in neuronal cells via a reactive oxygen species-induced endoplasmic reticulum stress signaling pathway[J].Chem Biol Interact,2015(225):1-12.
[15]Li S, Goldberg E. A novel N-terminal domain directs membrane localization of mouse testis-specific calpastatin[J]. Biol Reprod,2000,63(6):1 594-1 600.
[16]RojasFJ, BrushM, Moretti-RojasI.Calpain-calpastatin:a novel, complete calcium-dependent protease system in human spermatozoa[J]. Mol Hum Reprod, 1999, 5(6):520-526.
[17]Sultana T,Wahab-Wahlgren A,Assmus M,et al.Expression and regulation of the prointerleukin-1 alpha processing enzymes calpain I and II in the rat testis[J].Int J Androl,2003, 26(1):37-45.
[18]Coureuil M, Fouchet P, Prat M,et al.Caspase-independent death of meiotic and postmeiotic cells overexpressing p53: calpain involvement[J].Cell Death Differ,2006,13(11):1 927-1 937.
[19]Shiraishi K1, Naito K, Yoshida K. Inhibition of calpain but not caspase protects the testis against injury after experimental testicular torsion of rat[J].Biol Reprod,2000,63(5):1 538-1 548.
[20]Franco SJ, Huttenlocher A. Regulating cell migration: calpains make the cut[J].J Cell Sci,2005,118(17):3 829-3 838.
[21]Bendahmane M, Tulsiani DR.Capacitated acrosome-intact mouse spermatozoa bind to sepharose beads coated with functional neoglycoproteins[J].Arch Biochem Biophys,2003,415(2):203-212.
[22]Michailov Y, Ickowicz D, Breitbart H.Zn2+-stimulation of sperm capacitation and of the acrosome reaction is mediated by EGFR activation[J].Dev Biol,2014,396(2):246-255.
[23]Lawrence Y, Whitaker M, Swann K.Sperm-egg fusion is the prelude to the initial Ca2+increase at fertilization in the mouse[J].Development,1997,124(1):233-241.
[24]Rojas FJ, Moretti-Rojas I. Involvement of the calcium-specific protease, calpain, in the fertilizing capacity of human spermatozoa[J]. Int J Androl,2000,23(3):163-168.
[25]Ben-Aharon I1, Brown PR, Etkovitz N,et al.The expression of calpain 1 and calpain 2 in spermatogenic cells and spermatozoa of the mouse[J].Reproduction,2005,129(4):435-442.
[26]Ashizawa K, Wishart GJ, Katayama S, et al. Effects of calpain and Rho-kinase inhibitors on the acrosome reaction and motility of fowl spermatozoa in vitro [J].Reproduction, 2006,131(1):71-79.
[27]Gnoth C, Godehardt E, Frank-Herrmann P,et al. Definition and prevalence of subfertility and infertility[J].Hum Reprod,2005,20(5):1 144-1 147.
[28]Atala A. Re: missense mutations in SLC26A8, encoding a sperm-specific activator of CFTR, are associated with human asthenozoospermia[J].J Urol,2014,191(2):554-555.
[29]Druet T, Fritz S, Sellem E,et al. Estimation of genetic parameters and genome scan for 15 semen characteristics traits of Holstein bulls[J].J Anim Breed Genet,2009,126(4):269-277.
[30]O'Flynn O'Brien K L, Varghese A C, Agarwal A.The genetic causes of male factor infertility: a review[J]. Fertil Steril,2010,93(1):1-12.
[31]Aston KI, Carrell DT.Genome-wide study of single-nucleotide polymorphisms associated with azoospermia and severe oligozoospermia[J].J Androl,2009,30(6):711-725.
[32]Aston KI, Krausz C, Laface I,et al.Evaluation of 172 candidate polymorphisms for association with oligozoospermia or azoospermia in a large cohort of men of European descent[J].Hum Reprod,2010,25(6):1 383-1 397.
[33]Fortes MR, Reverter A, Hawken RJ,et al.Candidate genes associated with testicular development, sperm quality, and hormone levels of inhibin, luteinizing hormone, and insulin-like growth factor 1 in Brahman bulls[J].Biol Reprod,2012,13;87(3):58.
[34]Fortes MR, Reverter A, Kelly M,et al.Genome-wide association study for inhibin, luteinizing hormone, insulin-like growth factor 1, testicular size and semen traits in bovine species[J]. Andrology,2013,1(4):644-650.
[35]Sang L, Du Q Z, Yang W C,et al.Polymorphisms in follicle stimulation hormone receptor, inhibin alpha, inhibin bata A, and prolactin genes, and their association with sperm quality in Chinese Holstein bulls[J].Anim Reprod Sci,2011,126(3-4):151-156.
[36]Shiraishi K, Naito K, Yoshida K. Inhibition of calpain but not caspase protects the testis against injury after experimental testicular torsion of rat[J]. Biol Reprod, 2000 ,63(5):1 538-1 548.
[37]Shiraishi K, Naito K, Yoshida K. Nitric oxide promotes germ cell necrosis in the delayed phase after experimental testicular torsion of rat[J]. Biol Reprod,2001,65(2):514-521.
[38]Umemoto Y, Ozaki Y, Sasaki S, et al. Involvement of calpain for apoptosis in dysfunction of the unaffected testis in rats with experimental testicular torsion[J]. Am J Reprod Immunol, 2001,45(4):239-245.
Calpain 1 and Male Animal Reproduction
CUI Xiao-hui1,2,WANG Xiu-ge2,LI Hong1,2,YANG Chun-hong2,ZHONG Ji-feng2,
HOU Ming-hai2,YI Miao1*,WANG Chang-fa2*
(1.CollegeofLifeScience,ShandongNormalUniversity,Ji'nan,Shandong250014;
2.DairyCattleResearchCenter,ShandongAcademyofAgriculturalScience,Ji'nan,Shandong250100)
Abstract:Calpain 1 (calpain1, CAPN1) is widely expressed in various tissues in animals and described in a wide range of cellular processes including apoptosis, migration and cell cycle regulation. Calpain is present in the sperm head and participates in spermatogenesis and acrosome reaction. Calpain 1 has an important role in the normal functioning of sperm. The paper described the architecture, function of calpain and its correlation with male reproduction for further gene research.
Key words:CAPN1; spermatogenesis; genetic variation; molecular regulation
[中图分类号]S811.6
[文献标识码]A
[文章编号]1005-5228(2015)11-0001-05
*[通讯作者]尹苗(1972-),女,山东聊城人,博士,副教授,硕士生导师,研究方向:动物发育的机理。E-mail:yinmiao@sdnu.edu.cn;王长法(1967-),男,江苏淮安人,博士,研究员,研究方向:动物遗传育种与繁殖。E-mail:wangcf1967@163.com
[作者简介]崔晓慧(1990-),女,山东菏泽人,硕士研究生,研究方向:细胞生物学。E-mail:cxhddk@163.com
[基金项目]山东省农业良种工程种质创新应用项目(2014LZ);岗位科学家(CARS-37);国家自然基金(31401049,31401050);山东省农业产业技术体系牛产业创新团队(SDAIT-12-011-02)
*[收稿日期]2015-04-10修回日期:2015-05-05
