索拉非尼联合塞来昔布在体外对肝癌HepG2细胞的影响
2015-02-16周善学叶小磊赵亚荣应福明冯雪峰范天逸李贤杰
周善学,叶小磊,赵亚荣,应福明,冯雪峰,范天逸,李贤杰
索拉非尼联合塞来昔布在体外对肝癌HepG2细胞的影响
周善学1,叶小磊2,赵亚荣2,应福明1,冯雪峰1,范天逸1,李贤杰1
目的 研究索拉非尼联合塞来昔布在体外对肝癌HepG2细胞增殖的影响。方法以不同浓度索拉非尼和塞来昔布分别组成单药组和联合用药组作用于HepG2细胞,MTT法检测增殖抑制率,流式细胞仪检测细胞周期。Western blot检测Cyclin D1、Cyclin D3、CDK4蛋白的表达。结果索拉非尼、塞来昔布单药与联用均能抑制HepG2细胞增殖,呈时间-剂量依赖效应,两药联用有协同效应(P<0.05)。药物组与空白组相比,G0/G1期细胞比例增高,联合用药组最高。联合用药组与单药及空白对照组相比,HepG2细胞中Cyclin D1、Cyclin D3蛋白的表达显著降低。结论索拉非尼联合塞来昔布可能通过下调Cyclin D1、Cyclin D3表达,增强G0/G1期阻滞,发挥协同抑制HepG2细胞增殖的作用。
索拉非尼;塞来昔布;肝癌细胞
0 引言
肝癌的发病机制非常复杂,其形成、发展和转移与多种基因的突变、细胞信号转导通路和新生血管增生异常等密切相关,其中存在着多个关键性环节。索拉非尼(Sorafenib)是口服多靶点、多激酶抑制剂,具有同时抑制肿瘤细胞增殖和血管生成的双重作用[1-2]。COX-2蛋白在人肝细胞癌中的表达明显高于癌旁组织,而正常肝组织中多无表达[3];COX-2蛋白与癌细胞的分化程度、转移、复发密切相关[4],有望成为预防、治疗肿瘤的靶点。塞来昔布是美国FDA第一个批准的选择性COX-2抑制剂,可有效地抑制肿瘤引起的轻中度疼痛,对消化道毒副反应小、安全性好[5]。联合应用索拉非尼及塞来昔布有望更加有效地抑制肝癌的进展,同时缓解癌性疼痛。因此,我们通过索拉非尼联合塞来昔布作用肝癌细胞的研究探讨:①两药联用在体外是否存在协同抑制肝癌细胞增殖的作用;②两药联用对肝癌细胞周期的影响及其可能的机制。
1 材料与方法
1.1 细胞株与培养 人类肝癌细胞株HepG2细胞(购自中科院生化所),在宁波市医学科学研究所中心实验科液氮冻存。使用前复苏并常规培养在含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养液中,置于37 ℃恒温、5% CO2饱和湿度环境的培养箱中培养。
1.2 实验药品 索拉菲尼(德国拜耳医药保健公司产品,商品名:Nexavar,多吉美),塞来昔布(辉瑞制药有限公司产品,商品名:Celecoxib,西乐葆)。
1.3 MTT法检测细胞增殖 取对数生长期HepG2细胞,以5×104个/mL的细胞密度接种于96孔板,100 μL/孔。37 ℃、5% CO2、饱和湿度培养24 h后,弃去培养液,加入含有不同浓度索拉菲尼(0、5、10、20 μmol/L)和塞来西布(0、25、50、100、200 μmol/L)的培养液,每个浓度3个复孔,终体积200 μL/孔。分别培养24、48、72 h后加入20 μL MTT(5 mg/mL),在37 ℃、5% CO2培养箱中继续孵育3 h后,弃去孔内培养液,每孔加入200 μL DMSO,检测570 nm处的吸光度值(OD值),并用630 nm处进行校正。细胞抑制率(%)=(1-实验组OD/对照组OD)×100%。
1.4 流式细胞仪检测细胞周期 将HepG2细胞分10 cm dish,培养24 h后,50 μmol/L塞来昔布、10 μmol/L索拉非尼分别以及两者联合作用48 h。收集细胞,调整细胞密度为1×107/mL。用PBS洗1遍,然后加入1 mL预冷70%乙醇,4 ℃固定30 min。用PBS洗1遍,加入500 μL PBS及10 μL RNase(1 mg/mL),置于37 ℃,30 min。加入500 μL PBS以及20 μL PI染色液(2.5 mg/mL),避光染色30 min。细胞上机之前过300目筛网,然后检测。
1.5 Western blot检测细胞周期蛋白 将HepG2细胞分6孔板,培养24 h后,50 μmol/L塞来昔布、10 μmol/L索拉非尼分别及两者联合作用48 h。提取蛋白后,检测Cyclin D1、Cyclin D3、CDK4蛋白表达情况。具体操作如下:取25 μg细胞裂解液进行SDS-PAGE,然后转膜,封闭,抗体孵育。使用ECL发光液,压片。条带使用IMAGE J处理,并使用内参β-tubulin进行校正。
1.6 统计学分析 采用统计软件SPSS 13.0进行分析,数据以表示。均数比较采用单因素方差分析,LSD-t检验。交互效应分析采用两因素多水平的析因设计,P<0.05为差异有统计学意义。协同性分析用金正均q值法[6]判断,q=实际联合药效R′(A+B)/理论联合药效R(A+B),R(A+B)=RA+RB-RA×RB,RA、RB为单独用药药效。q<0.85为拮抗,0.85≤q<1.15为相加,q≥1.15为协同。所有实验均至少重复3次。
2 实验结果
2.1 显微镜形态学观察(×100) 对照组细胞:呈延展扁平,贴壁生长,细胞间排列紧密,密度均匀(见图1a)。单药处理组细胞:形态发生变化,细胞轮廓增强,细胞间接触变松,部分贴壁细胞变圆、漂浮(图1b、图1c)。联合药物处理组细胞:形态变化,细胞轮廓增强,细胞体积变小、变圆,漂浮的比例增大,细胞周围碎片增多,细胞数目减少(图1d)。

图1 显微镜形态学(×100)
2.2 MTT试验 塞来昔布与索拉非尼单药及联用各组均能抑制HepG2细胞生长,表现为时间-剂量依赖效应。联用组细胞抑制率较单药组明显增强。见表1~表3。
统计学结果显示,塞来昔布和索拉非尼不同剂量抑制效果不同,两种药物间存在交互作用(P<0.01)。以金正钧公式计算不同剂量联合用药时的q值,塞来昔布和索拉非尼联合作用24 h主要表现为相加作用,而联合作用48及72 h表现出明显的协同作用。见表4。

表1 塞来昔布联合索拉非尼作用HepG2细胞24 h抑制率(%)

表2 塞来昔布联合索拉非尼作用HepG2细胞48 h抑制率(%)

表3 塞来昔布联合索拉非尼作用HepG2细胞72 h抑制率(%)
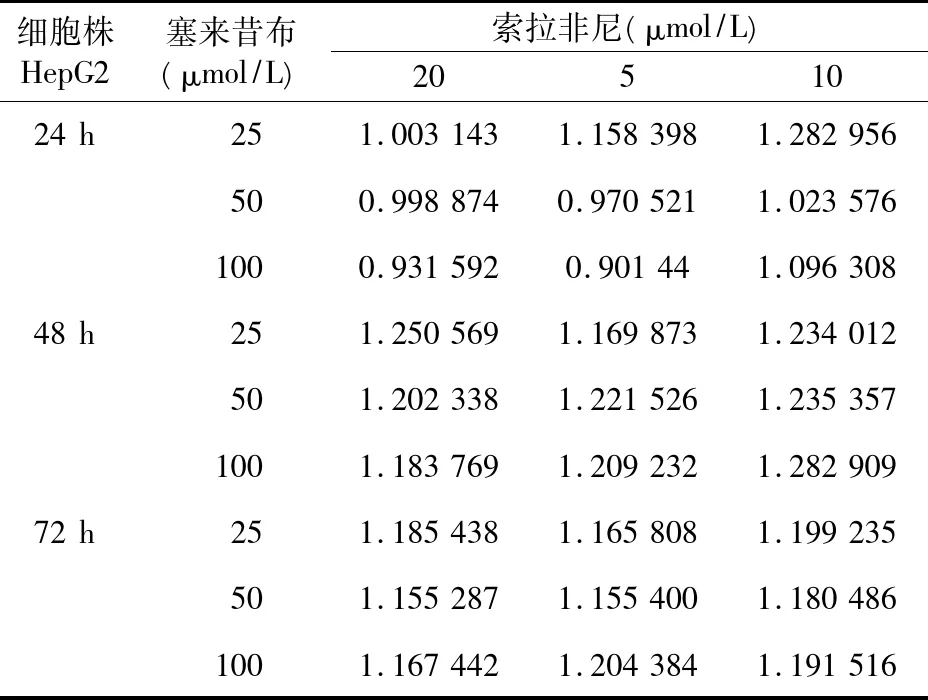
表4 不同浓度塞来昔布与索拉非尼联合作用的q值
2.3 流式细胞仪检测不同组细胞周期 与空白对照组比较,各药物组细胞周期中G0/G1期细胞比例增多,G2/M期细胞比例减少。与其他三组比较,联合用药组G0/G1期细胞比例最高,G2/M期细胞比例最低。提示联合用药主要增加了G0/G1期细胞阻滞(P<0.05)。见图2。
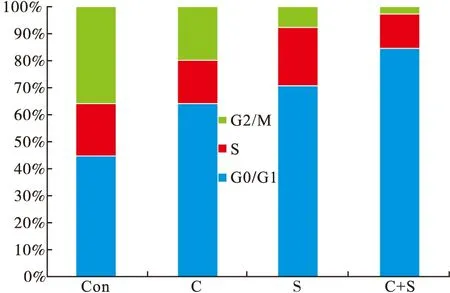
图2 塞来昔布,索拉非尼及联合用药48 h后HepG2细胞周期比例
2.4 Western blot检测细胞周期蛋白 联合用药组Cyclin D1、Cyclin D3蛋白表达水平较其他组显著下降,差异有统计学意义(P<0.05)。各组CDK4的表达无显著改变。见图3。表明塞来昔布联合索拉菲尼能显著下调HepG2细胞中Cyclin D1、Cyclin D3表达。

图3 塞来昔布和索拉菲尼单药与联合作用于HepG2细胞后Cyclin D1、Cyclin D3、CDK4的表达
索拉非尼联合塞来昔布对肝癌HepG2细胞有协同抑制作用。联合用药与单药相比细胞周期阻滞有显著差异。联合用药组与单药及对照组相比,Cyclin D1、Cyclin D3蛋白的表达下降差异有统计学意义。
3 讨论
索拉非尼通过抑制受体酪氨酸激酶KIT、FLT23以及Raf/MEK/ERK途径中的丝氨酸/苏氨酸激酶,抑制肿瘤细胞增生[7];同时通过上游抑制受体酪氨酸激酶VEGFR、PDGFR及下游抑制Raf/MEK/ERK途径中丝氨酸/苏氨酸激酶,抑制肿瘤新生血管形成;起到抗肿瘤细胞增殖和抗血管生成的双重作用[8]。
COX-2蛋白可增强肿瘤细胞侵袭性,抑制凋亡,抑制机体免疫反应[9],促进血管和淋巴管生成,促进肿瘤的生长和转移。选择性COX-2抑制剂主要通过抑制COX-2的活性,从而抑制肿瘤细胞增殖,诱导细胞凋亡[10],抑制肿瘤新生血管生成[11]。研究发现,塞来昔布可以抑制COX-2的合成,阻滞肝癌QGY-7701细胞G1-S期的转化[12];也可以抑制HepG2细胞NF-κB因子DNA结合活性和NF-κB因子P65蛋白的表达[13]。因此,塞来昔布的抗肿瘤能力并不完全取决于是否抑制COX-2的表达[14]。
索拉非尼和塞来昔布联合促进细胞凋亡的机制争论较多。有研究发现,塞来昔布联合索拉非尼在体外能够明显抑制肝癌SNU-449细胞增殖,机制可能是塞来昔布通过抑制IL-6/STAT3通路,减少STAT3下游表达基因,如Bcl-2、Bcl-XL和Survivin等,从而增强与其他抗癌药物联用时的效果[15]。也有研究认为,索拉非尼和塞来昔布联合能增强对肝癌细胞株HepG2、Huh7的毒性,使细胞凋亡增加;机制可能是通过PI3K-AKT抑制途径和RAS/RAF/MEK抑制途径相互作用[16]。
本研究发现,索拉非尼联合塞来昔布能协同抑制HepG2细胞增殖。从细胞周期分布来看,塞来昔布、索拉非尼抑制细胞生长,使细胞停滞在G0/G1期;联合用药后HepG2细胞G0/G1期阻滞更加明显。索拉非尼联合塞来昔布可能通过抑制HepG2中Cyclin D1、D3表达,增强G0/G1期细胞阻滞,抑制细胞增殖。
细胞周期的正常进行有赖于CDK与细胞周期蛋白Cyclin组成的一类蛋白复合物的调节。细胞周期蛋白D(Cyclin D)是G1/S期转换的重要正性调控因子,是G1期细胞增殖信号的关键蛋白[17],包括3个亚型:Cyclin D1、Cyclin D2和Cyclin D3。研究发现,肝癌组织中Cyclin D1显著高于正常肝组织及癌旁硬化肝组织,Cyclin D1的表达与肿瘤包膜的完整性、分化程度,肿瘤的临床分期及预后相关[18]。Cyclin D1过度表达使细胞周期G1/S期转换时间缩短,导致细胞增殖失控,引起癌变[19]。Cyclin D3通过与CDK4或CDK6结合,使Rb蛋白发生磷酸化,促进与DNA合成有关的基因转录,促进细胞周期[20]。Cyclin D3/CDK4或CDK6复合体和Rb蛋白的磷酸化失活可能不仅仅是细胞进入细胞周期运行的必要因素,同时也是决定细胞凋亡是否能发生的关键。因此,Cyclin D1、D3表达下调,可能是索拉非尼联合塞来昔布协同抑制HepG2细胞增殖的机制之一。索拉非尼和塞来昔布在肝癌细胞之间的协同作用有望减少索拉非尼的高额成本,降低手足综合征、血压升高、脱发、腹泻、疲乏、骨髓抑制及肾功能损害等潜在的不良事件发生率。
本研究提示,塞来昔布能协同增加索拉非尼的抗肝癌效果,减少索拉非尼剂量并减轻其毒副作用。但是两药联合的协同作用的具体机制仍在深入研究,临床应用前仍需有待进一步动物实验,明确应用范围及安全剂量。
[1] 罗丽丹,罗帧.索拉非尼联合经动脉化疗栓塞治疗肝癌合并门静脉癌栓的疗效及安全性分析[J].中国医师杂志,2014,16(12): 1699-1701.
[2] 叶新平,尚丽明,苏智雄,等.TACE联合索拉非尼治疗不能再手术的复发性肝细胞癌的临床分析[J].实用医学杂志,2014,30(22):3660-3662.
[3] 刘勇,车平,刘嘉涪,等.环氧化酶-2在肝细胞癌中的表达及临床意义[J].检验医学与临床,2011,8(17):2055-2057.
[4] Kondo M,Yamamoto H,Nagano H,et al.Increased expression of COX-2 in nontumor liver tissue is associated with shorter disease-free survival in patients with hepatocellular carcinoma[J].Clinical Cancer Research,1999,5(12):4005-4012.
[5] 郑伟华,詹志光,何蕙泾.塞来昔布抑制转移性癌症疼痛的疗效及其胃肠道反应分析[J].广东医学杂志,2004,25(10):1156-1157.
[6] 戴体俊.合并用药的定量分析[J].中国药理学通报,1998,14:479-480.
[7] Strumberg D,Clark JW,Awada A,et al.Safety,pharmacokinetics,and preliminary antitumor activity of sorafenib: a review of four phase I trials in patients with advanced refractory solid tumors[J].Oncologist,2007,12(4):426-437.
[8] Wilhelm SM,Carter C,Tang L,et al.BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J].Cancer Research,2004,64(19):7099-7109.
[9] Pockaj BA,Basu GD,Pathangey LB,et al.Reduced T-cell and dendritic cell function is related to cyclooxygenase-2 overexpression and prostaglandin E-2 secretion in patients with breast cancer[J].Ann Surg Oncol,2004,11(3):328-339.
[10]Kern MA,Schubert D,Sahi D,et al.Proapoptotic and antiproliferative potential of selective cyclooxygenase-2 inhibitors in human liver tumor cells[J].Hepatology,2002,36(4):885-894.
[11]左朝晖,黎祖荣,周晓,等.环氧合酶-2抑制剂塞来昔布对人肝癌HepG2裸小鼠移植瘤生长和肿瘤血管生成的抑制作用[J].癌症杂志,2006,25(4):414-420.
[12]唐保东,周奇,李媚,等.环氧合酶-2抑制剂塞来昔布对人肝癌细胞侵袭转移能力的影响[J].南方医科大学学报,2007,14(9):1400-1401,1413.
[13]卢栋,李永华,纪龙,等.塞来昔布对人肝癌细胞株HepG2细胞核转录因子-κB活性及蛋白表达的抑制[J].世界华人消化杂志,2008,40(16):1793-1796.
[14]Zhang S,Da L,Yang X,et al.Celecoxib potentially inhibits metastasis of lung cancer promoted by surgery in mice,via suppression of the PGE2-modulated β-catenin pathway[J].Toxicology Letters,2014,225(2):201-207.
[15]Liu Y,Liu A,Li H,et al.Celecoxib inhibits interleukin-6/interleukin-6 receptor-induced JAK2/STAT3 phosphorylation in human hepatocellular carcinoma cells[J].Cancer Prevention Research,2011,4(8):1296-1305.
[16]Morisaki T,Umebayashi M,Kiyota A,et al.Combining celecoxib with sorafenib synergistically inhibits hepatocellular carcinoma cells in vitro[J].Anticancer Res,2013,33(4):1387-1395.
[17]Musgrove EA,Caldon CE,Barraclough J,et al.Cyclin D as a therapeutic target in cancer[J].Nature Reviews Cancer,2011,11(8):558-572.
[18]刘娟,殷飞,姚树坤,等.细胞周期素Dl、视网膜母细胞瘤样蛋白2及微小染色体维持蛋白7在肝细胞癌中的表达及对预后的意义[J].中国病理生理杂志,2011,27(2):304-330.
[19]Zhang B,Liu W,Li L,et al.KAI1/CD82 and CyclinD1 as biomarkers of invasion,metastasis and prognosis of laryngeal squamous cell carcinoma[J].Int J Clin Exp Pathol,2013,6(6):1060-1067.
[20]邵晓轶,沈爱国,程纯.Cyclin D3与肿瘤的研究进展[J].实用癌症杂志,2004,19(4):440-442.
Effect of sorafenib and celecoxib combination therapy on proliferation of human hepatocellular carcinoma cell line HepG2invitro
ZHOU Shan-xue1,YE Xiao-lei2,ZHAO Ya-rong2,YING Fu-ming1,FENG Xue-feng1,FAN Tian-yi1,LI Xian-jie1
(1.Department of Hepatobiliary Surgery,The Affiliated Hospital of School of Medicine of Ningbo University,Ningbo 315020,China; 2.Ningbo Institute of Medical Sciences,Ningbo 315020,China)
Objective To investigate the effect of sorafenib and celecoxib combination therapy on proliferation of human hepatocellular carcinoma cell line HepG2.MethodsHepG2 cells were treated with different concertrations of sorafenib or celecoxib alone or their combination.The inhibitory effects were detected by MTT assay.Cell cycles were analyzed by flow cytometry in different groups.The expressions of cell cycle related proteins Cyclin D1,Cyclin D3,CDK4 were evaluated by Western blot.ResultsSorafenib or celecoxib used alone or combination inhibited the proliferation of HepG2 cells in a time- and dose-dependent manner,and a synergistic effects was observed in their combined action (P<0.05).G0/G1phase cell proportion in medication groups was higher than that in blank group,and G0/G1phase cell proportion in combination group was the highest.Compared with single drug or blank control group,the combination use could significantly inhibit Cyclin D1 and Cyclin D3 expression in HepG2 cell.ConclusionThe combination of sorafenib with celecoxib can inhibit Cyclin D1 and Cyclin D3 expression,increase the G0/G1phase retardation,and play a synergistic inhibitory effect for HepG2 cells.
Sorafenib; Celecoxib; Hepatoma cell
2014-09-21
1.宁波大学医学院附属医院肝胆外科,浙江 宁波 315020;2.宁波市医学科学研究所,浙江 宁波 315020
宁波大学医学院附属医院医学科技计划项目(xyy11021)
10.14053/j.cnki.ppcr.201505005
