槲皮素体内外抑制人骨肉瘤细胞株143B增殖及其机制研究
2015-02-16李瑞生
江 波,李 灿,林 清,李瑞生
槲皮素体内外抑制人骨肉瘤细胞株143B增殖及其机制研究
江 波,李 灿*,林 清,李瑞生
目的 研究槲皮素体内外对骨肉瘤143B细胞增殖的抑制作用及其作用机制。方法体外培养人骨肉瘤143B细胞,随机分组,MTT法检测细胞增殖抑制率;流式细胞术检测凋亡率和细胞周期;建立143B细胞裸鼠异种移植瘤模型,随机分为阴性对照组、5-Fu阳性对照组及槲皮素3个剂量组,每周给药3次,4周后处死裸鼠,剥瘤,计算抑瘤率;采血,双抗体夹心ABC-ELISA法测TNF-α和TGF-α的含量。结果槲皮素(10~320 μmol/L)体外可明显抑制143B细胞的增殖,且具有浓度和时间依耐性;在40~160 μmol/L浓度下,槲皮素可诱导143B细胞凋亡;将细胞阻滞在G0-G1期;体内抑制肿瘤生长,提高血清TNF-α含量,降低TGF-α的含量。结论槲皮素抑制143B细胞的作用机制与诱导细胞凋亡和将细胞周期阻滞在G0~G1期,及增强机体免疫功能有关。
槲皮素;143B;增殖;凋亡;裸鼠;TNF-α;TGF-α
0 引言
骨肉瘤是常见的原发性骨恶性肿瘤之一,好发于青少年长骨干骺端,进展快,易复发,恶性程度高,预后差等[1-2]。目前采用新辅助化疗法联合免疫及基因治疗能明显改善患者预后[3]。但是骨肉瘤的发生和发展过程复杂,受多种因素的影响和制约,且对大多数化疗药物不敏感[4-5]。因此,寻找天然有效的抗肿瘤药物,改善患者生存质量极其重要。
槲皮素是一种具有多种生物活性的天然的黄酮类化合物,具有显著的抗氧化、抗血小板聚集、抗炎、抗病毒、调节免疫功能等作用[6-7]。已有研究发现,槲皮素对多种恶性肿瘤细胞均有抑制增殖和诱导凋亡的作用[8-10],而目前槲皮素在抗骨肉瘤方面的报道较少。本实验建立移植瘤模型裸鼠,考察其体内的抑瘤率,为进一步研究槲皮素抑制143B细胞增殖及诱导其凋亡的作用机制提供理论依据。
1 材料和仪器
骨肉瘤细胞株143B购于中国科学院上海细胞研究所;SPF级BALB/C-nu裸鼠,体重16~20 g,购于中国医学科学院上海实验动物繁殖中心,按SPF级要求管理;胎牛血清(杭州四季青生物工程材料公司);DMEM培养基(HyClone公司);5-Fu(天津金耀氨基酸有限公司);MTT和胰蛋白酶(Sigma公司);ELx800型酶联免疫检测仪(BIO-TEK公司);CO2孵箱(JOUAN公司);流式细胞仪FACS Calibur(Becton Dickinson公司);其他试剂均为国产分析纯。
2 方法
2.1 细胞培养 将人骨肉瘤143B细胞接种于含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM完全培养液中,置于37 ℃、5% CO2饱和湿度的培养箱中培养,用胰蛋白酶消化后按1∶3的比例传代,每3天传代1次,取处于对数生长期的细胞用于本实验。
2.2 细胞增殖抑制率的测定 采用噻唑蓝(MTT)还原法检测细胞增殖抑制率。取处于对数生长期的143B细胞,制成1×105/mL细胞悬液,接种于96孔培养板中,每孔100 μL,培养24 h。将槲皮素溶解于DMEM培养液中,分别加入96孔培养板,使最终每组含槲皮素浓度分别为:10、20、40、80、160、320 μg/mL,每个浓度6个复孔,空白对照组加等量DMEM培养液。分别于24、48和72 h后各取出一块板进行MTT比色实验:将各孔中的上清液吸出100 μL弃去,加入MTT 10 μL(终浓度5 mg/mL),继续培养4 h后,加入DMSO 100 μL振荡使沉淀充分溶解,用酶标仪于波长570 nm处读取吸光度值(A)。按公式“(1-药物孔A值/对照孔A值)×100%”计算细胞抑制率,以剂量和抑制率绘制生长曲线。
2.3 细胞凋亡和细胞周期的测定 采用流式细胞术检测细胞凋亡和细胞周期。按照试剂盒说明,将对数生长期的143B细胞调整密度为1×106/mL,接种于培养瓶中。24 h后随机分组,分别加入槲皮素使终浓度为40、80、160 μg/mL,阳性对照组加入顺铂,对照组加入等体积的DMEM培养液,48 h后常规消化洗涤细胞,用70%预冷乙醇固定,置4 ℃环境待测凋亡率。检测前,先离心弃上清,用PBS洗涤后置于柠檬酸缓冲液中1 h以上,然后调整细胞浓度至1×106/mL,用流式细胞仪检测细胞凋亡率并分析细胞周期。
2.4 制备模型、分组及给药 将对数生长期的骨肉瘤143B细胞调整浓度为1×107/mL。取4~6周龄的BALB/C-nu裸鼠,将细胞于无菌条件下接种于左侧背部皮内,致瘤后,无菌条件下以组织瘤块移植传代,4代后生物学特征稳定。以无菌技术取出皮下移植瘤,剪切后接种于裸鼠左侧背部皮内,待5~7 d成瘤后将荷瘤裸鼠随机分为5组,每组5只。阴性对照组ip给予生理盐水,5-Fu阳性对照组ip 5-Fu 25 mg/kg、槲皮素3个剂量组分别按25、50、100 mg/kg ip给药,每周给药3次,每次0.2 mL,各组均连续给药4周。
2.5 抑瘤率的检测 取血后,脱颈椎处死裸鼠,剥取瘤块,剔除其他组织后分析天平称取瘤重量。计算各组平均瘤块重量及抑瘤率。肿瘤抑制率(%)=[1-(治疗组平均瘤重/阴性对照组平均瘤重)]×100%。
2.6 裸鼠血清TNF-α和TGF-α的测定 末次给药24 h后眼眶静脉丛采血,离心后取上清液分装于EP管中。按照检测试剂盒说明书采用双抗体夹心ABC-ELISA法检测TNF-α的含量。建立标准曲线:设标准孔8孔,每孔加入样品稀释液100 μL,第一孔加标准品100 μL,混匀后吸出100 μL移至第2孔。如此反复对倍稀释至第7孔,从第7孔吸出100 μL弃去,第8孔为空白对照。前7孔加入裸鼠血清100 μL,置于37 ℃反应120 min。用洗涤液将反应板充分洗涤4~6次,吸水纸拍干。每孔加入第一抗体工作液100 μL,混匀后置37 ℃反应60 min。再次洗涤4~6次,加入酶标抗体工作液100 μL,37 ℃反应60 min,洗板同前。加入底物工作液100 μL,37 ℃暗处反应5~10 min,再加入50 μL终止液混匀,酶联免疫检测仪于490 nm处测吸光度,绘制标准曲线,计算TNF-α含量。吸光度值的高低和细胞因子表达成正比。同法检测TGF-α的含量。
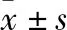
3 结果
3.1 槲皮素对骨肉瘤143B细胞生长的抑制作用 于倒置显微镜下观察发现,与空白对照组相比,槲皮素作用后的细胞排列稀疏,且随着药物浓度的增加和作用时间的延长,细胞密度逐渐减少。不同剂量的槲皮素对143B细胞的增殖均有抑制作用,各药物组细胞生长抑制率与相对应的空白对照相比差异均有统计学意义(P<0.05),随着作用时间的延长,对细胞生长的抑制作用增强,由此可见,槲皮素体外对143B细胞的抑瘤作用呈现浓度和时间依赖性,见图1。

图1 槲皮素对143B细胞增殖的抑制作用
3.2 槲皮素对骨肉瘤143B细胞凋亡的影响 经流式细胞仪检测发现,槲皮素可诱导骨肉瘤143B细胞凋亡。低、中、高3个浓度的槲皮素作用143B细胞后的细胞凋亡率分别为19.25%±5.04%、29.76%±5.20%、31.98%±6.18%,明显高于对照组,随着剂量的增加,凋亡率增加,见表1。

表1 槲皮素对143B细胞凋亡的影响(n=3)
3.3 槲皮素对骨肉瘤143B细胞周期的影响 槲皮素作用于143B细胞48 h后,细胞周期均受到不同程度的影响,与对照组相比,三个剂量组的G0~G1期细胞比例均增加,与对照组比较差异均有统计学意义(P<0.05),G0-G1期比例的增加与浓度无关;S期和G2-M期略有减少,但与对照组之间差异无统计学意义。提示槲皮素可通过将细胞周期阻滞在G0-G1期从而抑制骨肉瘤细胞的生长,见表2。

表2 槲皮素对143B细胞周期的影响(n=3)
3.4 槲皮素对荷瘤裸鼠瘤重量的影响 实验结果显示,给药4周后,5-Fu(25 mg/kg)对荷瘤裸鼠瘤重量的生长有明显的抑制作用,与模型组比较差异有统计学意义(P<0.001);槲皮素3个剂量组(25、50、100 mg/kg)皆可不同程度抑制荷瘤裸鼠瘤重量的增加,与模型组相比差异均有统计学意义(P<0.01或P<0.05),且抑瘤率呈现剂量依赖性,见表3。

表3 槲皮素对荷瘤裸鼠瘤重量的影响(n=5)
3.5 槲皮素对荷瘤裸鼠血清TNF-α和TGF-α含量的影响 模型组裸鼠TNF-α含量低于正常对照组,TGF-α含量高于正常对照组(P<0.01);5-Fu(25 mg/kg)能够提高荷瘤裸鼠的TNF-α含量(P<0.01),降低TGF-α含量(P<0.01);槲皮素在25、50 mg/kg剂量下,可提高荷瘤小鼠的血清TNF-α含量,以高剂量效果较好(P<0.05);槲皮素3个剂量均可降低荷瘤裸鼠血清TGF-α的含量,以中剂量效果最好(P<0.05),见表4。

表4 槲皮素对荷瘤裸鼠血清TNF-α和TGF-α含量的影响(,n=6)
4 讨论
细胞增殖主要受细胞周期和凋亡两个因素的影响。细胞凋亡过多或过少均会引发多种疾病[11]。诱导肿瘤细胞凋亡已成为现代肿瘤药物治疗的新策略[12]。槲皮素是一种广泛存在于自然界的黄酮类化合物,具有多种生物活性[13]。国内外已有的研究表明,其在保护细胞减少氧化应激的损害、缓解免疫损伤、促进肿瘤细胞凋亡和抑制肿瘤细胞增殖中发挥了重要作用,且槲皮素作为天然药物,其抗肿瘤作用具有选择性,在杀伤肿瘤细胞的同时,对正常细胞的毒性极其微弱[14]。
本实验采用MTT法及流式细胞术检测槲皮素体外对人骨肉瘤143B细胞的抗瘤效果,结果表明,槲皮素能够明显抑制143B细胞的生长,诱导其凋亡,使细胞周期阻滞在G0~G1期,随着药物浓度增高和作用时间的延长,槲皮素对人骨肉瘤143B细胞增殖的抑制率也增加,细胞形态发生明显改变,由此可见,槲皮素对143B细胞的抑制作用具有量效和时效关系。
裸鼠异种移植瘤模型是肿瘤实验中广泛应用的肿瘤动物模型。本实验结果显示,建立143B细胞裸鼠移植瘤模型,给药4周后,肿瘤生长明显受到抑制,随着给药剂量的增加,瘤块体积逐渐减小,低、中、高3个剂量组槲皮素的抑瘤率分别为28.64%、39.68%和51.20%,提示槲皮素体内可明显抑制骨肉瘤的生长,作用呈现剂量依赖性。
TNF-α属肿瘤坏死因子家族,主要由活化的单核-巨噬细胞分泌,也可由NK细胞、T细胞产生和释放。TNF-α是具有多种生物效应的细胞因子,机体内适量的TNF-α在肿瘤防御中起着重要作用,能够激活T淋巴细胞,刺激机体产生抗体和细胞因子,直接杀伤肿瘤细胞而对机体正常细胞无毒性;也可通过提高机体的免疫功能而发挥抗肿瘤作用;还可诱导多种不同类型的肿瘤细胞凋亡,其对肿瘤发生机制具有十分重要的研究价值[15-18]。TGF-α可与表皮生长因子受体(EGFR)结合,激活MAPK信号系统,促使DNA合成,从而促使肿瘤细胞在失控状态下不断增殖和分化,进而发生癌变[19-20]。TGF-α表达程度与肿瘤的恶性程度之间呈线性关系。本研究结果显示,荷瘤模型裸鼠血清TNF-α水平明显降低,TGF-α水平明显升高,说明裸鼠荷瘤以后,其免疫功能受到抑制,而在行槲皮素给药后,荷瘤裸鼠血清TNF-α水平显著升高,TGF-α水平明显降低,提示槲皮素可通过上调血清TNF-α水平或/和下调TGF-α水平,增强荷瘤机体的免疫功能,进而达到抑制骨肉瘤的目的。
[1] 宁金沛,梁柱德,韦武,等.髋部晚期骨肉瘤的手术治疗[J].实用骨科杂志,2014,20(1):72-75.
[2] 徐飞,任晔,宫晨,等.PPAR激动剂对MG-63细胞分泌OPG/RANKL的影响[J].骨科,2014,5(1):9-10.
[3] 刘琦,李晓阳,肖涛.骨肉瘤优化新辅助化疗方案临床疗效观察[J].中国医师杂志,2014,16(5):634-637.
[4] 王雪,张威.大剂量甲氨蝶呤治疗骨肉瘤的研究进展[J].中国医药,2013,8(1):142-144.
[5] 李珊珊,张娜.还原叶酸载体基因甲基化和甲氨蝶呤耐药的关系[J].国际儿科学杂志,2014,41(3):267-270.
[6] 刘爽.广枣总黄酮对CVB3病毒引起细胞凋亡的影响[J].中医药导报,2011,17(3):87-89.
[7] 韩丽萍,徐长庆,李鸿珠,等.槲皮素对大鼠血管平滑肌肌张力的影响[J].浙江中医药大学学报,2011,35(4):562-564.
[8] Jung YI,Heo J,Lee YJ,et al.Quercetin enhances TRAIL induced apoptosis in prostate cancer cells via increased protein stability of death receptor 5[J].Life Sci,2010,86(10):351-357.
[9] Suh DK,Lee EJ,Kim HC,et al.Induction of G(1)/Sphase arrest and apoptosis by quercetin in human osteosarcoma cells[J].Arch Pharm Res,2010,33(5):781-785.
[10]王晓燕,张尤历,张恒,等.槲皮素对人胃癌细胞侵袭和MMP-2表达的影响[J].世界华人消化杂志,2012,20(3):215-218.
[11]Brunelle JK,Letai A.Control of mitochondrial apoptosis by the Bcl-2 family[J].J Cell Sci,2009,122(Pt 4):437-441.
[12]杜圣红,何丛,贾培敏,等.伊马替尼联合槲皮素对K562细胞增殖、凋亡的影响及其机制研究[J].诊断学理论与实践,2013,12(6):610-613.
[13]肖洁,牛国敏,尹松梅,等.槲皮素联合硼替佐米或雷利度胺对抑制HL-60细胞增殖的影响[J].实用医学杂志,2014,30(14):2196-2199.
[14]Cheng S,Gao N,Zhang Z,et al.Quercetin induces tumor-selective apoptosis through downregulation of Mcl-1 and activation of Bax[J].Clin Cancer Res,2010,16(23):5679-5691.
[15]Kruglov AA,Kuchmiy A,Grivennikov SI,et al.Physiological functions of tumor necrosis factor and the consequences of its pathologic overexpression or blockade: Mouse models[J].Cytokine Growth Factor Rev,2008,19:231-244.
[16]陈学彰,田华琴,黄志庆,等.肺积方对Lewis肺癌小鼠抑瘤率及EGFR、TNF-α表达的实验研究[J].中西医结合研究,2013,5(1):17-20.
[17]曹兴国,魏强,俞海英,等.原发性肝癌微波消融治疗前后TNF-α和TGF-β1变化及其临床意义[J].肝脏,2013,5(18):319-321.
[18]向春艳,何小燕,李逐波,等.TNF-α在癌症中的作用研究进展[J].生命科学,2012,24(3):250-254.
[19]Kikuehi K,Li XH,Zheng Y,et al.Invasion of breast cancer cells into collagen matrix requires TGF-a and Cdc42 signaling[J].FEBS Letters,2011,585(2):286-290.
[20]Kobayashi K,Kusakabe M,Okada M,et al.Immunohistochemical localization of transforming growth factor alpha in chemically induced rat hepatocellular carcinomas with reference to differentiation and proliferation[J].Toxicol Pathol,2000,28(5):664-667.
Effect of quercetin on tumor growth in human osteosarcoma cell line 143Binvivoandinvitroand its mechanism
JIANG Bo,LI Can*,LIN Qing,LI Rui-sheng
(Xiangyang Central Hospital Affiliated to Hubei University of Arts and Science,Xiangyang 441021,China)
Objective To study the influence of apoptosis and apoptosis pathway on human osteosarcoma 143B cells by quercetin.Methods143B cells were culturedinvitro,and MTT was performed to observe the proliferation.Flow cytometry was utilized for measuring the apoptosis and cell cycle.After subcutaneous implantation of the 143B cells,the tumor-bearing nude mice were randomized into control group,5-Fu group,three doses quercetin groups.The medication groups were given the corresponding drugs.After 4 weeks,the tumor was peeled off and tumor-inhibition rate was counted.The expression of TNF-α and serum TGF-α was determined by enzyme-linked immunosorbent assay.ResultsQuercetin could inhibit the proliferation of 143B cellsinvitroat 10~320 μmol/L,which was concentration- and time-dependence.At a dosage of 40~160 μmol/L in cultured cells,the apoptosis rates was elevated,and cell cycle was blocked in G0~G1phase.Quercetin was able to inhibit the tumor growth in a dose-dependent manner,inhibited the expression of TGF-α,and promoted the expression of TNF-α.ConclusionQuercetin can inhibit the growth of 143Binvitroandinvivo,the mechanism of anti-tumor effect relates to inducing apoptosis,arresting cell cycle at the G0~G1phase,and enhancing immune function.
Quercetin; 143B; Proliferation; Apoptosis; Nude mice; TNF-α; TGF-α
2014-06-09
湖北文理学院附属襄阳市中心医院,湖北 襄阳 441021
*通信作者
10.14053/j.cnki.ppcr.201505004
