SIRT1在有氧运动改善APOE-/-小鼠肝脏脂代谢异常中的作用研究
2015-02-15燕小妮
燕小妮
SIRT1在有氧运动改善APOE-/-小鼠肝脏脂代谢异常中的作用研究
燕小妮
目的:探讨SIRT1在有氧运动改善APOE-/-小鼠肝脏脂代谢异常中的作用。方法:16只雄性 C57BL/6J小鼠随机分为 C57BL/6J小鼠对照组(CC)和运动组(CE),16只雄性APOE-/-小鼠随机分为APOE-/-小鼠对照组(AC)和运动组(AE),每组8只。12周有氧运动干预后,通过病理学切片观察肝脏脂质积聚情况,检测小鼠肝脏SIRT1、LKB1、P-LKB1-ser428、AMPKα1、P-AMPKα1-Thr172和FAS蛋白表达量。结果:1)与CC组比较,AC组肝脏脂肪积聚增加,与AC组比较,AE组肝脏脂质积聚减少;2)与CC组比较,CE组SIRT1 (P<0.05)、P-LKB1-ser428(P<0.01)和P-AMPKα1-Thr172(P<0.01)含量明显升高,LKB1、AMPKα1和FAS没有明显变化(P>0.05);3)与CC组比较,AC组SIRT1 (P<0.05)、P-LKB1-ser428(P<0.01)和P-AMPKα1-Thr172(P<0.01)表达明显降低,LKB1、AMPKα1和FAS没有明显变化(P>0.05);4)与AC组比较,AE组SIRT1 (P<0.01)、P-LKB1-ser428(P<0.01)和P-AMPKα1-Thr172(P<0.01)表达明显升高,FAS表达明显降低(P<0.01),LKB1和AMPKα1没有明显变化(P>0.05)。结论:12周有氧运动可能通过增加SIRT1表达,提高LKB1和AMPKα1活性,抑制FAS表达,改善APOE-/-小鼠肝脏脂代谢异常。
有氧运动;肝脏脂代谢;动脉粥样硬化;动物实验;鼠
肝脏是研究脂代谢的重要靶器官,是内源性和外源性脂代谢途径的交汇点和调节中心,能够合成和释放各种脂蛋白及脂代谢酶类,在维持脂代谢平衡中发挥着重要的作用[7]。APOE-/-小鼠是研究动脉粥样硬化的最常见模型,有研究发现,高脂喂养的APOE-/-小鼠肝脏有明显的脂质沉积,这可能影响肝细胞的正常形态和机能,诱发动脉粥样硬化肝脏脂肪性病变[1]。SIRT1是哺乳动物sir2同系物[9],一种NAD依赖的脱乙酰化酶,参与糖脂代谢[4]和寿命的调节[10]。研究显示,2型糖尿病鼠附睾脂肪组织[17]和比目鱼肌[5]SIRT1表达水平下降,提示,SIRT1表达降低可能是某些慢性代谢疾病的病症之一。那么,动脉粥样硬化肝脏SIRT1表达是否降低?若SIRT1表达降低,是否与动脉粥样硬化肝脏脂代谢异常有关?有氧运动能否增加动脉粥样硬化肝脏SIRT1表达,SIRT1表达增加是否与运动改善肝脏脂代谢异常有关尚不明确。AMPK是细胞能量状态的感受因子,能够被其上游的LKB1、CaMkkB和TAK1激活。已有研究表明,高糖导致的肝脏AMPK功能受损,引起肝脏脂质积聚,而采用多酚类激活肝脏AMPK,减少了脂质沉积[11,15,19,21]。Zang等[23]对人肝细胞和1型糖尿病LDL-/-鼠进行研究发现,多酚类显著激活了肝脏AMPK,减少了脂质的沉积,减轻了糖尿病鼠的高脂血症和动脉粥样硬化。动脉粥样硬化肝脏AMPK的表达和活性是否降低,有氧运动能否影响AMPK的表达和活性,如果影响,是否与有氧运动影响SIRT1表达的变化有关,这些问题的答案尚不清楚。本研究的目的是通过观察12周有氧运动对APOE-/-小鼠肝脏SIRT1表达的影响,探讨SIRT1在有氧运动改善动脉粥样硬化肝脏脂代谢异常中的作用。
1 实验材料与方法
1.1 实验动物及分组
健康SPF级7周龄APOE-/-小鼠和 C57BL/6J小鼠购自广东省医学实验动物中心[许可证号为SCXK(粤)2008-0002],适应性喂养1周后[动物房温度为(25±1)℃,湿度为50%±5%,光照周期为12 h],随机分为4组,C57BL/6J小鼠对照组(CC组)、C57BL/6J小鼠运动组(CE组),APOE-/-小鼠对照组(AC组)、APOE-/-小鼠运动组(AE组)、每组8只。APOE-/-小鼠饲以高脂饲料(胆固醇含量为0.15%,脂肪含量为21%)。C57BL/6J小鼠饲以普通饲料。
1.2 运动方案
小鼠采用不负重游泳训练方式进行12周的有氧运动,游泳在白色的大水桶中进行,每桶4只动物,水深60 cm,水温(32±1)℃,第1周30 min/d,第2~12周60 min/d,每周训练6 d。
1.3 实验取材
干预停止36 h后利用10%水合氯醛(3.5 ml/kg bw)对小鼠进行麻醉后取相同部位的肝脏,将取出的肝脏一部分迅速置于液氮罐中备用测试蛋白指标,一部分置于10%甲醛溶液中固定48 h,用于制备肝脏组织病理切片。
1.4 主要实验仪器、试剂及材料
1.4.1 主要实验仪器
WO-9413B型凝胶成像系统(北京六一);DYCZ-24DN型电泳仪(北京六一);DYCZ-40D型电泳仪(转膜,北京六一);AX-ⅡX射线摄影暗匣(广东粤华);HM340E轮转式切片机(北京中昇天成科技有限公司)。
1.4.2 主要实验试剂及材料
PVDF膜(Milli pore);GADPH酶标记二抗 (武汉博士德);兔抗大鼠SIRT1(北京博奥森)、LKB1 (武汉博士德)、FAS(武汉博士德)、P-LKB1-ser428 (北京博奥森)、AMPKα1 (北京博奥森)、P-AMPKα1-Thr172(北京博奥森)多克隆抗体。
1.5 检测指标及方法
肝脏SIRT1、LKB1、FAS、P-LKB1-ser428、AMPKα1 、P-AMPKα1-Thr172蛋白表达采用Western-blot方法检测。Western-blot检测步骤为:SDS-PAGE电泳(5%浓缩胶90 V,12%分离胶110 V,不恒定电流,约1.5 h)。取分离胶将其放入电转膜仪转膜(90 V,30~90 min),将蛋白转移到PVDF膜上,室温下用5%脱脂奶粉(用TBS稀释)室温封闭30 min,再4℃过夜,第2天室温平衡。不洗膜加一抗(1∶200,稀释液含2%的脱脂奶粉)孵育,4 ℃过夜。TBS洗膜4次,第1次15 min,后3次每次5 min。将膜在室温下与二抗(1∶5 000,稀释液含2%的脱脂奶粉)室温下孵育1 h,TBS漂洗。将PVDF膜上的TBS吸干,加入ECL化学发光试剂(试剂盒),放入凝胶成像系统。
1.6 数据统计

2 实验结果与分析
2.1 不同组别小鼠肝脏HE染色图片
图1所示,肝脏石蜡切片经HE染色后,CC组和CE组小鼠肝脏都没有发现明显病理学改变。AC组小鼠肝小叶中血管充血,在中央静脉周围肝细胞脂肪变性明显,肝板中肝细胞有明显的点状坏死区域,周围有明显的炎性细胞浸润。AE组小鼠肝小叶结构基本正常,在肝板中有点状坏死区域,周围有炎性细胞浸润,肝细胞脂肪变性轻微。
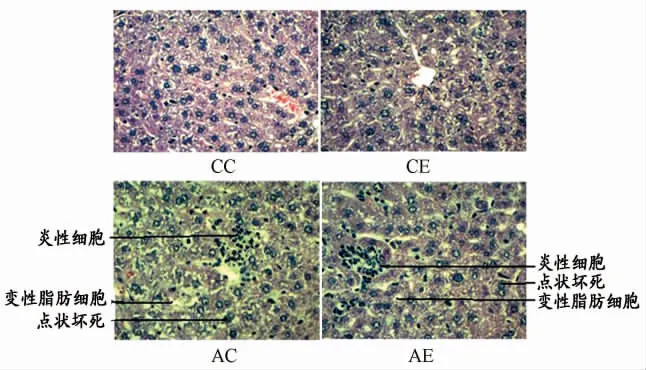
图1 本研究不同组别小鼠肝脏HE染色图片示意图
2.2 不同组别小鼠肝脏SIRT1、LKB1 、P-LKB1-ser428、AMPKα1、P-AMPKα1-Thr172、FAS蛋白表达的比较
高脂饮食的APOE-/-小鼠肝脏SIRT1表达较C57BL/6J小鼠显著性降低(P<0.05),运动训练明显升高C57BL/6J小鼠和APOE-/-小鼠肝脏SIRT1表达 (P<0.05,P<0.01,图3)。 高脂饮食的APOE-/-小鼠肝脏P-LKB1-ser428 表达较C57BL/6J小鼠明显降低(P<0.01),运动干预明显升高C57BL/6J小鼠和APOE-/-小鼠肝脏P-LKB1-ser428 表达(P<0.01,图4),不同组别小鼠肝脏LKB1表达没有明显变化(图5)。
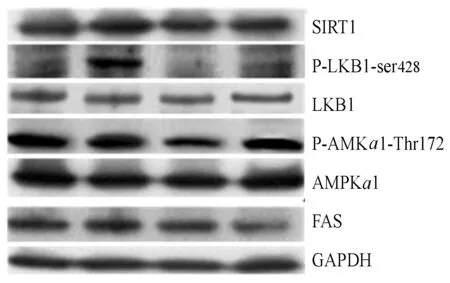
图2 本研究不同组别小鼠肝脏蛋白表达图谱

图3 本研究不同组别小鼠SIRT1表达变化示意图

图4 本研究不同组别小鼠P-LKB1-ser428 表达变化示意图

图5 本研究不同组别小鼠LKB1表达变化示意图
高脂饮食的APOE-/-小鼠肝脏P-AMPKα1-Thr172表达显著降低(P<0.01),运动干预明显升高肝脏P-AMPKα1-Thr172的表达 (P<0.01,图6)。不同组别小鼠肝脏AMPKα1表达没有显著性差异(P>0.05,图7)。高脂饮食的APOE-/-小鼠肝脏FAS表达没有明显变化,运动干预明显降低了APOE-/-小鼠肝脏FAS的表达(P<0.01,图8)。

图6 本研究不同组小鼠P-AMPKα1-Thr172表达变化示意图

图7 本研究不同组别小鼠AMPKα1表达变化示意图

图8 本研究不同组别小鼠FAS表达变化示意图
3 讨论
3.1 高脂喂养APOE-/-小鼠肝脏脂代谢异常
邹艳艳[7]研究发现,用高脂喂养的APOE-/-/LDLR-/-小鼠肝脏存在明显的脂质沉积,引起肝脏脂肪变性。当前研究也发现,利用高脂喂养的APOE-/-小鼠,肝脏存在明显的脂质积聚,脂肪细胞变性明显增加(图1,AC组),有炎性细胞侵润。本实验检测了肝细胞中与脂质代谢有关的指标LKB1 、P-LKB1-ser428、AMPKα1 、P-AMPKα1-Thr172和FAS蛋白表达情况,发现高脂喂养的APOE-/-小鼠肝脏中LKB1、AMPKα1 和FAS没有明显变化,而P-LKB1-ser428和P-AMPKα1-Thr172的表达明显降低,提示,高脂喂养的APOE-/-小鼠肝脏脂代谢调节因子异常。先前研究表明,SIRT1与脂代谢存在明显相关,王军力等[6]研究发现,SIRT1可能通过促进PPARγ和aP2蛋白的表达改善2型糖尿病大鼠内脏脂肪组织脂代谢异常。有综述报道,用白藜芦醇干预高脂饮食喂养的大鼠,结果表明大鼠体重增加减慢,提示SIRT1能够抑制脂肪生成,加速脂肪分解[4]。本研究发现,高脂喂养的APOE-/-小鼠肝脏SIRT1表达明显降低,先前研究[5,19]指出,SIRT1在组织表达中降低可能是慢性代谢疾病的病理特征之一,提示,SIRT1表达下降可能是APOE-/-小鼠肝脏脂代谢异常的原因之一。
3.2 有氧运动对APOE-/-小鼠肝脏SIRT1和AMPKα1表达的影响
研究发现,耐力训练能够使正常大鼠[16,20]和糖尿病大鼠[5]比目鱼肌中SIRT1表达明显增加。有氧运动是否影响APOE-/-小鼠肝脏SIRT1的表达尚不明确。本研究发现,高脂喂养的APOE-/-小鼠肝脏SIRT1表达明显降低,经过12周的有氧运动明显提高了C57BL/6J小鼠和APOE-/-小鼠肝脏SIRT1表达。AMPK是细胞能量状态的感受因子,AMP/ATP含量增加能够导致AMPK的活化[21]。AMPK与脂代谢关系密切,有研究发现,在脂肪肝状态下AMPK的活性明显降低[22],这与本研究的结果一致。已有研究发现,有氧运动能够增加胰岛素抵抗小鼠[3]和糖尿病大鼠[2]骨骼肌中AMPK的表达或活性。有研究表明,高糖血症诱导肝脏AMPKα1 功能异常导致了糖尿病动物肝脏脂质积聚,用白藜芦醇处理鼠的肝脏可以提高AMPKα1 的活性[8]。本研究发现,高脂喂养的APOE-/-小鼠肝脏AMPKα1 表达与C57BL/6J正常小鼠相比没有发生明显变化,但本实验进一步检测了AMPKα1 的磷酸化水平的变化,结果发现P-AMPKα1-Thr172的表达明显降低。此前,有氧运动能否影响肝细胞AMPKα1 和P-AMPKα1-Thr172的表达尚不明确。本研究发现,12周有氧运动对C57BL/6J小鼠和APOE-/-小鼠肝细胞AMPKα1的表达没有明显影响,但明显提高了两组小鼠P-AMPKα1-Thr172的表达,提示,有氧运动可以提高肝细胞AMPKα1 的活性。
3.3 SIRT1在有氧运动改善APOE-/-小鼠肝细胞脂质代谢异常的机制探讨
通过肝脏病理切片发现,12周有氧运动明显减少了APOE-/-小鼠肝脏脂肪积聚,脂肪变性明显减轻(图1,AE组),说明有氧运动明显改善肝脏脂代谢异常。分子和生物化学证据已经证实了SIRT1和AMPK之间存在密切的功能联系。SIRT1能够调节衰老和衰老相关的疾病[12],衰老伴随着AMPK活性降低,导致了脂代谢异常[17]。在脂代谢异常调节过程中,SIRT1和AMPK具有关键的调节作用[14]。有研究[23]进一步表明,SIRT1过度表达能够增加鼠肝细胞AMPKα1 的磷酸化水平,敲除SIRT1,AMPKα1 磷酸化水平降低,说明SIRT1是AMPKα1 信号通路的上游调节子。本研究最重要的研究任务是探讨SIRT1表达变化是否是有氧运动改善APOE-/-小鼠肝脏脂质代谢异常的关键调节子。本研究发现高脂喂养的APOE-/-小鼠肝脏SIRT1表达降低,尽管AMPKα1表达没有明显变化,但伴随着P-AMPKα1-Thr172表达减少,12周有氧运动明显增加了肝脏SIRT1表达,P-AMPKα1-Thr172表达也增加。
为了探讨SIRT1在有氧运动改善APOE-/-小鼠肝脏脂质代谢中作用的可能机理,本实验检测了AMPKα1 的上游调节子LKB1的表达及活性的变化和其下游与脂肪合成相关的FAS表达的变化。结果显示,高脂喂养的APOE-/-小鼠肝脏LKB1表达没有明显变化,12周有氧运动对C57BL/6J小鼠和APOE-/-小鼠肝脏LKB1的表达也没有明显影响。本研究进一步检测了P-LKB1-ser428的表达水平,结果发现,高脂喂养的APOE-/-小鼠肝脏P-LKB1-ser428水平明显下降,12周的有氧运动明显提高了C57BL/6J小鼠和APOE-/-小鼠肝脏P-LKB1-ser428的表达,说明有氧运动可以提高C57BL/6J小鼠和APOE-/-小鼠肝脏LKB1的活性。FAS能够促进脂肪的合成,在肥胖动物脂肪组织中FAS表达增加[18]。本研究发现,高脂喂养的APOE-/-小鼠肝脏FAS表达没有明显变化,12周有氧运动对C57BL/6J小鼠肝脏FAS的表达也没有明显影响,但是可以明显降低APOE-/-小鼠肝脏FAS的表达。有研究[13]发现,通过多酚类和SIRT1激活AMPK能够抑制FAS的脂肪合成能力,这与本研究的结果类似。因此,通过本实验研究发现,有氧运动可能通过增加APOE-/-小鼠肝脏SIRT1表达,激活LKB1和AMPKα1,抑制肝脏FAS的表达,减少了肝脏脂质的集聚。
4 结论
12周有氧运动可能通过SIRT1/LKB1/ AMPKα1/FAS信号途径改善小鼠肝脏脂代谢异常,SIRT1在调节过程中有非常关键的作用。
[1]杜慧.高脂高胆固醇饮食喂养的APOE-/-小鼠肝脏脂代谢相关基因的表达研究[D].济南:山东师范大学硕士学位论文,2009.
[2]刘霞,张瑜,徐广艳,等.有氧运动联合膳食干预对2 型糖尿病大鼠骨骼肌AMPK 含量和活性的影响[J].西安体育学院学报,2011,28(3):344-348.
[3]牛燕媚,苑红,刘彦辉,等.有氧运动对胰岛素抵抗小鼠骨骼肌球形脂联素及腺苷酸活化蛋白激酶的影响[J].中国运动医学杂志,2009,28(1): 36-40.
[4]王军力,肖国强,曹姣.SIRT1与糖脂代谢及其与运动关系研究进展[J].中国运动医学杂志,2012,31(4):356-362.
[5]王军力,肖国强,曹姣,等.SIRT1在运动训练和白藜芦醇改善T2DM大鼠骨骼肌胰岛素信号通路中的作用[J].上海体育学院学报,2013,37(5):78-83.
[6]王军力,肖国强,曹姣,等.运动训练和白藜芦醇改善2型糖尿病大鼠脂代谢异常的SIRT1 机制研究[J].西安体育学院学报,2013,30(5):108-114.
[7]邹艳艳.高脂高胆固醇饮食喂养的APOE-/-/LDLR-/-小鼠肝脏脂代谢相关基因的表达研究[D].济南:山东师范大学硕士论文,2009.
[8]BAUR J A,PEARSON K J,PRICE N L,etal.Resveratrol improves health and survival of mice on a high-calorie diet[J].Nature,2006,444 (7117): 337-42.
[9]CHENG H L,MOSTOSLAVSKY R,SAITO S,etal.Developmental defects and p53 hy peracetylation in sir2 homology(SIRT1)-deficient mice[J].Dev Biol,2003,100 (19):10794-10799.
[10]CHUA K F,MOSTOSLAVSKY R,LOMBARD D B,etal.Mammalian SIRT1 limits replicative lifespan in response to chronic genotoxic stress[J].Cell Metab,2005,2(1):67-76.
[11]HAWLEY S A,PAN D A,MUSTARD K J,etal.Calmodulin-dependent protein kinase kinase-β is an alternative-upstream kinase for AMP-activated protein kinase[J].Cell Metab,2005,2(1):9-19.
[12]HAIGIS M C,GUARENTE L P.Mammalian sirtuins- emerging roles in physiology,aging,and calorie restriction[J].Genes Dev,2006,20(21):2913-2921.
[13]HOU X,XU S,MAITLAND-TOOLAN K A,etal.SIRT1 regulates hepatocyte lipid metabolism through activating AMP-activated protein kinase[J].Biol Chem,2008,283(29):20015-26.
[14]LONG Y C,ZIERATH J R.AMP-activated protein kinase signaling in metabolic regulation[J].Clin Invest,2006,116(7):1776-1783.
[15]SUWA M,NAKANO H,RADAK Z,etal.Endurance exercise increases the SIRT1 and peroxisome proliferator-activated receptor γ coactivator-1α protein expressions in rat skeletal muscle[J].Clin Exp,2008,57(7):986-998.
[16]MOMCILOVIC M,HONG S P,CARLISON M.Mammalian TAK1 activates Snf1 protein kinase in yeast and phosphorylates AMP-activated protein kinase in vitro[J].Biol Chem,2006,281(35):25336-25343.
[17]QIAO L,SHAO J.SIRT1 regulates adiponectin gene expression through Foxo1- C/enhancer-binding protein alpha transcriptional complex[J].Biol Chem,2006,281(52):39915-39924.
[18]REZNICK R M,ZONG H,LI J,etal.Aging-associated reductions in AMP-actived protein kinase activity and mitochondrial biogenesis[J].Cell Metab,2007,4(5):151-156.
[19]RONCARI D A.Abnormalities of adipose cells in massive obesity[J].Int J Obes,1990,14(S3):187-192.
[20]SHAW R J,LAMIA K A,VASQUEZ D,etal.The kinase LKB1 mediates glucose homeostasis in liver and therapeutic effects of metformin[J].Sci,2005,310(5754):1642-1646.
[21]XIE M,ZHANG D,DYCK J R.A pivotal role for endogenous TGF-beta-activated kinase-1 in the LKB1/AMP-activated protein kinase energy-sensor pathway[J].Proc Natl Sci USA,2006,103(46):17378-17383.
[22]YU X,MCCORKLE S,WANG M,etal.Leptinomimetic effects of the AMP kinase activator AICAR in leptin-resistant rats:Prevention of diabetes and ectopic lipid deposition[J].Diabetologia,2004,47(11):2012-2021.
[23]ZANG M,XU S,MAITLAND-TOOLAN K Aetal.Polyphenols stimulate AMP-actived protein kinase,lower lipids,and inhibit accelerated atherosclerosis in diabetic LDL receptor-deficient mice[J].Diabetes,2006,55(8):2180-2191.
Research on Effect of SIRT1 on Ameliorating Hepatic Lipid Metabolism Disorder of APOE-/-after Aerobic Exercise
YAN Xiao-ni
Objective: To observe the effect of SIRT1 of aerobic exercise on the improvement liver lipid metabolism in APOE-/-rats.Methods: 16 male C57BL/6J rats were randomly divided into control group (CC,n=8),exercise group (CE,n=8),16 male APOE-/-rats were randomly divided into control group (AC,n=8),exercise group (AE,n=8).After 12 weeks intervention,hepatic lipid accumulation were observed,Also the protein expression of SIRT1,LKB1,P-LKB1-ser428,AMPKα1,P-AMPKα1-Thr172 and FAS were determined in the liver.Results: 1) Compared with CC group,hepatic lipid accumulation increased significantly in the AC group,Compared with AC,lipid accumulation decreased significantly in the AE group.2) Compared with CC group,the content of SIRT1 (P<0.05),P-LKB1-ser428(P<0.01)and P-AMPKα1-Thr172(P<0.01)increased significantly,while the expression of LKB1,AMPKα1 and FAS (P>0.05)didn’t change significantly in the CE group.3) Compared with CC group,the expression of SIRT1 (P<0.05),P-LKB1-ser-428(P<0.01)and P-AMPKα1-Thr172(P<0.01)decreased significantly,while the expression of LKB1,AMPKα1and FAS(P>0.05)didn’t change significantly in the liver of AC group.4)Compared with AC group,the content of SIRT1 (P<0.01),P-LKB1-ser428(P<0.01)and P-AMPKα1-Thr172(P<0.01)increased significantly,while that of FAS(P<0.01)decreased significantly,and that of LKB1 and AMPKα1 didn’t change obviously(P>0.05).Conclusions: 12 weeks aerobic exercise may be through promoting the SIRT1,increasing LKB1 and AMPKα1 activity,inhibiting the expression of FAS,to ameliorate hepatic lipid metabolism disorder of APOE-/-rats.
aerobicexercise;hepaticlipidmetabolism;atherosclerosis;animalexperiment;rat
2015-03-30;
2015-07-30
燕小妮(1979-),陕西户县人,讲师,硕士,主要研究方向为运动与健康,E-mail:634499211@qq.com。
怀化学院 体育系,湖南 怀化 418000 Huaihua University,Huaihua 418000,China.
1000-677X(2015)08-0040-05
10.16469/j.css.201508006
G804.7
A
