PARP抑制剂对糖尿病大鼠皮层神经元的保护作用
2015-02-07吴晓黎王智敏梁鹤缤郝颖郑东明郭阳
吴晓黎,王智敏,梁鹤缤,郝颖,郑东明,郭阳
(中国医科大学附属盛京医院神经内科,沈阳 110021)
·论著·
PARP抑制剂对糖尿病大鼠皮层神经元的保护作用
吴晓黎,王智敏,梁鹤缤,郝颖,郑东明,郭阳
(中国医科大学附属盛京医院神经内科,沈阳 110021)
目的研究PARP抑制剂3-氨基苯甲酰(3-AB)对链脲佐菌素诱导的糖尿病(DM)大鼠皮层神经元的作用及机制。方法将60只大鼠随机分假手术对照组、DM组和DM+3-AB组,每组20只。采用Morris水迷宫实验检测大鼠学习记忆能力,采用紫外分光光度计法测定皮层组织超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和丙二醛(MDA)含量,采用Western blot法检测皮层PARP1蛋白表达水平,采用免疫组化法检测皮层caspase-3表达变化。结果DM组大鼠学习记忆能力明显下降。DM组的SOD和GSH-Px含量显著低于对照组(P<0.01),MDA含量显著高于对照组(P<0.01),DM+3-AB组的SOD和GSH-Px含量明显高于DM组(P<0.05),MDA含量明显低于DM组(P<0.05)。DM组的PARP1表达显著增加(P<0.01),DM+ 3-AB组的PARP1表达显著降低(P<0.01)。DM组的caspase-3表达显著高于对照组(P<0.01),DM+3-AB组的caspase-3表达显著降低(P<0.01)。结论3-AB通过抑制PARP1,减轻DM导致的氧化应激,减少皮层神经元凋亡。
糖尿病;PARP;认知障碍;氧化应激
随着人们生活方式的改变和人口老龄化,糖尿病(diabetes mellitus,DM)发病率呈逐年上升趋势。DM并发中枢神经系统损害已经引起了人们的广泛关注[1,2]。早在1922年Miles等[3]就报道了DM相关认知障碍。Bestetti等[4,5]发现链脲佐菌素诱导的DM大鼠中枢神经系统内有显著的结构变化。Jakobsen等[6]发现链脲佐菌素诱导的DM大鼠有大量皮层神经元缺失。Li等[7]认为神经元凋亡与大鼠认知有关,2个月自发DM的BB/Wor大鼠无神经元凋亡,也不伴有认知障碍,而8个月的BB/Wor大鼠神经元凋亡增加,认知功能受损。DM导致神经元损伤的机制尚不明确,高血糖会导致活性氧簇(reactive oxy-gen species,ROS)过量产生,使多个组织发生氧化应激。最近有研究表明,氧化应激最终有可能是通过激活聚腺苷二磷酸核糖聚合酶1[poly(ADP-ribose)polymerase1,PARP1]而发挥作用[8]。
PARP是一种富含核染色质的多功能酶,分子量为113~116 kDa,它的作用是识别DNA的缺口后结合到DNA的受损处。在生理状态下PARP的活性很低,当细胞处于氧化应激状态时被过度活化,会耗竭细胞内能量,激活细胞死亡相关蛋白,最终导致细胞死亡[9]。PARP1是否参与DM大鼠皮层神经元凋亡鲜有报道。本研究中我们应用链脲佐菌素介导的DM大鼠模型,观察PARP抑制剂3-氨基苯甲酰(3-aminobenzamide,3-AB)对DM大鼠皮层神经元的影响。
1 材料与方法
1.1 材料
链脲佐菌素和3-AB(美国Sigma-Aldrich公司);超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和丙二醛(malondialdehyde,MDA)(南京建成生物工程研究所);PARP1多克隆抗体试剂盒、鼠抗caspase-3抗体、小鼠抗大鼠β-actin抗体、PARP1单克降抗体(美国Santa Cruz公司);SABC试剂盒、DAB显色剂、SP免疫组化试剂盒、DAB显色剂(北京中山公司)。
1.2 实验动物与方法
清洁级3月龄雄性SD大鼠60只,体质量200~250 g,由中国医科大学实验动物中心提供。大鼠随机分为假手术对照组、DM组和DM+3-AB组,每组20只。DM大鼠模型制备前大鼠禁食12 h,给予单次腹腔注射溶解于pH 4.0~4.2、浓度为0.1 mol/L柠檬酸钠缓冲液中的链脲佐菌素,剂量为55 mg/kg。对照组注入相同剂量的生理盐水。注射后所有大鼠放入代谢笼内常规饲养,自由饮食。大鼠血糖持续超过16.7 mmol/L、尿糖试纸(+++)的大鼠为DM大鼠。DM+3-AB组给予腹腔注射3-AB(20 mg·kg-1·d-1),持续3个月,对照组和DM组给予腹腔注射等量生理盐水。3个月后取材。
1.3 认知功能测定
采用Morris水迷宫实验检测大鼠的空间学习记忆能力。
1.3.1 定位航行实验:选择1个象限的固定位置将大鼠面向池壁放入水中,通过自动图像拍摄系统记录游泳轨迹,记录大鼠入水至找到平台的时间,即逃避潜伏期。120 s找不到平台,潜伏期记录为120 s。其总行程为游泳距离。实验2次/d,历时4 d,第5天测试。
1.3.2 空间探索实验:训练完毕次日进行空间探索实验,撤除平台,记录大鼠120 s内穿过原平台的次数,反映空间记忆能力。
1.4 皮层组织SOD、GSH-Px和MDA含量测定
每组各取5只大鼠,用10%水合氯醛麻醉后取脑,分离出大脑皮质,-80℃保存。SOD活力、MDA含量的测定均采用南京建成生物工程研究所提供的试剂盒,严格按照说明书操作,用紫外分光光度计法测定。
1.5 Western blot法检测各组脑组织PARP1蛋白表达水平的变化
每组各取5只大鼠,颈椎脱臼处死、断头、剥离并取出大脑皮质,称取各组标本100 g,剪碎加入冰预冷的细胞裂解液500 μL,超声粉碎。4℃、12 000 r/min离心0.5 h,取上清。采用酚试剂法测定蛋白浓度。进行SDS-聚丙烯酞胺凝胶电泳,转印,用含5%去脂奶粉的TTBS封闭4℃1 h。一抗(1∶500)4℃过夜。洗膜,并加入碱性磷酸酶标记的二抗(1∶1 000),室温下2 h。TTBS清洗2次,每次5 min;TBS洗1次,5 min。酶显法显色。使用ChemiImager 5500 V3.0软件进行图像灰度扫描,Fluor Chem 2.0分析软件进行分析,获取目的条带和内参照GADPH的整合光密度值,以两者的比值作为蛋白表达半定量指标。
1.6 免疫组化法检测caspase-3表达变化
每组各取5只大鼠麻醉,开胸,用生理盐水灌流后4%多聚甲醛灌注固定。取脑置于上述固定液中固定24 h,再将标本置于30%蔗糖中沉淀24 h。组织块在恒冷切片机上切片。免疫组化操作步骤按照说明书进行。
1.7 统计学分析
2 结果
2.1 大鼠学习记忆能力
DM组大鼠逃避潜伏期和空间探索时间较对照组显著延长(P<0.01),学习记忆能力明显受损。DM+3-AB组大鼠逃避潜伏期和空间探索时间显著缩短(P<0.01)。见表1。

表1 各组大鼠Morris水迷宫实验逃避潜伏期和空间探索时间的比较Tab.1 The escape latency and spatial probe test by Morris water maze test
2.2 各组大鼠皮质SOD、GSH-Px和MDA的含量
DM组的SOD和GSH-Px含量显著低于对照组(P<0.01);DM+3-AB组的SOD和GSH-Px含量明显低于对照组(P<0.05),明显高于DM组(P<0.05)。DM组的MDA含量显著高于对照组(P<0.01);DM+ 3-AB组的MDA含量明显高于对照组(P<0.05),明显低于DM组(P<0.05)。见表2。

表2 各组脑组织中SOD、GSH-Px、MDA、PARP1和caspase-3含量的变化Tab.2 Changes in expression of SOD,GSH-Px,MDA,PARP1 and caspase-3 in brain tissues in each group
2.3 各组大鼠PARP1蛋白的表达
与对照组相比,DM组的PARP1的表达水平明显升高(P<0.01)。与DM组相比,DM+3-AB组的PARP1的表达水平明显降低(P<0.01),见图2、表2。
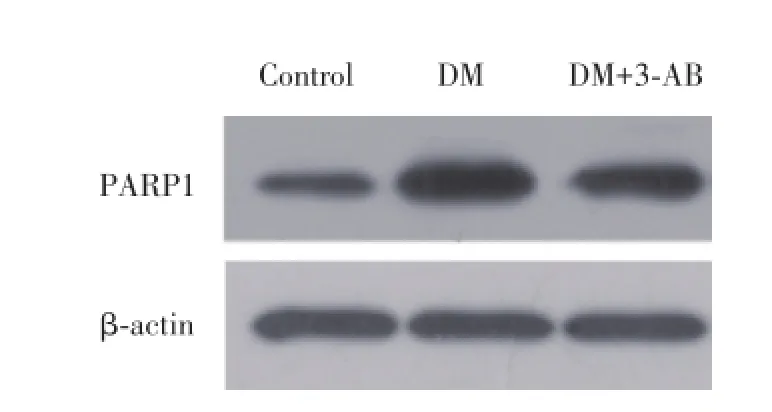
图2 各组大鼠皮层中PARP1的表达Fig.2 Expression of PARP1 in cortex in each group
2.4 各组大鼠皮层中caspase-3的表达
与对照组相比,DM组的caspase-3的表达水平明显升高(P<0.01)。与DM组相比,DM+3-AB组的caspase-3的表达水平明显降低(P<0.01),见图3、表2。
3 讨论
大量研究已发现DM相关的认知障碍问题,而且研究还发现DM患者存在一系列神经心理学改变。对于1型DM患者,最常见的是学习能力、记忆力、解决问题能力等功能受损[10]。已有报道在1型DM患者大脑皮层可见弥漫性或局灶性的退化性变,如神经元的丢失、脱髓鞘、神经胶质增生等[11,12]。影像学也证实了脑沟增宽、侧脑室扩大、脑白质疏松等变化[13]。

图3 各组大鼠皮层中caspase-3的表达 ×200Fig.3 Expression of caspase-3 in cortex in each group×200
尽管DM导致神经元变性死亡的发病机制尚不明确,氧化应激是重要机制。机体存在两类抗氧化系统,一类是非酶抗氧化系统,包括维生素C、维生素E、谷胱甘肽等;一类是酶抗氧化系统,包括SOD、过氧化氢酶、GSH-Px等。人体内氧化系统和抗氧化系统处于动态平衡状态。DM时升高的血糖导致线粒体产生大量ROS,ROS是一种强氧化剂,过量的ROS使氧化系统与抗氧化系统失衡,导致氧化应激。ROS能够触发DNA断裂,轻微的DNA损害激活PARP-1,这有利于DNA的修复及细胞的存活。但DM诱导的氧化应激使PARP过度活化,从而耗竭ATP,导致细胞功能异常,直至死亡[14]。研究已经证实,PARP抑制剂能在氧化应激的细胞中抑制或灭活PARP并能保存细胞中的NAD+及ATP。在这种情况下,细胞能保持正常的形态,保护细胞避免坏死。
本研究通过链脲佐菌素单次腹腔注射建立DM模型,结果显示:DM组的SOD和GSH-Px含量显著降低,MDA和PARP1的含量显著增加,表明DM大鼠脑内氧化应激反应明显增强,PARP1被激活。免疫组化显示皮层内caspase-3的表达增强,表明DM诱导皮层神经元的死亡增多。给予3-AB后PARP1明显减少,SOD和GSH-Px含量显著升高,而MDA含量降低,说明3-AB抑制PARP1的活性,明显抑制氧化应激反应。DM+3-AB组皮层内caspase-3的表达减少,表明3-AB减少DM诱导的神经元凋亡,保护皮层神经元。
综上所述,氧化应激和PARP-1的活化在DM皮层神经元损伤中发挥重要作用。PARP-1抑制剂通过抑制PARP的活性,减轻细胞的氧化应激损伤,保护皮层神经元,延缓病变的发展,可能是治疗DM新的途径。
[1]Biessels GJ,Kappelle AC,Bravenboer B,et al.Cerebral function in diabetes mellitus[J].Diabetologia,1994,37(7):643-650.
[2]McCall AL.The impact of diabetes on the CNS[J].Diabetes,1992,41(5):557-570.
[3]Miles WR,Root HF.Psychologic tests applied to diabetic patients[J].Arch Int Med,1922,30(6):767-777.
[4]Bestetti G,Rossi GL.Hypothalamic lesions in rats with long-term streptozotocin-induced diabetes mellitus.A semiquantitative lightand electron-microscopic study[J].Acta Neuropathol,1980,52(2):119-127.
[5]Bestetti G,Rossi GL.Hypothalamic changes in diabetic Chinese hamsters.A semiquantitative,light and electron microscopic study[J].Lab Invest,1982,47(6):516-522.
[6]Jakobsen J,Sidenius P,Gundersen HJ,et al.Quantitative changes of cerebral neocortical structure in insulintreated long-term streptozocin-induced diabetes in rats[J].Diabetes,1987,36(5):597-601.
[7]Li ZG,Zhang W,Grunberger G,et al.Hippocampal neuronal apoptosis in type 1 diabetes[J].Brain Res,2002,946(2):221-231.
[8]Brownlee M.Biochemistry and molecular cell biology of diabetic complications[J].Nature,200l,414(6865):813-820.
[9]D′Amours D,Desnoyers S,D′Silva I,et al.Poly(ADP-ribosyl)ation reactions in the regulation of nuclear functions[J].Biochem,1999,342(Pt2):249-268.
[10]Desrocher M,Rovet J.Neurocognitive correlates of type 1 diabetes mellitus in childhood[J].Child Neuropsychol,2004,10(1):36-52.
[11]Reske-Nielsen E,Lundbaek K.Diabetic encephalopathy.Diffuse and focal lesions of the brain in long-term diabetics[J].Acta Neurol Scand Suppl,l963,39(4):Suppl4:273-290.
[12]Northam EA,Rankins D,Cameron FJ.Therapy insight:the impact of type 1 diabetes on brain development and function[J].Nat Clin Pract Neurol,2006,2(2):78-86.
[13]Perros P,Deary IJ,Sellar RJ,et a1.Brain abnormalities demonstrated by magnetic resonance imaging in adult IDDM patients with and without a history of recurrent severe hypoglycemia[J].Diabetes Care,1997,20(6):1013-1018.
[14]Pacher P,Szabo C.Role of poly(ADP-ribose)polymerase l(PARP-1)in cardiovascular diseases:the therapeutic potential of PARP inhibitors[J].Cardiovasc Drug Rev,2007,25(3):235-260.
(编辑陈姜)
Protective Effect of PARP Inhibitor on Cortical Neurons in Streptozotocin-induced Diabetic Rats
WU Xiao-li,WANG Zhi-min,LIANG He-bin,HAO Ying,ZHENG Dong-ming,GUO Yang
(Department of Neurology,Shengjing Hospital,China Medical University,Shenyang 110021,China)
Objective To investigate the effect of PARP inhibitor 3-aminobenzamide(3-AB)on cortical neurons in streptozotocin-induced diabetes mellitus(DM)rats and the mechanism.M ethodsA total of 60 rats were divided into 3 groups randomly:sham-operated control group,DM group and DM+3-AB group,20 rats in each group.Morris maze was used to detect learning and memory abilities in each group.Spectrophotometer assay was used to detect the levels of superoxide dismutase(SOD),glutathione peroxidase(GSH-Px)and malondialdehyde(MDA)in cortex.Western blot was used to determine the expression of poly(ADP-ribose)polymerase 1(PARP1)in cortex.Immunohistochemical staining was used to determine the expression of caspase-3-immunoreactive neurons in cortex.ResultsDM rats showed significantly declined learning and memory abilities.Compared with the control group,the levels of SOD and GSH-Px were significantly reduced(P<0.01)and the level of MDA was significantly up-regulated(P<0.01)in the DM group.Compared with the DM group,the levels ofSOD and GSH-Px were significantly higher(P<0.05)and the level of MDA was significantly lower in the DM+3-AB group(P<0.05).The expression level of PARP1 was significantly up-regulated in the DM group and was significantly decreased in the DM+3-AB group(P<0.01).The level of caspase-3 was significantly higher in the DM group than in the control group(P<0.01),and was significantly decreased in the DM+3-AB group(P<0.01).Conclusion3-AB protected cortical neurons from apoptosis in DM rats by inhibition of PARP1 and alleviation of oxidative stress.
diabetes mellitus;poly(ADP-ribose)polymerase;cognitive impairment;oxidative stress
R743.32
A
0258-4646(2015)06-0481-04
国家自然科学基金(81000467)
吴晓黎(1973-),女,讲师,博士. E-mail:77kwuxiaoli@163.com
2015-01-07
网络出版时间:
