抑郁症Notch信号通路相关因子与去甲肾上腺素转运体的关系
2015-02-06雷蕾孙宁刘志芬杜巧荣杨春霞张克让
雷蕾孙宁刘志芬杜巧荣杨春霞张克让
·论 著·
抑郁症Notch信号通路相关因子与去甲肾上腺素转运体的关系
雷蕾*孙宁*刘志芬*杜巧荣*杨春霞*张克让*
目的探索去甲肾上腺素转运体(norepinephrine transporter,NET)调控Notch信号通路的相关因子在抑郁症患者及健康人群中的表达差异。方法对20例抑郁症患者和20名正常对照外周血提取DNA和RNA,通过实时荧光定量PCR(real-time PCR)检测Notch信号通路相关分子Notch1、RBP-jk、Numb、Hes1以及NET基因mRNA表达,通过PCR和质谱法检测NET基因分型。结果未在两组外周血中发现NET基因表达;抑郁症患者外周血Notch信号通路Notch1表达低于对照组(P=0.001),而抑制Notch通路活性的RBP-jk(P=0.005)、Numb(P=0.002)表达高于对照组。抑郁症患者NET基因rs2242446位点三种基因型间RBP-jk(P=0.005)、Numb(P= 0.003)的表达存在统计学差异,TC型患者的RBP-jk(P=0.008)、Numb(P=0.006)表达高于TT型;基因型间合并后发现,携带有rs2242446位点C等位基因患者(CC+TC型)RBP-jk(P=0.001)、Numb(P=0.001)的表达高于TT型。rs28386840位点T等位基因患者(AT+TT型)的Hes1表达低于AA型(P=0.028)。结论初步探索发现抑郁症可能存在外周血Notch信号通路相关因子表达调控异常,推测NET基因可能调控Notch信号通路进而影响抑郁症的发生。
抑郁症Notch信号通路去甲肾上腺素转运体神经可塑性
目前认为抑郁症患者存在神经可塑性障碍,抗抑郁药通过细胞内信号转导通路调节神经可塑性而发挥作用,而Notch信号通路是调节大脑神经可塑性的一条重要途径[1]。去甲肾上腺素转运体(norepinephrine transporter,NET)可改变突触间隙去甲肾上腺素(norepinephrine,NE)浓度,NET能抗抑郁药物可促进海马神经细胞增殖、再生,降低海马脑源性神经营养因子(brain-derived neurotroph⁃ic factor,BDNF)表达水平,进而影响大脑神经可塑性[2-3]。Hu等[4]研究发现NET基因缺陷小鼠Numb(Notch通路的抑制调节因子)表达升高,Notch信号通路活性减弱。以上研究提示NET基因缺陷可能影响Notch信号通路。本研究拟通过检测抑郁症患者与正常对照外周血NET基因分型以及NET、Notch信号通路相关因子mRNA表达水平,初步探索抑郁症外周血Notch信号通路表达水平以及NET基因对Notch信号通路的调控作用。
1 对象与方法
1.1 研究对象选择2014年4~6月于山西医科大学第一医院精神卫生科门诊就诊的抑郁症患者。纳入标准:①18~50岁,汉族;②首次发病,未经任何治疗;③符合《美国精神障碍诊断与统计手册第四版》(Diagnostic and Statistical Manual of Mental Disorders,Fourth Edition,DSM-Ⅳ)中重性抑郁障碍诊断标准,使用标准化的DSM-IV-TR轴I障碍定式临床检查(structured clinical interview for DSM-IV-TR axis I disorders,SCID-I)作筛查工具;④汉密尔顿抑郁量表17项版本(Hamilton depres⁃sion scale,HAMD-17)评分≥17分;⑤相互间无血
缘关系。排除标准:①患有重大躯体疾病或有颅脑外伤史;②患有其它神经精神系统疾病;③最近6个月内接受过抗抑郁、抗精神病药物治疗或电休克治疗;④妊娠或哺乳期女性。
选择同期来源于社区的健康志愿者作为正常对照。纳入标准:①18~50岁,汉族;②无神经精神疾病;③两系三代无精神疾病家族史;④相互间及与患者间无血缘关系。排除标准:①患有重大躯体疾病或有颅脑外伤史;②妊娠或哺乳期女性。
共收集抑郁症患者20例,其中男性9例,女性11例,平均年龄(27.77±8.31)岁。收集对照20名,男性10名,女性10名,平均年龄(29.13±6.56)岁。抑郁组与对照组间性别(χ2=0.100,P=0.752)、年龄(t=0.574,P=0.569)无统计学差异。所有被试对本研究同意并签署知情同意书。本研究方案经过山西医科大学第一医院伦理委员会审查通过。
1.2 DNA提取与基因型检测
1.2.1 DNA提取 研究对象于抽血当天晨起空腹,常规消毒,抽取静脉血4 mL。其中2 mL置于-20℃低温冰箱保存,随后使用FlexGen Blood DNA Kit试剂盒提取DNA,4℃低温保存。
1.2.2 筛选SNP参考Hapmap数据库的中国汉族人群(Chinese Han in Beijing,China,CHB)数据,结合既往研究,选择可能与抑郁症病理机制相关的NET基因3个功能区SNP:rs2242446(T-182C)、rs5569(G1287A)和rs28386840(A-3081T)[5-6]。
1.2.3 基因分型 使用MassARRAY™MALDI-TOF MS质谱检测平台[7-8]对样本DNA检测NET基因3个SNP位点(基因科技上海有限公司),使用TYP⁃ER 4.0软件(Sequenom公司,USA)分析质谱数据以进行SNP等位基因分型。SNP引物见表1。
1.3 mRNA提取及检测
1.3.1 淋巴细胞液提取 取新鲜全血2 mL,加1 mL 3%柠檬酸钠,混匀后3000 r/min离心10 min(4℃),取浅黄色中层,即为淋巴细胞液。
1.3.2 RNA提取 取淋巴细胞液150 μL加入离心管(经DEPC水处理),加入1 mL TRIZOL试剂,振荡混匀,冰浴中放置5 min。按TRIZOL提取方法操作:加入350 μL氯仿,充分振荡混匀,静置分层后,立即于12000 r/min离心20 min(4℃);将上清转移至另一离心管,加等体积的异丙醇(4℃预冷)混匀;-20℃放置1 h,12000 r/min离心20 min(4℃),沉淀即获得总RNA;加入0.5 mL 75%乙醇洗涤,12000 r/min离心10 min(4℃),小心倒掉乙醇,室温放置10 min,加30 μL适量DEPC处理水溶解沉淀,-80℃低温保存。
取5 μL RNA,经紫外分光光度计测定A260和A280值,并经1.5%琼脂糖凝胶电泳分析RNA的完整性。选择A260/A280比值在1.8~2.1的RNA样品,进行后续的实时荧光定量PCR(real-time PCR)。
1.4 Real-time PCR检测mRNA表达使用引物设计软件Primer Premier 5.00分别设计NET、Notch1、RBP-jk、Numb、Hes1的mRNA引物,使用Oligo 6.69软件验证,并在美国国立生物技术信息中心(NCBI)的基因库中比对后得出可行性序列。所有引物序列均由上海生物工程公司合成,见表2。
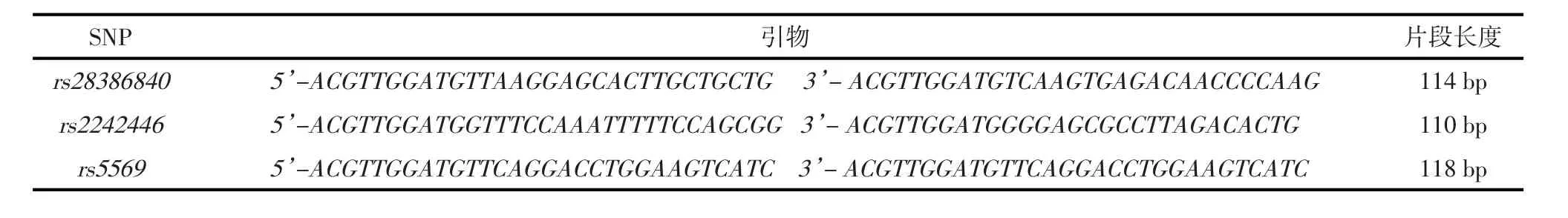
表1 SNP引物
先使用DNase I消化样品RNA中的DNA;后将RNA逆转录为cDNA;将cDNA稀释10倍后,使用7900HT Real-time PCR仪(Applied Biosystems,USA)进行PCR反应(每个样品作3管)。反应体系:SYBR Mix 10 μL,上下游引物(见表1)各0.4 μL,cDNA 1 μL加DEPC水补足体积至20 μL。反应条件:50°C 2 min,95°C 2min;然后95°C变性15 s,60°C退火60 s,共40个循环。所有SYBR Master Mix购于TOYOBO,引物由Invitrogen合成。检测
Ct值后,使用GAPDH作为内参,经2-ΔΔCt转换后得到各mRNA相对含量。
1.5 统计学方法使用SPSS 17.0进行统计分析。抑郁组和对照组外周血Notch信号通路相关因子(Notch1、RBP-jk、Numb、Hes1)mRNA表达水平呈非正态分布,采用中位数(下四分位数,上四分位数)[M(QL,QU)]描述,组间比较采用Mann-Whit⁃ney U检验。抑郁组分别按NET基因各SNP位点的基因型分亚组,采用Kruskal-Wallis检验比较三个亚组之间mRNA的表达水平,进一步两两多重比较采用Nemenyi法。考虑到部分纯合子基因型较为罕见,将样本量少的纯合子与杂合子基因型合并,比较mRNA表达水平。检验水准α为0.05,双侧检验。
2 结果
2.1 抑郁组与对照组NET基因及Notch信号通路相关基因mRNA表达水平在20例抑郁症患者和20例对照外周血中,未检测到NET基因的表达。抑郁组和对照组外周血中Notch信号通路Notch1、RBP-jk、Numb、Hes1的mRNA表达情况见表3。抑郁组Notch1表达低于对照组(Z=-3.256,P=0.001),RBP-jk(Z=-2.800,P=0.005)、Numb(Z=-3.132,P= 0.002)表达高于对照组,未发现抑郁组与对照组间Hesl的mRNA表达有统计学差异(P>0.05)。
2.2 NET基因不同分型抑郁症患者Notch信号通路相关基因mRNA表达水平NET基因rs2242446位点不同基因型抑郁症患者RBP-jk(χ2=10.640,P=0.005)、Numb(χ2=11.375,P=0.003)mRNA的表达水平具有统计学差异,进一步经Nemenyi秩和检验发现,TC基因型患者的RBP-jk(P=0.008)、Numb(P=0.006)mRNA表达高于TT型患者;未发现NET基因型间其他各mRNA表达水平存在统计学差异(P>0.05),见表4。
基因型合并后,携带rs2242446位点C等位基因(TC+CC型)的抑郁症患者RBP-jk(Z=-3.240,P=0.001)、Numb(Z=-3.240,P=0.001)mRNA的表达水平高于TT型患者。携带rs28386840位点T等位基因(AT+TT型)的抑郁症患者Hes1(Z=-2.199,P=0.028)表达低于AA型患者。未发现rs5569各基因型间Notch通路相关基因表达存在差异(P>0.05),见表4。
3 讨论

表2 Real-time PCR引物

表3 抑郁组和对照组外周血中Notch信号通路基因mRNA表达水平[M(QL,QU)]
随着近些年抑郁症神经可塑性假说的不断发展,学者们开始思考并关注神经元再生领域的相关研究。研究发现,抑郁症患者存在海马体积缩小,伴神经细胞萎缩和缺失[9-10],抗抑郁药治疗可阻止抑郁症患者海马体积减小,并部分逆转实验动物因应激诱导而产生的海马萎缩[11]。
Notch信号通路调节神经干细胞的增殖、神经细胞轴突和树突的生长,对中枢神经系统再生有重要作用,是调节大脑神经可塑性的一条重要途径。Notch信号通路由Notch受体、配体及下游的效应物三部分组成。哺乳动物中有4个同源
Notch受体(Notch1~4)和5个同源配体(Dll1、Dll3、Dll4、Jag1和Jag2)。转录抑制因子RBP-jk可与Notch的活化形式NICD结合形成NICD-CSL复合体后进而激活靶基因的表达。Numb被认为是细胞不对称分裂的一个关键调节点,含Numb的细胞Notch活性受抑制,不含则Notch通路活化。Notch的下游主要靶基因为E(spl)/Hes或ESR基因家族,如Hesl、Hes5等,Notch系统可直接促进这类分子的表达,最终影响细胞的增殖、分化和凋亡。研究显示,Notch信号通路在成年动物海马区持续表达,且发挥促进神经重塑的作用。
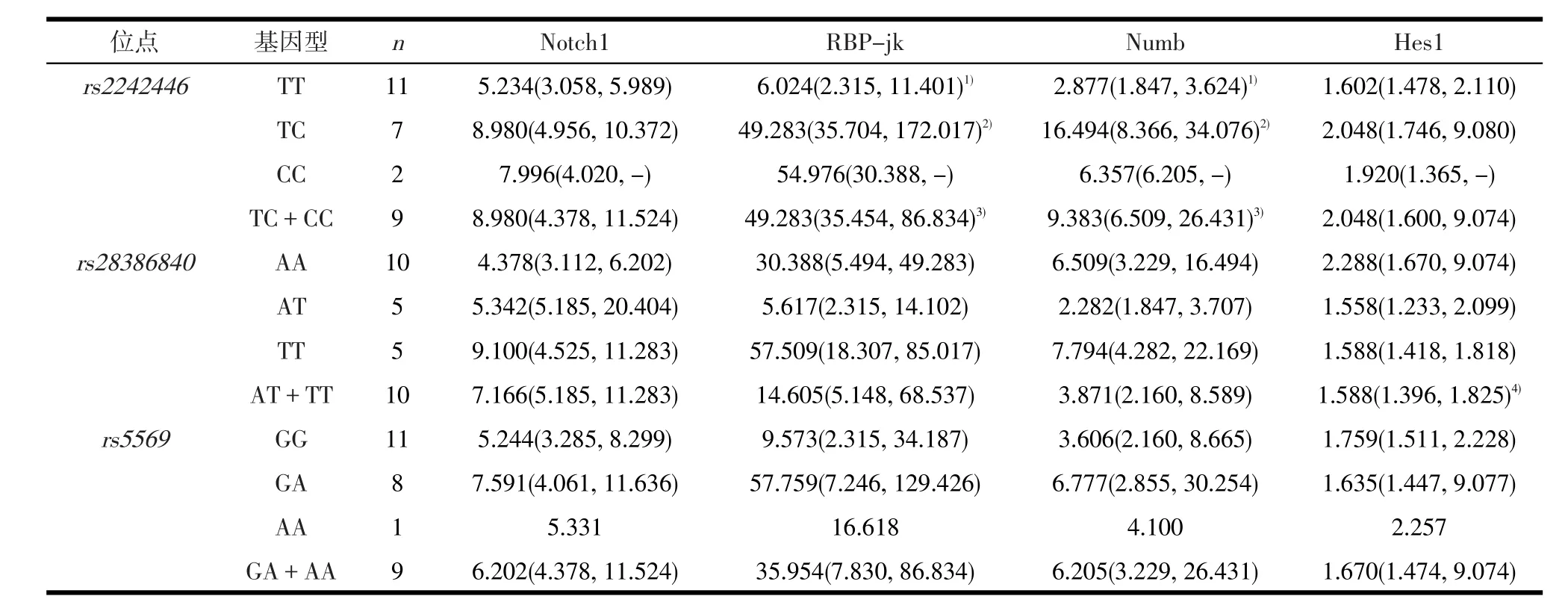
表4 NET基因不同分型患者Notch信号通路基因mRNA表达水平[M(QL,QU)]
本研究首次在抑郁症患者外周血白细胞中发现Notch信号通路中Notch1基因的mRNA表达低于正常对照,而抑制Notch通路活性的RBP-jk、Numb的mRNA表达高于正常对照。关于Notch通路与抑郁症的相关性之前在动物实验中已有报道:Costa等[12]发现Notch基因缺陷型小鼠表现出空间学习记忆能力障碍;郭怡菁等[13]在缺血卒中大鼠模型中发现慢性应激后大鼠海马神经细胞呈现凋亡及Notch通路活性下降;隋毓秀等[14-15]研究也发现抑郁模型大鼠海马Notch信号通路的功能呈下调趋势,与齿状回神经干细胞增殖抑制同步,给予抗抑郁药氟西汀干预后,大鼠海马齿状回NSCs增殖显著增加,同时Notch信号通路相关mRNA表达及蛋白水平显著升高。以上研究均提示Notch信号通路调节神经可塑性与抑郁症的发生有关。
NET再摄取抑制剂是临床常见的抗抑郁药,可促进海马神经细胞增殖、再生,进而影响大脑神经可塑性。Hu等[4]研究发现NET基因缺陷小鼠Numb表达增高,Notch信号通路活性减弱。据此推测,NET可能通过影响Notch信号通路,调控大脑神经可塑性变化,进而参与抑郁症的发生。目前所报道的检测NET基因表达研究,实验材料大多来自于组织细胞,如胎盘、肿瘤、动物大脑等[16-17]。然而本研究在外周血白细胞中未能检测出NET基因的表达,可能原因与大部分NET都是在神经或其它组织细胞膜表面重吸收有关,所以在外周NET表达少,提示NET基因可能主要在中枢神经系统表达[18]。
因此,为了进一步明确NET基因与Notch信号通路的关联性,我们对NET基因进行基因分型。结果发现携带有NET基因rs2242446位点TC基因型患者的RBP-jk、Numb表达高于TT型患者,未发现其他NET基因型间Notch表达存在差异。由于部分纯合子样本例数偏少,为进一步探索等位基因间Notch表达差异,将rs2242446位点含C等位
基因的TC、CC基因型患者合并,rs28386840位点含T等位基因的AT、TT基因型患者合并,rs5569位点含A等位基因的GA、AA基因型合并。发现携带有rs2242446位点C等位基因(TC+CC型)的抑郁症患者RBP-jk、Numb的表达高于TT组患者,携带rs28386840位点T等位基因(AT+TT型)的抑郁症患者Hes1表达低于AA组患者。rs2242446和rs28386840基因多态性均位于NET基因启动子区,其基因突变可能会影响NET基因启动子的转录活性[19],导致NET基因表达改变。既往研究表明,去甲肾上腺素转运蛋白可能通过改变细胞内的水平,进而影响功能变化[20]。因此,以上结果提示NET基因变异可能引起RBP-jk、Numb的增加,最终抑制Notch信号通路活性,NET基因在Notch信号通路的表达中起一定调控作用。
综上,本研究初步探讨在患者外周血中Notch信号通路相关因子与抑郁症的关系,发现NET的不同基因型间可能存在Notch信号通路表达差异,推测NET可能调控Notch进而影响抑郁症的发生。但本研究存在一定的局限性:首先研究样本量偏小,且可能存在地区差异等,未来还需进一步扩大样本量来验证;其次,本研究仅检测Notch相关mRNA的表达水平,尚未检测相关因子蛋白表达水平,也有待进一步补充实验完善结论;此外,NET基因与Notch信号通路以及抑郁症的关联性还需进一步在功能学上进行验证。未来的研究需要通过建立抑郁动物模型,比较不同组间Notch信号通路相关因子的mRNA/蛋白表达水平以及相关脑区结构和功能上的差异,来进一步明确NET基因调控Notch信号通路介导的神经可塑性与抑郁发生的关联性。
[1]李元,戴志萍,隋毓秀.抑郁状态下大鼠海马Notch1信号系统的改变[J].中国神经精神疾病杂志,2011,37(11):641-645.
[2]Spasojevic N,Stanisavljevic D,Gavrilovic L,et al.Hippocampal asymmetry in expression of catecholamine synthesizing enzyme and transporters in socially isolated rats[J].Neuro Endocrinol Lett,2012,33(6):631-635.
[3]Chen P,Fan Y,Li Y,et al.Chronic social defeat up-regulates expression of norepinephrine transporter in rat brains[J].Neuro⁃chem Int,2012,60(1):9-20.
[4]Hu YF,Caron MG,Sieber-Blum M.Norepinephrine trans⁃port-mediated gene expression in noradrenergic neurogenesis [J].BMC Genomics,2009,10:151.
[5]孙宁,徐勇,孙俊伟,等.去甲肾上腺素转运体基因与中国汉族人群重性抑郁症关联分析[J].中国神经精神疾病杂志,2007,33(7):416-419.
[6]王建国,孙宁,孙燕,等.在控制生活事件与人格因素条件下探讨NET基因G1287A多态性和重型抑郁症关联性[J].中国药物与临床,2012,12(5):549-551.
[7]Liu H,Han D,Wong S,et al.rs929387 of GLI3 is involved in tooth agenesis in Chinese Han population[J].PLoS One,2013,8 (11):e80860.
[8]Sharma V,Michel S,Gaertner V,et al.A role of FCER1A and FCER2 polymorphisms in IgE regulation[J].Allergy,2014,69 (2):231-236.
[9]Ahdidan J,Hviid LB,Chakravarty MM,et al.Longitudinal MR study of brain structure and hippocampus volume in major de⁃pressive disorder[J].Acta PsychiatrScand,2011,123(3): 211-219.
[10]Wainwright SR,Galea LA.The neural plasticity theory of de⁃pression:assessing the roles ofadultneurogenesis and PSA-NCAM within the hippocampus[J].Neural Plast,2013, 2013:805497.
[11]Masi G,Brovedani P.The hippocampus,neurotrophic factors and depression:possible implications for the pharmacotherapy of depression[J].CNS Drugs,2011,25(11):913-931.
[12]Costa RM,Honjo T,Silva AJ.Learning and memory deficits in Notch mutant mice[J].Curr Biol,2003,13(15):1348-1354.
[13]郭怡菁,张志珺,王少华,等.缺血性卒中大鼠海马的Notch信号通路功能的动态变化[J].中国神经精神疾病杂志, 2009,35(6):346-349.
[14]隋毓秀,张志珺,郭怡菁,等.Notch1信号系统在氟西汀上调大鼠海马神经再生中的作用[J].中国神经精神疾病杂志,2011,37(5):285-289.
[15]隋毓秀,张志珺,郭怡菁,等.Notch1信号系统与抑郁模型大鼠海马神经重塑障碍[J].中华精神科杂志,2011,44(3): 163-168.
[16]Na KH,Choi JH,Kim CH,et al.Altered expression of norepi⁃nephrine transporter and norepinephrine in human placenta cause pre-eclampsia through regulated trophoblast invasion[J]. Clin Exp Reprod Med,2013,40(1):12-22.
[17]Chen P,Fan Y,Li Y,et al.Chronic social defeat up-regulates
expression of norepinephrine transporter in rat brains[J].Neuro⁃chem Int,2012,60(1):9-20.
[18]Bonisch H,Bruss M.The norepinephrine transporter in physiol⁃ogy and disease[J].Handb Exp Pharmacol,2006,(175): 485-524.
[19]Zill P,Engel R,Baghai TC,et al.Identification of a naturally oc⁃curring polymorphism in the promoter region of the norepineph⁃rine transporter and analysis in major depression[J].Neuropsy⁃ chopharmacology,2002,26(4):489-493.
[20]Mata S,Urbina M,Manzano E,et al.Noradrenaline transporter and its turnover rate are decreased in blood lymphocytes of pa⁃tients with major depression[J].J Neuroimmunol,2005,170 (1-2):134-140.
R749.4
A
2014-10-27)
(责任编辑:肖雅妮)
10.3936/j.issn.1002-0152.2015.03.010
☆ 国家自然科学基金面上项目(编号:81171290,81471379);山西省高等学校科技创新项目(编号:2013119)
* 山西医科大学第一医院精神卫生科(太原 030001)
