血管性痴呆嗅觉功能损害的功能MRI研究
2014-12-13纪东旭赵博峰宋扬倪红艳尹建忠
纪东旭,赵博峰,宋扬,倪红艳,尹建忠*
1.天津医科大学一中心临床学院 天津市第一中心医院放射科,天津市影像医学研究所,天津 300192
2.天津医科大学一中心临床学院 天津市第一中心医院神经内科,天津300192
随着生活和医疗水平的提高,我国人口平均寿命不断延长,人口老龄化日益加重,老年期疾病发病率不断提高。而且老年痴呆也逐渐被大众所认识,老年痴呆主要包括阿尔茨海默病(Alzheimer’s disease,AD)、血管性痴呆(vascular dementia,VaD)和混合型痴呆三大类。其中阿尔茨海默病约占50%,VaD约占20%,另外约有20%的老年痴呆患者同时存在AD和VaD两种病理改变,即混合型痴呆,余下的10%痴呆患者主要是由其他原因所致,如帕金森、路易小体痴呆等[1-2]。随着脑血管病发病率的不断增加和医疗水平的发展,脑血管病患者大部分能度过急性期得以存活,但遗留肢体和认知功能损害症状,VaD也就越来越成为影响患者后期生活质量的重要因素。
多种神经退行性疾病,包括AD、特发性帕金森和路易小体性痴呆等均可表现出嗅觉障碍,嗅觉过程中涉及到嗅觉系统的外周和中枢结构两部分。嗅觉阈值很可能是由嗅觉系统的外周结构支配,而嗅觉识别是由嗅觉中枢结构处理的,认为是一定程度的认知任务[3]。除嗅觉高级中枢之外,嗅觉的传入纤维经嗅球、嗅束至嗅觉的初级中枢即初级嗅觉皮层(primary olfactory cortex,POC),某些病理改变累及该区的神经元,将导致该区的神经元退行性变及数量减少,以致该区的神经元代谢水平降低,临床即可出现嗅觉功能障碍。最近,关于POC区的功能的fMRI逐渐成为研究的热点,Wang等[4]和Li等[5]应用fMRI研究AD患者的POC区的功能,进而评价AD患者的嗅觉功能。而且fMRI已经逐渐成为一种具有较高空间时间分辨率的非创伤性神经影像检查手段,来检测脑神经元的功能。所以嗅觉MRI可以根据血氧浓度水平(blood oxygen level dependent,BOLD)原理检测嗅觉相关脑区的神经细胞活动水平,进而评价受试者的嗅觉功能,从而反映嗅觉相关脑区神经元的病理改变。
笔者也将POC区作为感兴趣区(ROI),联合全脑区的嗅觉激活一起评价VaD患者的嗅觉功能情况,为下一步进行具有嗅觉功能损害疾病的研究提供参考。
1 材料与方法
1.1 受试对象
2012年8月至2013年10月,选择于天津市第一中心医院就诊的12例VaD患者(VaD组),同期招募15名健康同龄正常老年人(NC组)。所有受试者均接受MMSE (Mini-Mental Status Examination)[6]、MoCA (Montreal Cognitive Assessment)[7]和CDR(Clinical Dementia Rating Scale)[8]量表的标准化神经心理学测试和相关病史采集,VaD组患者由高年资神经内科医师进行诊断,符合美国国立神经科障碍及卒中研究所与国际神经科学学会(NINDS-AIREN)工作小组制定的VaD诊断标准,Hachinski缺血指数在7分以上。
受试者均排除脑外伤、鼻窦炎活动期与呼吸道阻塞及精神分裂、抑郁症等影响神经心理和嗅觉的疾病,以及吸烟者、有精神药物服用史者。本研究经医院伦理委员会批准,所有受试者或是法定监护人均签署知情同意书。
1.2 成像参数
采用Siemens 3.0 T MR扫描仪和32通道头线圈,采集图像序列如下:常规头横断面T2WI:TR 6000 ms,TE 93 ms,FOV 230 mm×230 mm,矩阵256×256,层厚5 mm,层距 0.75 mm 层数20;薄层矢状面T1WI结构像,TR 1900 ms,TE 2.5 ms,FOV 250 mm×250 mm,反转角30°,矩阵256×256,层厚1.0 mm,无间隔扫描,层数176层;嗅觉BOLD像,TR 3000 ms,TE 30 ms,FOV 230 mm×230 mm,反转角90°,层厚 5.0 mm,层距 0.75 mm,矩阵80×80,层数20,共250帧图像,FLAIR:TR 9290 ms,TE 93 ms,TI 2500 ms,FOV 220 mm×220 mm,反转角30°,矩阵256×256,层数25,层厚4.0 mm。
1.3 嗅觉fMRI实验设计
此项研究采用薰衣草作为嗅觉刺激剂,分别被稀释成三种浓度(0.10%、0.33%和1.00%)。稀释过的薰衣草通过特制的嗅觉刺激器聚乙烯管给予,将其放置在受试者鼻子的前方约1 cm处,流速维持在8 L/min。采用较短的刺激持续时间和较长的刺激间隔时间:首先给予42 s的洁净空气气流作为刺激间隔,然后给与6 s的含有薰衣草气味的嗅觉刺激,以此循环,重复15次,每种浓度连续刺激5次,按由低到高的顺序依次分为三组进行刺激,总的刺激时间为90 s。
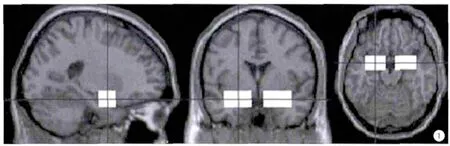
图1 初级嗅觉皮层的范围,MNI坐标:左侧24±17、0±11、-17±10;右侧-24±17、0±11、-17±10。Fig.1 The range of the primary olfactory cortex, MNI: left 24±17, 0±11,-17±10; right -24±17,0±11,-17±10.
1.4 数据处理与分析
首先在全脑水平观察NC组和VaD组两样本间激活差异。然后选择双侧初级嗅觉皮层(primary olfactory cortex,POC)作为ROI,观察NC与VaD两组的POC区的嗅觉激活差异。POC区由神经内科医师、放射科医师和神经解剖学专家共同制定(图1),包括嗅核、梨状皮层、嗅结节、杏仁核、杏仁核周围皮层及内嗅皮层[9]。
采用Matlab 7.11.0版本及SPM 8软件进行图像分析,先进行BOLD图像的头动校正、图像对齐、空间标准化和高斯平滑的预处理;对预处理后的BOLD图像建立激活模型,将NC组和VaD组两样本全脑区全部浓度的激活进行独立样本t检验组分析。其次将两组POC区全部浓度的激活进行独立样本t检验组分析。
1.5 统计学分析
采用SPSS 19.0 软件,采用独立样本t检验对两组受试者的基本资料、神经心理学评分以及POC区的全部浓度的激活体素数进行分析,P<0.05为差异有统计学意义。
2 结果
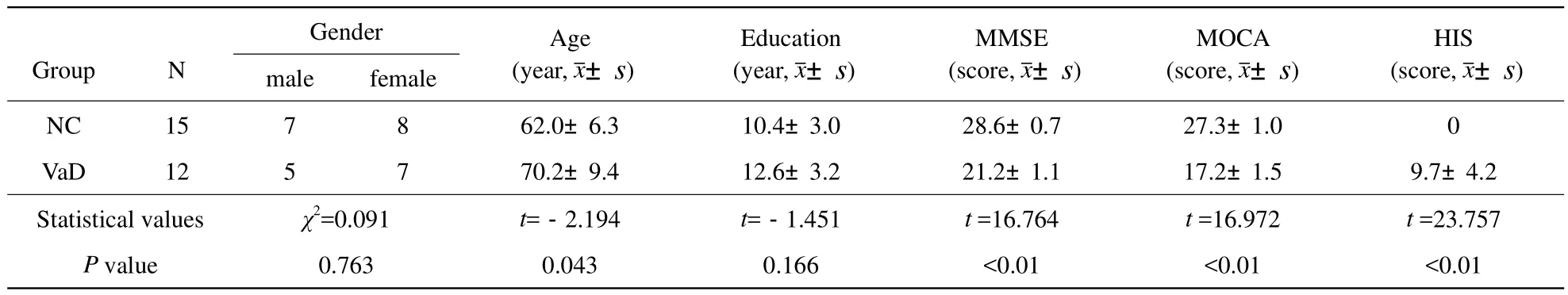
表1 两组受试者的基本信息和认知评分情况Tab.1 Demographic information and neurocognitive tests results of two groups
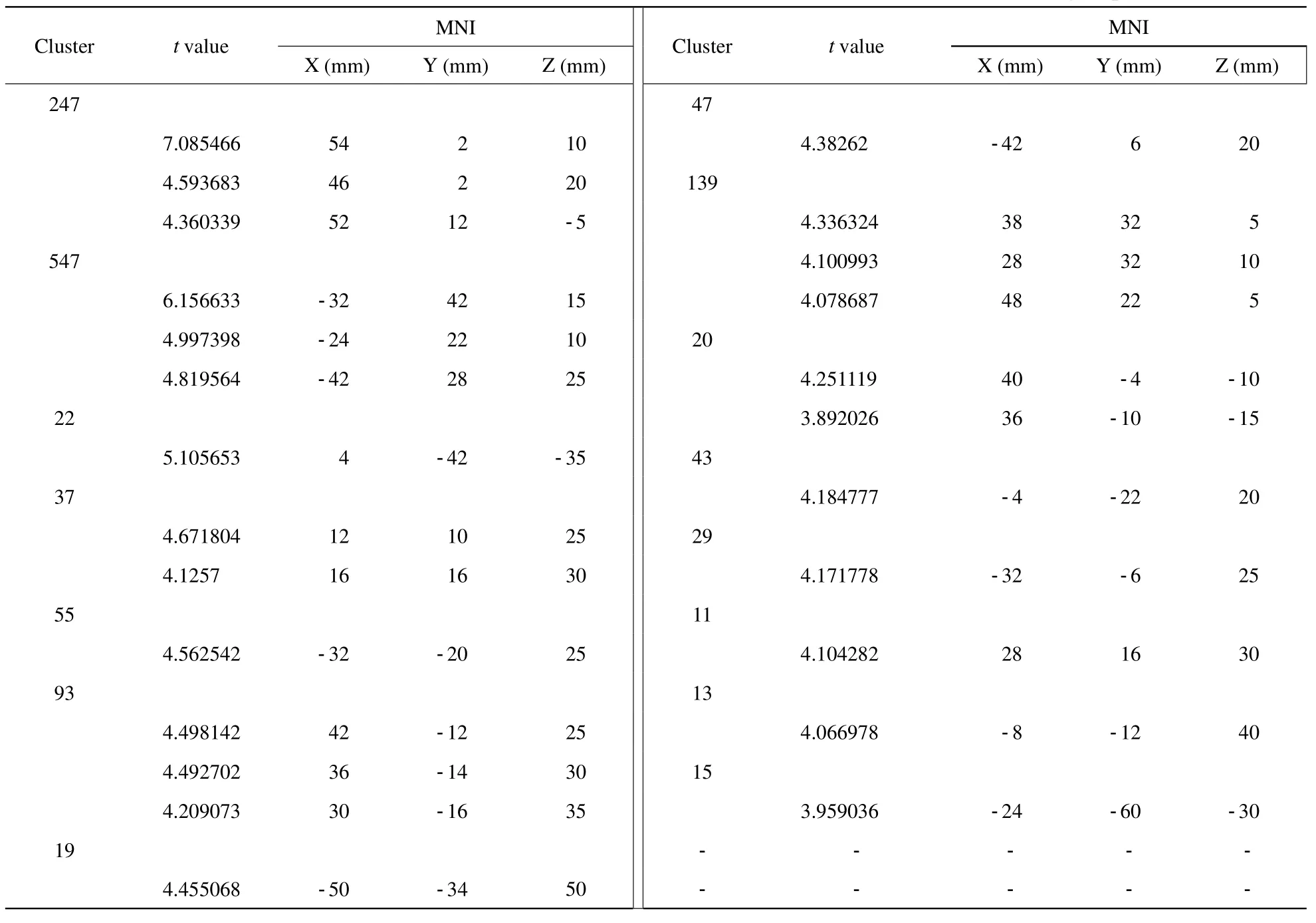
表2 NC与VaD两组间的全脑激活体素差异Tab.2 The difference of activated voxels in the whole brain between the NC and VaD groups

图2 NC组与VaD组的激活差异图(两组样本t检验)Fig.2 The fMRI activation differences maps between NC and VaD groups (two-sample t test).
2.1 受试者基本情况
NC和VaD两组受试者在性别、教育年限均没有统计学差异,P值分别为0.763,0.166。两组之间的神经心理学量表MSSE和MOCA得分,NC组的得分明显高于VaD组,P值均<0.01,差异具有统计学意义,如表1所示。
2.2 VaD和NC组的总体嗅觉fMRI差异
NC组和VaD组两样本全部浓度相减(NC-VaD时作为正性激活,VaD-NC时作为负性激活)的独立样本t检验组分析,选择全脑作为ROI,观察NC组与VaD组的激活区域差异,结果显示NC组的全脑有28簇激活体素,共计1486个体素,而VaD组的全脑有13簇激活体素,共计149个体素,明显低于NC组,NC组多于VaD组即属于正性激活,这些区域主要位于额叶皮层下的白质、额下回、中央前回、中央后回、扣带回以及颞叶前部,例如岛叶、颞上回等结构,如图2及表2所示;而负性激活为0。
2.3 VaD和NC组的POC区激活差异
将POC区的激活体素数分别进行分析,进行独立样本t检验组分析,NC组的POC区0.10%~1.00%整体浓度激活的体素数与VaD组的差异具有统计学意义(t=3.231,P<0.01;表3),结果显示VaD组的整体激活程度明显低于NC组,提示VaD组也存在嗅觉功能损害(图3;表3)。
3 讨论
本组结果显示,VaD患者的全脑激活体素数较NC明显减低,VaD患者的激活减低区主要位于额叶皮层下的白质、额中回、额下回以及颞上回、岛叶、边缘叶的扣带回等结构。这些区域主要是VaD患者的梗死灶、脑白质稀疏病灶,然而人类嗅觉系统的高级中枢主要位于眶额回、内侧颞叶前部。因此,病变只要累及额叶及颞叶前部时就会表现出嗅觉识别障碍[10]。血管性病理改变累及这些部位,导致嗅觉识别功能减低甚至消失[3]。另外,VaD患者的额叶中央前回的白质、顶叶中央后回的灰质激活减低较明显,这可能与VaD患者的躯体感觉、认知障碍有关,以致嗅觉产生的躯体感觉及相关认知的激活减低。而且NC的嗅觉阈值高于年轻人,嗅觉敏感性也降低[11-12],而VaD老年患者的老龄化进一步加重,VaD患者的嗅觉阈值会更高,所以激活会低于NC。

图3 NC与VaD组的POC区激活差异Fig.3 The activation differences in the POC between the NC and VaD groups.
除此之外,以POC区作为ROI,因为POC区是初级嗅觉中枢,是不经过丘脑直接接受来自嗅球所传导的嗅觉刺激的皮层结构,嗅觉纤维在此交换神经元后向更高级嗅觉中枢投射,与正常嗅觉功能有密切的关系,是嗅觉编码的特异性区域[13-15],也是AD病理改变早期累及的脑区[16],对于同一种气味连续刺激时会产生嗅觉适应[17-18];因此,笔者为了避免嗅觉适应效应的产生,选择同一种香剂的三种不同浓度由低到高依次刺激嗅觉。结果显示,NC组的POC区激活体素明显多于VaD组,可能是由于血管性病变累及了POC区,致使这部分神经元代谢减低、甚至消失,嗅觉功能受损。另外,嗅觉中枢系统存在广泛的神经纤维联系,嗅觉从位于鼻腔黏膜的内嗅细胞的一级神经元开始发出嗅丝,穿过筛孔止于嗅球,嗅球内的第二级神经元发出纤维组成嗅束,嗅觉的传入神经纤维经嗅球、嗅束至初级嗅觉皮层(POC),可以广泛地向海马回钩及其附近皮质、丘脑背内侧核投射,并且通过边缘系统和丘脑背内侧核投射至眶额回等高级嗅觉中枢。而且,嗅觉中枢除了接受嗅觉的传入神经纤维以外,实际上还与很多其他脑功能区,包括海马、丘脑、扣带回、岛叶等存在着广泛的内在联系,从而参与中枢神经系统的多种功能。因此,当血管性病理改变累及以上这些结构时,均可导致其与POC区的功能连接的减少、初级嗅觉皮层神经元的功能减弱或丧失,最终出现嗅觉功能障碍,所以VaD患者的POC区嗅觉激活体素数低于NC,表现出嗅觉障碍。

表3 NC和VaD组的POC区激活体素差异Tab.3 The activated voxels difference in POC between the NC and VaD groups
VaD主要是由“动脉硬化性痴呆”一词发展而来,是由脑血管病,如脑梗死、脑出血及皮层下白质缺血性改变等引起痴呆表现的临床综合征。VaD的神经病理改变主要包括缺血性和出血性脑损害所致痴呆和低血氧-低灌流性痴呆。而临床上以多发性脑梗死性痴呆(multiple infarct dementia,MID)多见,流行病学调查显示多于1/3的中风患者会发展为痴呆。脑白质稀疏和腔隙性脑梗死是微循环缺血性疾病,而且随着年龄或是其他危险因素(高血压、糖尿病以及基因因素等)的增长而逐渐加重[19-21],血管性损害患者的各项机能及生活质量较正常老年人均明显下降,例如轻度血管性认知障碍(mild vascular cognitive impairment, MVCI)患者的计算能力较正常老年人明显下降,且相关脑区的fMRI激活明显减低[22-23]。脑白质稀疏强烈提示缺血及VaD,且脑白质稀疏、动脉粥样硬化及隐匿性腔隙性脑梗死(silent lacunar infarcts,SLI)均与患者的认知下降有着密切的关系[24-26],如果在疾病早期阶段即脑白质稀疏及腔隙性脑梗死阶段给予临床干预,VaD的发生率会降低。但是,目前关于VaD的诊断标准主要是建立在高危因素、神经系统表现和病因机制等的专家意见基础之上的,其主要目的是与AD临床表现相比而取得较高的诊断特异度和敏感度。按照目前VaD的诊断标准,患者得到诊断时往往病情已很严重,行为能力明显受限,错过了治疗的最佳阶段。而且这些诊断标准主要是用于鉴别VaD和AD,但是对于是AD还是VaD,有时临床鉴别起来比较困难,特别是由于长期的低氧-低灌注所致痴呆及隐匿性腔隙性脑梗死的鉴别,因此需要更多客观依据的支持。
通常认为,嗅觉功能损害存在于AD、帕金森及路易小体性痴呆等多种神经退行性疾病中,本研究结果表明VaD患者同样存在嗅觉功能损害。应用嗅觉fMRI可以间接反映嗅觉相关脑区的神经元活动,评价VaD患者的嗅觉功能可为进一步探讨伴有嗅觉功能损害疾病的发病机制提供依据,特别是对于早期鉴别诊断VaD和AD意义重大。
[References]
[1]Roman GC.Vascular dementia revisited: diagnosis, pathogenesis,treatment, and prevention.Med Clin North Am, 2002, 86(3): 477-499.
[2]Fotuhi M, Hachinski V, Whitehouse PJ.Changing perspectives regarding late-life dementia.Nature Reviews Neurology, 2009, 5(12):649-658.
[3]Kovács T.Mechanisms of olfactory dysfunction in aging and neurodegenerative disorders.Ageing research reviews, 2004, 3(2):215-232.
[4]Wang J, Eslinger PJ, Doty RL, et al.Olfactory deficit detected by fMRI in early Alzheimer’s disease.Brain Res, 2010, 1357: 184-194.
[5]Li W, Howard JD, Gottfried JA.Disruption of odour quality coding in piriform cortex mediates olfactory deficits in Alzheimer’s disease.Brain, 2010, 133(9): 2714-2726.
[6]Folstein MF, Folstein SE, McHugh PR.“Mini-mental state”: a practical method for grading the cognitive state of patients for the clinician.J psychiatr Res, 1975, 12(3): 189-198.
[7]Nasreddine ZS, Phillips NA, Bédirian V, et al.The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment.J Am Geriatr Soc, 2005, 53(4): 695-699.
[8]Morris JC.The clinical dementia rating (CDR): currentversion and scoring rules.Neurology, 1993, 43(11): 2412-2414.
[9]Carmichael ST, Clugnet MC, Price JL.Central olfactory connections in the macaque monkey.J Comp Neurol, 1994, 346(3): 403-434.
[10]Lee JS, Choi JC, Kang SY, et al.Olfactory identification deficits in cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy.European Neurology, 2010, 64(5): 280-285.
[11]Doty RL. Odor perception in neurodegenerative diseases.Neurol Dis Therapy, 2003, 57: 479-502.
[12]Attems J, Lintner F, Jellinger KA.Olfactory involvement in aging and Alzheimer’s disease: an autopsy study.J Alzheimers Dis, 2005, 7(2):149-157.
[13]Wilson RS, Arnold SE, Schneider JA, et al.The relationship between cerebral Alzheimer’s disease pathology and odour identification in old age.J Neurol Neurosurg Psychiatry, 2007, 78(1): 30-35.
[14]Howard JD, Plailly J, Grueschow M, et al.Odor quality coding and categorization in human posterior piriform cortex.Nature neuroscience, 2009, 12(7): 932-938.
[15]Gottfried JA, Winston JS, Dolan RJ.Dissociable codes of odor quality and odorant structure in human piriformcortex.Neuron, 2006, 49(3):467-479.
[16]Christen-Zaech S, Kraftsik R, Pillevuit O, et al.Early olfactory involvement in Alzheimer’s disease.Can J Neurol Sci 2003, 30(1):20-25.
[17]Poellinger A, Thomas R, Lio P, et al.Activation and habituation in olfaction: an fMRI study.Neuroimage, 2001, 13(4): 547-560.
[18]Sobel N, Prabhakaran V, Zhao Z, et al.Time course of odorant-induced activation in the human primary olfactory cortex.J Neurophysiol,2000, 83(1): 537-551.
[19]Chui H.Neuropathology lessons in vascular dementia.Alzheimer Dis Assoc Disord, 2005, 19(1): 45-52.
[20]Schmidtke K, Hüll M.Cerebral small vessel disease: how does it progress? J Neurol Sci, 2005, 229-230: 13-20.
[21]Ringelstein EB, Nabavi DG.Cerebral small vessel diseases: cerebral microangiopathies.Curr Opin Neurol, 2005, 18(2): 179-188.
[22]Xue YJ, Zhou ZF, Su YZ, et al.Calculation ability in mild vascular cognitive impairment and normal aging: a functional magnetic resonance imaging study.Chin J Magn Reson Imaging, 2012, 3(6):424-429.薛蕴菁, 周作福, 苏宇征, 等.轻度血管性认知障碍患者计算能力的功能MRI研究.磁共振成像, 2012, 3(6): 424-429.
[23]Yin YL, Yang XQ, Liu B, et al.Functional MRI study of calculation task of the healthy olders and the patients with MCI.Chin J CT MRI,2008, 6(4):7-10.尹昳丽, 杨小庆, 刘斌, 等.正常老年人与轻度认知功能障碍患者计算任务的功能磁共振研究.中国CT和MRI杂志, 2008, 6(4): 7-10.
[24]Thong JY, Hilal S, Wang Y, et al.Association of silent lacunar infarct with brain atrophy and cognitive impairment.J Neurol Neurosurg Psychiatry, 2013, 84(11): 1219-1225.
[25]O’Sullivan M.Leukoaraiosis.Pract Neurol, 2008, 8(1): 26-38.
[26]Gorelick PB, Scuteri A, Black SE, et al.Vascular contributions to cognitive impairment and dementia a statement for healthcare professionals from the American Heart Association/American Stroke Association.Stroke, 2011, 42(9): 2672-2713.
