CXCL5在膀胱癌组织中的表达及其临床意义
2014-12-13管振锋朱建宁杜依青王新阳贺大林范晋海
张 凯,管振锋,丁 晨,朱建宁,杜依青,王新阳,贺大林,范晋海
(西安交通大学医学院第一附属医院泌尿外科,陕西西安 710061)
据估计,2008年全球膀胱癌新增病例386 300例,死亡150 200例,且在世界范围内发病率差别较大,不同地区膀胱癌的发病率可相差14倍[1]。在美国,根据1975~2010年的统计,男性膀胱癌的发病率和死亡率分别位于恶性肿瘤发病率和死亡率的第4和第7位,膀胱癌严重威胁着人类的健康[2]。
趋化因子是一种重要的小分子细胞因子,到目前为止,近50种趋化因子得以发现,成为最大的细胞因子亚家族。根据蛋白质的一级结构进行分类:CXC(α);CC(β);C(γ);CX3C(δ)[3]。趋化因子及其受体在肿瘤发生、生长、转移等方面具有重要作用,趋化因子相关产品已经进入临床研究,成为新的生物治疗热点[4]。
在本研究中,我们用免疫组化法研究136例膀胱癌标本和30例正常膀胱组织标本中CXCL5表达水平,探讨CXCL5的表达与膀胱癌发生、发展、转移及预后的关系。
1 对象与方法
1.1 研究对象 收集西安交通大学医学院第一附属医院泌尿外科2006年1月至2009年1月间确诊为膀胱癌住院手术(包括膀胱肿瘤电切和膀胱全切)、并有完整临床和随访资料的膀胱癌患者136例,其中男105例,女31例;年龄27~84岁,平均(54.0±0.24)岁。病理诊断均为膀胱移行细胞癌。患者术前均未经过放疗及化疗等。正常膀胱组织取自30例膀胱癌全切标本,距离癌灶5cm 以上的癌旁膀胱组织视为正常膀胱组织。该研究方案经医院伦理委员会批准,详细实验情况告知患者并签署知情同意书。
1.2 肿瘤分级、分期及随访有关情况 病理分级按WHO 1973分级系统。肿瘤分期依据国际抗癌联盟(Union for International Cancer Control,UICC)2003版分期标准,生存时间的计算标准按从手术日到因复发或转移而死亡的日期或随访日期(2014年2月)为止。
1.3 主要试剂及仪器 兔抗人CXCL5多克隆抗体(sc-292642),工作浓度1∶200,购自Santa Cruz公司。免疫组化检测试剂盒,含山羊抗兔辣根过氧化物酶生物素化二抗,购自基因科技(上海)有限公司。
1.4 免疫组织化学方法 先将切片置于60 ℃烤箱内烘烤2h,然后二甲苯脱蜡,乙醇梯度水化,再将切片放入数控热抗原修复仪,121℃维持5min 进行抗原修复,之后阻断内源性过氧化物,用抗体稀释液按1∶200稀释兔抗人CXCL5多克隆抗体,每张切片设置一个阴性对照,用PBS 代替一抗。将加好一抗的切片放到湿盒内,置于4℃冰箱过夜,再用二抗在室温下孵育30min,然后DAB显色,苏木素复染,盐酸分化,氨水返蓝,最后用乙醇梯度脱水,二甲苯透明,用中性树胶封片。
1.5 结果判断 评分标准参考BEGLEY等[5]的方法,染色强度分级如下:无着色为0,淡棕黄色为1,棕黄色为2分,棕褐色为3分;阳性细胞数分级为:阳性细胞数<5%为0,5%~24%为1,25%~49%为2分,≥50%为3分。染色强度和阳性细胞比例评定阳性表达:随机选取一个视野后计数100个细胞中阳性细胞数,再在每张切片中选取8个400倍视野,然后计算阳性细胞率。目前多采用积分综合计量:两个得分相乘得到0~9分的总得分,将总得分0~3分组织视为CXCL5表达阴性,4~6分的组织视为CXCL5表达弱阳性,7~9 分的组织视为CXCL5 表达强阳性。
1.6 统计学方法 采用SPSS 17.0统计分析软件。计数资料分析用χ2检验,膀胱癌相关生存期生存分析采用Kaplan-Meier分析法,生存分析统计结果用Log-Rank检验判断差异性。P<0.05认为差异有统计学意义。
2 结果
2.1 CXCL5 在膀胱癌组织中的表达明显高于正常膀胱组织 免疫组化染色结果显示CXCL5在膀胱癌组织和正常膀胱组织的表达情况(图1A~1E)。图1A 为正常膀胱组织样本,可见有个别细胞胞质内有淡黄色颗粒;图1B为G1级膀胱癌组织,可见有少量细胞胞质内有淡黄色颗粒;图1C 为G2级膀胱癌组织,细胞胞质内有明显的棕色颗粒;图1D 为G3级膀胱癌组织,细胞胞质内有很明显的棕褐色颗粒;图1E为阴性对照切片。对趋化因子CXCL5的表达部位分析,CXCL5主要位于细胞质和细胞间质中,提示CXCL5可能分泌至细胞外发挥作用。
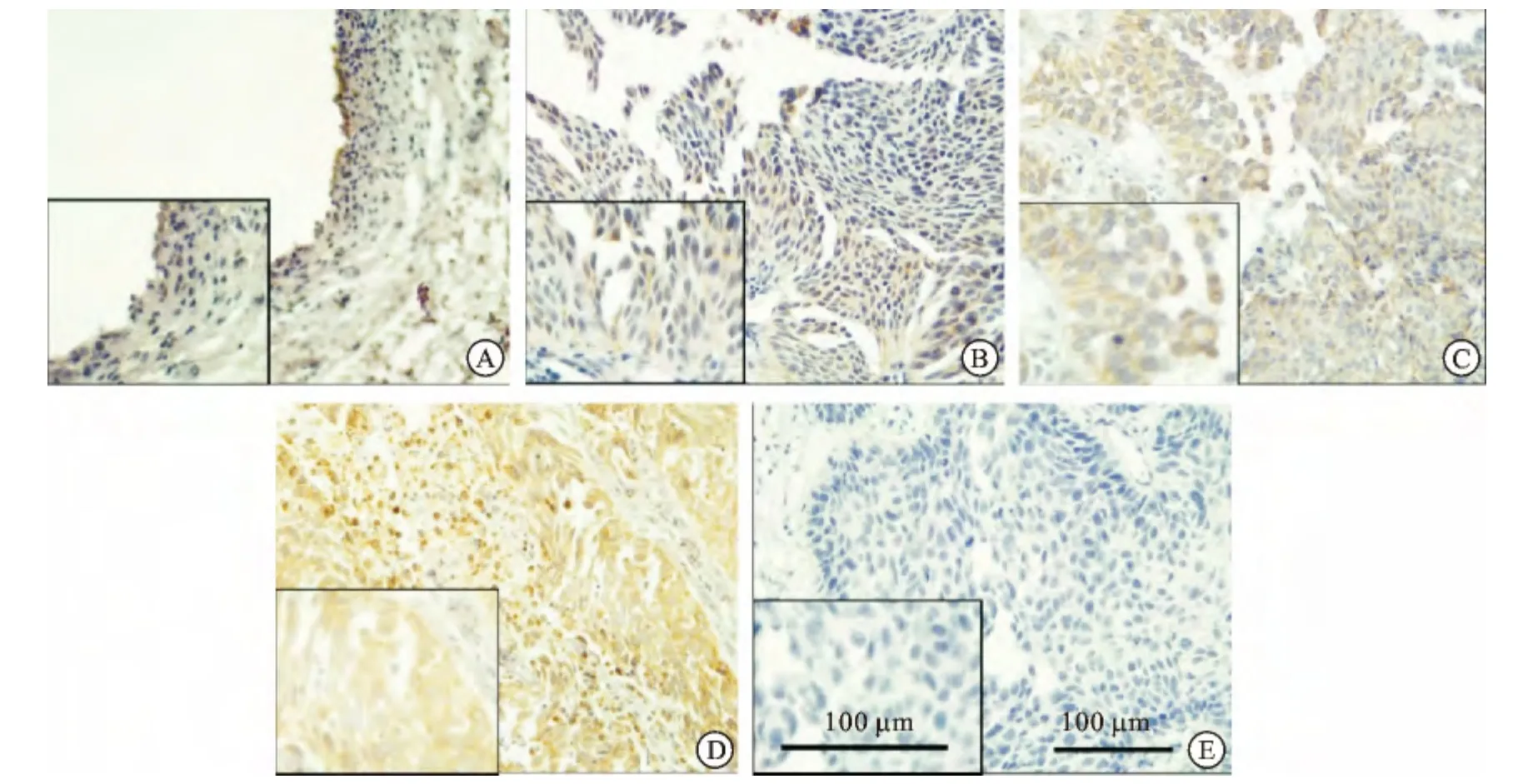
图1 CXCL5在正常膀胱组织和膀胱癌组织中的表达(左下角局部放大图)
在136例膀胱癌组织和30例正常膀胱组织中,趋化因子CXCL5染色阳性率在膀胱癌组织的表达率高于正常膀胱组织,差异有统计学意义(P<0.05,表1)。
2.2 膀胱癌组织中CXCL5的表达与病理分级、临床分期和淋巴结转移呈正相关 在男、女性中,CXCL5阳性表达率在性别、年龄分组方面差异无显著统计学意义(P均>0.05);在病理分级、肿瘤分期和淋巴结转移分组中,病理分级、分期高及有淋巴结转移者,CXCL5阳性表达率较高,差异有显著性统计学意义(P均<0.05,表2)。
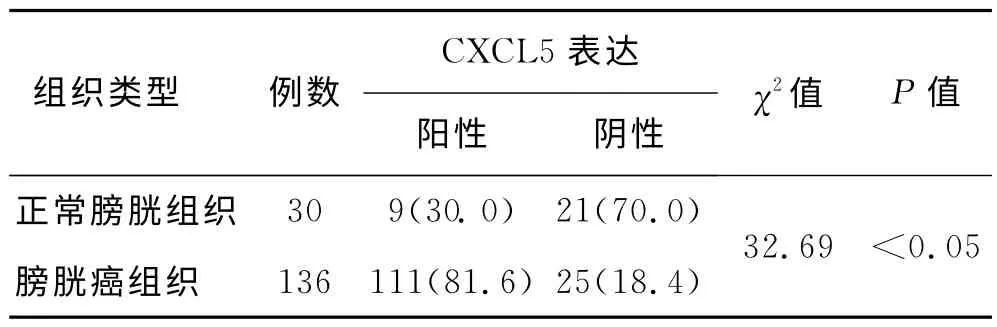
表1 CXCL5的表达阳性率在正常膀胱组织与膀胱癌组织中的比较 [例(%)]
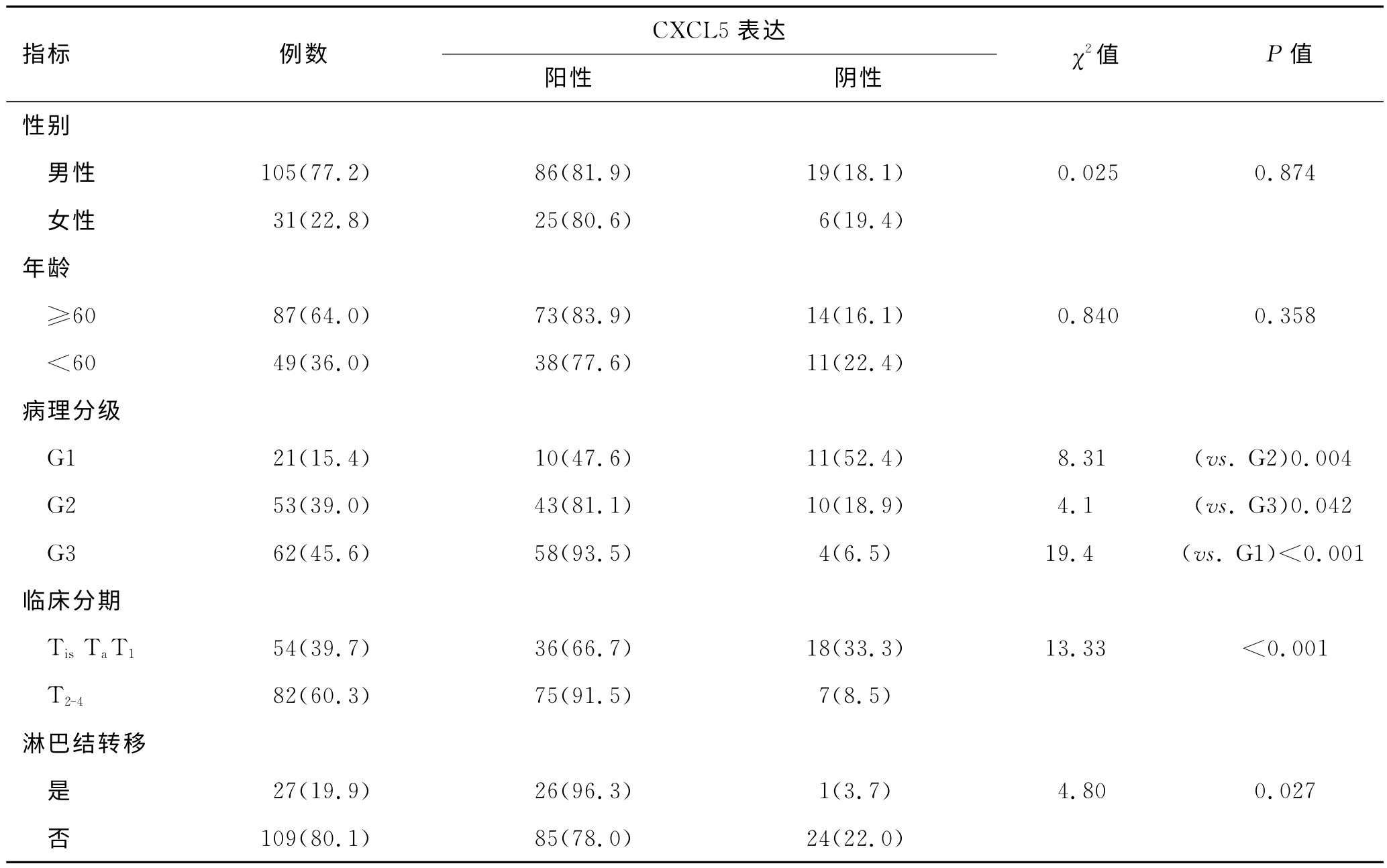
表2 CXCL5的阳性表达率在膀胱癌各分组间的差异 [例(%)]
2.3 膀胱癌组织中CXCL5的表达与预后呈负相关截止2014年2月,随访患者中最长随访时间为59个月,死亡39例,无瘤存活97例,失访病例已排除。根据随访资料,Kaplan-Meier生存曲线统计分析示:CXCL5强阳性表达组、弱阳性表达组和阴性组的中位生存期分别为36.0月、51.4月和56.0月;CXCL5强阳性表达组、弱阳性表达组和阴性组的5年生存率分别为43.4%、84.5%和100%。CXCL5的阳性表达与患者的5年生存率呈负相关。其中变量组间的差异分析使用Log-Rank检验分析,三者之间的生存率差异有统计学意义(χ2=12.34,P<0.05,图2)。
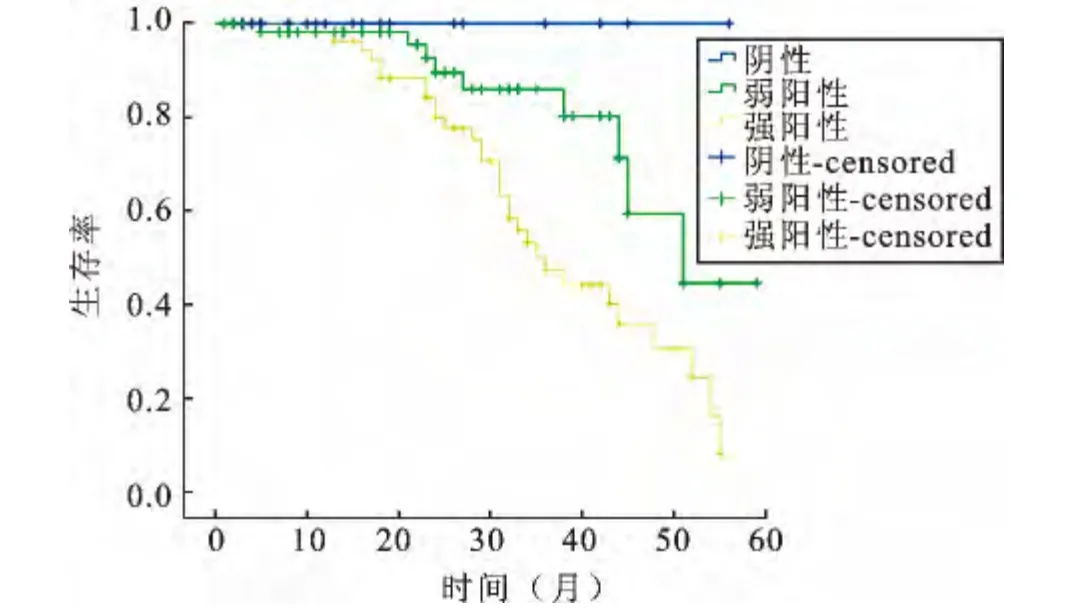
图2 CXCL5的表达与膀胱癌5年生存率的关系
3 讨论
CXC趋化因子是一组和肿瘤血管生成密切相关的细胞因子,根据第一个半胱氨酸前是否有ELR(谷氨酸-亮氨酸-精氨酸)功能区分为ELR 趋化因子和非ELR 趋化因子,其中ELR+趋化因子可使肿瘤血管新生,但非ELR 趋化因子可抑制肿瘤血管生成,而CXCL5属于ELR 趋化因子[6]。CXCL5可促进血管生成,具有很强的粒细胞趋化作用,由上皮细胞、中性粒细胞/内皮细胞、成纤维细胞等产生。研究显示CXCL5可识别并结合G 蛋白偶联受体CXCR2,对肿瘤的形成和进展发挥重要作用[7-8]。
血管生长在肿瘤发展、浸润和转移中起着非常重要的作用,是肿瘤生长的基础[9]。实验研究表明抑制肿瘤血管生成可明显影响肿瘤的生长、转移及进展[10]。白细胞介素-17 可明显增强趋化因子CXCL1、5、8在肿瘤血管生成的活力,通过增加肿瘤的微血管密度来促进肿瘤的生长[11]。肿瘤细胞可与宿主的特异性趋化因子受体结合进而获得生长优势,研究发现肝、肺等靶器官的特异性转移与淋巴转移机制有关,可能通过分泌IL-8等趋化因子从而募集嗜中性白细胞,进而上调蛋白酶活性,从而降解细胞外基质促进肿瘤细胞的侵袭转移等[3]。CXCL5属于(ELR+)CXC趋化因子,推断其通过促进血管形成和募集炎症细胞进而在膀胱癌发生、发展、浸润及转移中发挥重要作用。
多项研究发现CXCL5在非小细胞肺癌[12]、胰腺恶性肿瘤[6]、肾癌[13]、大肠癌[14]、胆管上皮癌[15]和前列腺癌[5]中表达明显增高,表达水平与疾病的晚期状态、局部浸润和转移潜能相关。近来,有学者用PCR和Western blot检测CXCL5 在膀胱癌组织和细胞中的表达,并用shRNA 下调膀胱癌细胞T24中CXCL5的水平,可降低T24 细胞增殖、迁移能力,并通过PI3K-AKT 和ERK1/2信号途径在体外诱导细胞凋亡[16]。
本研究中,免疫组化结果提示膀胱癌组织中的CXCL5 阳性率明显高于正常膀胱组织的阳性率。CXCL5的表达水平与膀胱癌病理分级、临床分期、淋巴结转移呈正相关。而且CXCL5 的表达水平与膀胱癌的预后有关,CXCL5表达越高,预后也越差。我们推断CXCL5在膀胱癌的发生、转移中可能扮演了较为重要角色,参与的机制可能有:①CXCL5 激活癌细胞的PI3K-AKT 和ERK1/2 信号通路,促进肿瘤增殖、迁移和侵袭。此外,在体外研究中,CXCL5对中性粒细胞有直接趋化作用。在动物实验中,癌细胞中CXCL5的上调促进肿瘤细胞的生长以及肺转移,瘤内中性粒细胞浸润数目也增加[17]。②CXCL5 与CXCR2受体结合使肿瘤细胞易于移动,肿瘤细胞骨架重建;CXCL5促进肿瘤形成的新生血管或作为肿瘤转移的重要通道;CXCL5与受体结合释放MMP-9,使基质屏障破坏,促进肿瘤转移[18]。③CXCL5与受体结合后通过PI3K-AKT 和MAPK 信号通路,激活转录因子ELKl,从而激活下游一些与肿瘤发生、生长及转移相关的基因,进而发挥促进肿瘤生长及转移[19]。CXCL5与受体结合后,可作用于酪氨酸激酶受体(RPTKs),从而引起趋化运动、血管内皮细胞增殖及抑制内皮细胞凋亡等生物学效应[20-21]。本研究结果与前人研究类似,据此推测CXCL5可能通过促进膀胱癌血管形成、降解癌细胞外基质、抑制癌细胞凋亡来影响膀胱癌的发生、发展及转移等。
综上,CXCL5可能通过PI3K-AKT 和ERK1/2信号通路抑制膀胱癌细胞凋亡,进而影响膀胱癌的进展和预后。趋化因子基因治疗和基因疫苗有望成为膀胱癌治疗的新方法。
[1]JEMAL A,BRAY F,CENTER M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]SIEGEL R,MA J,ZOU Z,et al.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(1):9-29.
[3]ZLOTNIK A.Chemokines and cancer[J].Int J Cancer,2006,119(9):2026-2029.
[4]SARVAIYA P J,GUO D,ULASOV I,et al.Chemokines in tumor progression and metastasis[J].Oncotarget,2013,4(12):2171-2185.
[5]BEGLEY L A,KASINA S,MEHRA R,et al.CXCL5promotes prostate cancer progression[J].Neoplasia,2008,10(3):244-254.
[6]LI A,KING J,MORO A,et al.Overexpression of CXCL5is associated with poor survival in patients with pancreatic cancer[J].Am J Pathol,2011,178(3):1340-1349.
[7]KOCH A E,KUNKEL S L,HARLOW L A,et al.Epithelial neutrophil activating peptide-78:a novel chemotactic cytokine for neutrophils in arthritis[J].J Clin Invest,1994,94(3):1012-1018.
[8]WALZ A,BURGENER R,CAR B,et al.Structure and neutrophil-activating properties of a novel inflammatory peptide(ENA-78)with homology to interleukin 8[J].J Exp Med,1991,174(6):1355-1362.
[9]KEANE M P,STRIETER R M.The role of CXC chemokines in the regulation of angiogenesis[J].Chem Immunol,1999,72:86-101.
[10]FOLKMAN J.Fighting cancer by attacking its blood supply[J].Sci Am,1996,275(3):150-154.
[11]ZEITLIN B D,JOO E,DONG Z,et al.Antiangiogenic effect of TW37,a small-molecule inhibitor of Bcl-2[J].Cancer Res,2006,66(17):8698-8706.
[12]YANAGAWA J,WALSER T C,ZHU L X,et al.Snail promotes CXCR2ligand-dependent tumor progression in non-small cell lung carcinoma[J].Clin Cancer Res,2009,15(22):6820-6829.
[13]HLAVKOVA D,KOPECKY O,LUKESOVA S,et al.Monitoring of serum levels of angiogenin,ENA-78and GRO chemokines in patients with renal cell carcinoma(RCC)in the course of the treatment[J].Acta Medica(Hradec Kralove),2008,51(3):185-190.
[14]KAWAMURA M,TOIYAMA Y,TANAKA K,et al.CXCL5,apromoter of cell proliferation,migration and invasion,is a novel serum prognostic marker in patients with colorectal cancer[J].Eur J Cancer,2012,48(14):2244-2251.
[15]ZHOU S L,DAI Z,ZHOU Z J,et al.CXCL5contributes to tumor metastasis and recurrence of intrahepatic cholangiocarcinoma by recruiting infiltrative intratumoral neutrophils[J].Carcinogenesis,2014,35(3):597-605.
[16]ZHENG J,ZHU X,ZHANG J.CXCL5knockdown expression inhibits human bladder cancer T24cells proliferation and migra-tion[J].Biochem Biophys Res Commun,2014,446(1):18-24.
[17]ZHOU S L,DAI Z,ZHOU Z J,et al.Overexpression of CXCL5mediates neutrophil infiltration and indicates poor prognosis for hepatocellular carcinoma[J].Hepatology,2012,56(6):2242-2254.
[18]TACKE F,ZIMMERMANN H W,TRAUTWEIN C,et al.CXCL5plasma levels decrease in patients with chronic liver disease[J].J Gastroenterol Hepatol,2011,26(3):523-529.
[19]MURPHY C,MCGURK M,PETTIGREW J,et al.Nonapical and cytoplasmic expression of interleukin-8,CXCR1,and CXCR2correlates with cell proliferation and microvessel density in prostate cancer[J].Clin Cancer Res,2005,11(11):4117-4127.
[20]SHYAMALA V,KHOJA H.Interleukin-8receptors R1and R2 activate mitogen-activated protein kinases and induce c-fos,independent of Ras and Raf-1in Chinese hamster ovary cells[J].Biochemistry,1998,37(45):15918-15924.
[21]WU J L,ABE T,INOUE R,et al.IkappaBalphaM suppresses angiogenesis and tumorigenesis promoted by a constitutively active mutant EGFR in human glioma cells[J].Neurol Res,2004,26(7):785-791.