补体过度激活在应激致早期流产及宫内发育迟缓中的作用
2014-11-21党慧敏刘艳巧吴晓玲刘润侠
党慧敏,刘艳巧*,吴晓玲,刘润侠,安 鹏
(1西安交通大学第二附属医院中医科,西安 710004;2西安交通大学第二附属医院妇产科;*通讯作者,E-mail:liuyanqiao@sohu.com)
应激(stress)是指机体在受到各种内外环境刺激时所出现的非特异性全身反应,其对于生殖能够产生较为不利的影响,通常都与妊娠失败密切相关且还会影响子代的健康[1,2],以往对声波应激模型研究表明,围着床期接受应激后会使流产率增加[3],而其可能的机制与母胎界面的炎性细胞募集等有关[4];胚胎是一种半同种异体移植物,但大多数都不被母体免疫系统所排斥,而是维持至分娩,即母胎免疫耐受[5],而补体系统对于适应性免疫具有调节作用[6],活化的补体成分如C3a、C5a等可趋化招募炎性细胞,炎性细胞经可溶性血管内皮生长因子受体(fms-like tyrosine kinase-1,sFlt-t)途径如血管内皮生长因子(vascular endothelial growth factor,VEGF)表达下降导致胎盘发育不足,发生胚胎损伤,导致复发性自然流产(recurrent spontaneous abortion,RSA)及宫内发育迟缓(intrauterine growth restriction,IUGR)的发生[7]。CBA/J(雌)×DBA/2J(雄)小鼠为国际上公认的自发性流产经典模型,与人类RSA临床表现类似,本文以其为研究对象,明确补体激活在应激后自发性流产孕鼠早期流产及胎儿宫内发育迟缓中的作用。
1 材料和方法
1.1 实验动物及分组
选择8周龄未经产雌性CBA/J小鼠80只,雄性DBA/2J小鼠30只及BALB/c小鼠10只,体质量18-22 g,均购自北京华阜康实验动物中心,并饲养于SPF级环境中。将雌性CBA/J小鼠与雄性DBA/2J及BALB/c小鼠按2∶1于前晚6∶00合笼,次日晨8∶00用镊子检查阴栓,可见阴栓者即为妊娠0.5 d,雌性CBA/J小鼠与雄性DBA/2J小鼠合笼后成功受孕57只,受孕率为95%,将成功受孕的自然流产模型CBA/J(雌)×DBA/2J(雄)孕鼠编号后按随机化原则分为模型组、低应激组及高应激组,每组各19只。雌性CBA/J小鼠与雄性BALB/c小鼠合笼后成功受孕20只,设为正常对照组,模型组小鼠平均周龄(7.32± 0.82)周,平均体质量(19.89±1.38)g。高应激组平均周龄(7.58±0.69)周,平均体质量(20.30±1.23)g。低应激组平均周龄(7.42±0.77)周,平均体质量(20.05±1.32)g。对照组平均周龄(7.55±0.60)周,平均体质量(20.28±1.28)g。各组小鼠年龄及体质量差异无统计学意义。
1.2 干预方法
参照Blois等[8]声波应激模型方法,低应激组孕鼠于妊娠5.5 d给予持续24 h声频为460 Hz,1 s/次,间隔14 s(由 Mathworks Matlab R2009a软件控制),分贝强度为88 dB(由优利德电子(上海)有限公司生产UT351分贝测量仪测定)的声波刺激;高应激组孕鼠于妊娠5.5 d给予持续24 h声频为460 Hz,5 s/次,间隔 10 s,分贝强度为 88 dB 的声波刺激;对照组及模型组孕鼠均不接受任何声波刺激。
1.3 检测指标
将各组孕鼠分为两批取材,首先于妊娠7.5 d对各组孕鼠各14只行眶下静脉取血2 ml,检测其血清C3a及VEGF、sFlt-1水平,同时留取各组孕鼠胎盘蜕膜组织测定VEGF蛋白表达水平;最后于妊娠13.5 d处死对照组孕鼠6只及模型组、低、高应激组孕鼠各5只,分别记录活胎数、死胎数,称重胚胎质量,并计算胚胎吸收率。
1.3.1 血清C3a及VEGF、sFlt-1检测 将各组孕鼠2 ml静脉血1 500 r/min离心5 min后取上清,采用双抗体夹心法酶联免疫吸附试验(ELISA)分别检测所采集血清标本的C3a、VEGF、sFlt-1水平,操作按试剂盒(购自福州蓝图生物科技有限公司)的说明书进行;根据吸光度及标准曲线换算小鼠血清C3a、VEGF及sFlt-1质量浓度。
1.3.2 蜕膜组织VEGF蛋白表达测定 将各组孕鼠胎盘蜕膜组织固定于0.01 mg/ml甲醛中,经常规脱水、石蜡包埋,4μm连续切片后,常规脱蜡,梯度酒精中浸泡,滴加3%的双氧水15 min以灭活内源性酶;热修复抗原;滴加兔抗VEGF多克隆抗体(一抗,滴度1∶100,Abcam公司生产),4℃孵育过夜;滴加有辣根过氧化物酶标记的抗兔IgG抗体(二抗,北京中杉金桥生物有限公司生产),37℃孵育45 min,DBA显色,镜下控制反应时间,显色后脱水,透明,封片。光镜下观察,VEGF表达阳性为棕黄色颗粒。阴性对照用PBS代替一抗,其他步骤相同。选取同批染色切片,每张切片在光镜下随机取5个不同视野,以切片染色的背景作对照,用OLYMPUS CX31病理图文分析系统测定阳性信号的积分光密度(integral optical density,IOD)值,以此反映组织切片中相应阳性物质的相对表达量。
1.3.3 胚胎吸收率及重量测定 将各组孕鼠于麻醉处死后记录活胎数、死胎数,称重胚胎质量,并计算胚胎吸收率[胚胎吸收率=死胎数/(活胎数+死胎数)×100%]。
死胎判断标准[9]:丢失胚胎为体积明显缩小,或失去正常胚胎形状,胎儿胎盘单位颜色暗红,母胎界面有出血水肿。
1.4 统计学分析
2 结果
2.1 各组小鼠胚胎吸收率、胚胎重量的比较
将各组孕鼠处死后,观察并记录其子宫、胚胎、胎盘、羊膜囊的情况。正常对照组(图1A,见第1001页)可见正常胚胎粗大如串珠状,胚胎呈淡红色,胚胎体积及形态正常,母胎界面无出血及水肿;应激组(图1B、1C,见第1001页)可见羊膜囊较小,胎儿胎盘单位颜色暗红,母胎界面有明显出血或可见部分子宫呈竹节样改变,胚胎呈黑褐色,仅见到胚胎着床点,胚胎已完全或部分消失。

图1 丢失胚胎的判定(妊娠13.5 d)Figure 1 Macroscopic evaluation of fetal loss(gestational 13.5 d)

图2 免疫组织化学检测各实验组蜕膜组织的VEGF表达水平(×400)Figure 2 Expression of VEGF in decidual tissue by immunohistochemistry(×400)
我们进一步分析各组胚胎吸收率和胚胎重量,结果显示:相比对照组,模型组胚胎吸收率明显升高;低、高应激组与模型组分别相比较,其胚胎吸收率均明显升高;且高应激组与低应激组相比,胚胎吸收率明显增高,各组间差异均有统计学意义(均P<0.05,见表1)。各组胚胎重量相比较,模型组显著低于对照组;模型组胚胎重量值高于低、高应激组,差异有统计学意义;高应激组与低应激组相比,其胚胎重量明显下降,各组间差异有统计学意义(均P<0.05)。
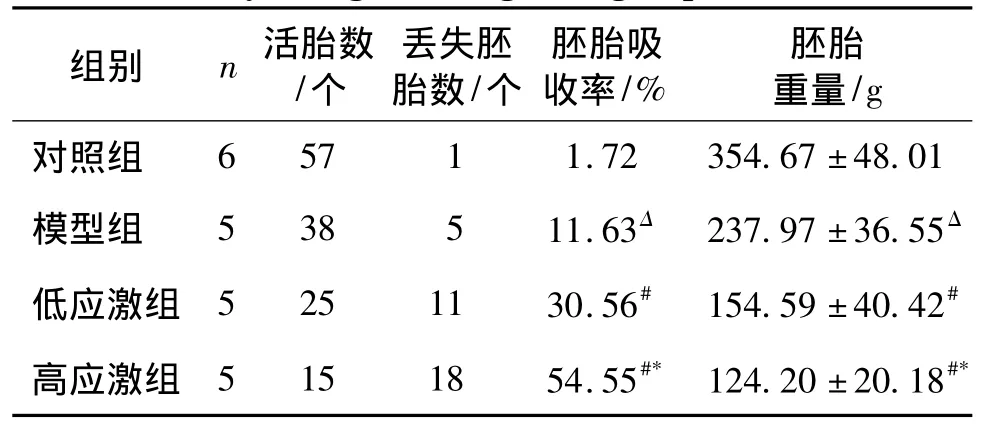
表1 各组胚胎吸收率及胚胎重量的比较Table 1 Comparison of embryo absorption rate and embryo weight among four groups
2.2 各组小鼠血清C3a、VEGF和sFlt-1水平的比较
各组血清C3a及sFlt-1水平相比较,模型组均明显高于对照组,差异有统计学意义(P<0.05,见表2);各应激组与模型组相比,其血清C3a及sFlt-1水平均显著升高,差异有统计学意义(P<0.05);而高应激组血清C3a及sFlt-1水平均明显高于低应激组,差异有统计学意义(P<0.05)。同时,各组血清VEGF水平相比,模型组低于对照组,差异有统计学意义(P<0.05),应激组其血清VEGF水平相比模型组均明显下降(P<0.05),高应激组血清VEGF水平相比低应激组显著降低,差异有统计学意义(P<0.05)。
表2 各组血清C3a、VEGF及sFlt-1水平的比较(±s)Table 2 Comparison of serum C3a,VEGF and sFlt-1 levels among four groups(±s)

表2 各组血清C3a、VEGF及sFlt-1水平的比较(±s)Table 2 Comparison of serum C3a,VEGF and sFlt-1 levels among four groups(±s)
与对照组比较,ΔP<0.05;与模型组比较,#P<0.05;与低应激组比较,*P<0.05
高应激组 201.16±103.2523.55±7.172 797.00±396.57
2.3 各组小鼠蜕膜VEGF蛋白表达水平的比较
在各组小鼠蜕膜中,VEGF主要表达于腺上皮细胞和血管内皮细胞胞质中(图2,见第1002页),模型组小鼠蜕膜VEGF阳性染色明显低于正常对照组,组间表达差异有统计学意义(P<0.05),应激后自然流产小鼠蜕膜VEGF积分光密度值相比模型组明显下降,差异有统计学意义(P<0.05),其中高应激组小鼠蜕膜VEGF表达水平与低应激组比较明显降低,差异有统计学意义(P<0.05,见表3)。
表3 各组蜕膜VEGF表达水平的比较(±s)Table 3 Comparison of decidual VEGF expression levels among four groups(±s)

表3 各组蜕膜VEGF表达水平的比较(±s)Table 3 Comparison of decidual VEGF expression levels among four groups(±s)
与对照组比较,ΔP<0.05;与模型组比较,#P<0.05;与低应激组比较,*P<0.05
?
3 讨论
固有免疫系统为抵御外源性微生物侵害机体的第一道防线,补体是固有免疫的重要组成成员。补体系统经经典途径、旁路途径、甘露糖结合凝集素(MBL)途径所激活,形成C3转化酶,将C3分解为C3a和C3b,C3a脱落进入体液,而C3b分别与C4b2b和C3bBb结合组成C5转化酶C4b3b2b和C3b3bBb,进而形成攻膜复合物(MAC)[10]。活化C5a和 C3a是强烈的过敏性毒素,可招募激活炎性细胞,导致或增强炎症反应。相关研究发现,CBA/J(雌)×DBA/2J(雄)自然流产模型小鼠胚胎吸收率明显较正常对照组高,胎盘及存活胚胎的重量显著低于正常组;胚胎残骸、胎盘及蜕膜的单核细胞有大量C3沉着,炎性细胞的浸入。补体抑制剂Crry-Ig或B因子敲除或抗B因子抗体处理后均可显著降低胚胎吸收率、胚胎重量增长,减少C3的沉着和炎性细胞的浸润,与正常组无差异,表明RSA及IUGR发生与补体异常激活密切相关[11,12]。本研究结果显示,自发流产模型组孕鼠胚胎吸收率相比正常对照组明显升高,胚胎重量低于对照组,同时血清C3a水平较对照组明显升高,亦证明自然流产及IUGR的发病与补体异常激活关系密切。
近年来研究显示,补体异常激活可通过sFlt-1途径导致RSA的发生。胎盘正常发育依赖于血管内皮生长因子(VEGF)、胎盘生长因子(PIGF)及相应的受体,体内外研究发现,补体异常激活型RSA可能与血管生成因子紊乱有关,sFlt-1具有血管内皮生长因子受体Ⅰ样结合VEGF的能力,但无生物学功能,具有强烈的抗血管生成作用[13]。自然流产模型小鼠血清游离VEGF水平明显低于正常组,不足以满足妊娠的需求,而流产组sFlt-1较对照组明显升高;流产组经补体抑制剂Crry-Ig处理,可阻止sFlt-1升高,游离VEGF水平与对照组相当,妊娠得以维持,且胚胎重量相比自然流产明显升高,表明sFlt-1升高是补体异常激活的结果,是RSA及IUGR的重要机制。本研究结果表明,模型组相比正常组血清sFlt-1升高,血清VEGF水平下降同时胎盘蜕膜VEGF表达减少,影响胚胎原始血管形成、胚胎发育、胎盘形成等过程,从而导致RSA及IUGR的发生。
研究表明,躯体或心理的应激都会使神经、内分泌及免疫系统受到影响,而这些系统的平衡正是妊娠维持所必需的,在通常状态下,细胞应激或组织受损,细胞里一般就会释放一些分子并且与固有免疫细胞表面上的模式识别受体(pattern recognition receptor,PRRs)相结合,进而引发炎性反应[14],通过研究接受应激后的小鼠模型表明,其成熟的子宫树突状细胞数目增长,子宫引流淋巴结中Treg细胞下降,并且分泌炎性细胞因子如TNF-α、IFN-γ的Th1细胞克隆扩增增长,从而严重影响了胚胎耐受[15],其中精神应激不但能够导致不孕而且能导致流产,有研究表明声波应激能够导致妊娠早期同种异体胚胎的丢失,可能与其导致Th1/Th2比值升高有关[16],其能够减少高和低胚胎丢失模型鼠中大血管分布密度,在高胚胎丢失模型中,声波应激可使表达VCAM-1的血管分布显著增加[17]。通过本研究结果显示,接受声波应激后自然流产孕鼠相比较模型组,胚胎吸收率明显升高,存活胚胎重量进一步下降,同时血清C3a及sFlt-1水平异常增高,且升高水平与其接受应激的强度呈正比,血清VEGF水平及蜕膜VEGF表达显著下降,分析其导致高胚胎流失率并加剧IUGR发生的作用机制可能与应激导致补体过度活化产生过多的C3a趋化激活中性粒细胞或单核细胞,激活的中性粒细胞或单核细胞经sFlt途径导致胎盘蜕膜VEGF表达减少,胎盘血管形成不足,血管重塑障碍有关,且病情程度与应激程度呈正相关。
总之,本研究证实补体异常激活在应激致RSA早期流产、IUGR中均发挥重要作用,不同程度的应激刺激导致补体系统经经典途径或旁路途径异常激活,且活化的程度与其受应激的强度成正比,异常活化的补体成分趋化招募炎性细胞,炎性细胞经sFlt途径导致胎盘发育不足导致胚胎损伤,导致早期流产及IUGR发生,而应激导致补体过度活化等具体机制有待进一步研究。
[1]Nakamura K,Sheps S,Arck PC.Stress and reproductive failure:past notions,present insights and future directions[J].J Assist Reprod Genet,2008,25(2/3):47-62.
[2]Seckl J,Meaney M.Glucocorticoid programming[J].Ann NY Acad Sci,2004,1032(1):63-84.
[3]Blois S,Tometten M,Kandil J,etal.Intercellular adhesion molecule-1/LFA-1 cross talk isa proximate mediator capable of disrupting immune integration and tolerance mechanism at the feto-maternal interface in murine pregnancies[J].J Immunol,2005,174(4):1820-1829.
[4]Arck P,Merali F,Manuel J,etal.Stress-triggered abortion:inhibition of protective suppression and promotion of tumor necrosis factor-alpha(TNF-alpha)release as a mechanism triggering resorptions in mice[J].Am.J Reprod Immunol,1995,33(1):74-80.
[5]Girardi G,Prohaszka Z,Bulla R,etal.Complement activation in animal and human pregnancies as a model for immunological recognition[J].Mol Immunol,2011,48(14):1621-1630.
[6]Sjöberg A,Trouw L,Blom A.Complement activation and inhibition:a delicate balance[J].Trends Immunol,2009,30(2):83-90.
[7]苏小玲,赵爱民,林其德.补体异常激活在复发性流产中的作用[J].国际妇产科学杂志,2013,40(4):353-357.
[8]Blois S,Ilarregui J,Tometten M,etal.A pivotal role for galectin-1 in fetomaternal tolerance[J].Nat Med,2007,12(13):1450-1457.
[9]Chaouat G,Zourbas S,Ostojic S,etal.A brief review of recent data on some cytokine expression at maternal fetal interface which hight challenge the classical Th1/Th2 dichotomy[J].JReprod Immunol,2002,53(1-2):241-256.
[10]Lim W.Complement and the antiphospholipid syndrome[J].Curr Opin Hematol,2011,18(5):361-365.
[11]Takeshita A,Kondo T,Okada T,etal.Elevation of adipsin,a complement activating factor,in the mouse placenta during spontaneous abortion[J].J Reprod Dev,2010,56(5):508-514.
[12]Girardi G,Yarilin D,Thurman J,etal.Complement activation induces dysregulation of angiogenic factors and causes fetal rejection and growth restriction[J].JExp Med,2006,23(9):2165-2175.
[13]Breen K,Seed P,Parmar K,etal.Complement activation in patients with isolated antiphospholipid antibodiesor primary antiphospholipid syndrome[J].Thromb Haemost,2012,107(3):423-429.
[14]Seong S,Matzinger P.Hydrophobicity:an ancient damage-associated molecular pattern that initiates innate immune responses[J].Nat Rev Immunol,2004,4(6):469-478.
[15]Blois S,Kammerer U,Soto C,etal.Dendritic cells:key to fetal tolerance[J].Biol Reprod,2007,77(4):590-598.
[16]Clark D,Blois S,Kandil J,etal.Reduced uterine indoleamine 2,3-dioxygenase versus increased Th1/Th2 cytokine ratios as a basis for occult and clinical pregnancy failure in mice and humans[J].Am JReprod Immunol,2005,54(4):203-216.
[17]Prados M,Solano ME,Friebe A,etal.Stress increases VCAM-1 expression at the fetomaternal interface in an abortion-pronemouse model[J].Reprod Immunol,2011,89(2):207-211.
