XRCC1、APE1单核苷酸多态性与食管癌放疗敏感性的相关性
2014-11-21韩高华徐千明王松华程国昌
黄 河,韩高华,徐千明,王松华,郭 婷,程国昌
(1泰州市人民医院肿瘤内科,泰州 225300;2泰州市人民医院普通外科;*通讯作者,E-mail:chengguochang@126.com)
放射治疗是食管癌综合治疗的主要手段之一,约50%-60%的患者在患病过程中会接受放射治疗。而临床工作中,我们注意到有些病理类型甚至临床分期相同的患者,给予相同放射治疗后,近期疗效和预后并不一致,放射治疗反应差异明显[1]。这种个体间放疗反应差异与遗传变异有关[2,3]。肿瘤患者自身基因状态如DNA损伤修复基因(XRCC、APE1、ERCC 等)近年来倍受关注[4]。本研究选取150例接受单一放疗方案的初治食管癌患者为研究对象,检测其外周血DNA修复基因(XRCC1、APE1单核苷酸多态性)的分布情况,同时比较其与食管癌放射治疗敏感性的关系,以期寻找一种能够预测食管癌放疗敏感性的可靠指标,指导临床合理治疗。
1 资料与方法
1.1 一般资料
本研究选取150例2010-04~2012-08在我院接受单行放疗的初治食管鳞癌患者。年龄32-82岁,平均(64±10)岁,均为汉族人。接受放射治疗前,无肺、肝等远处器官转移,无肝肾等器官功能障碍,一般情况良好。
1.2 放疗方法及疗效评价
三维适形放疗,常规分割2.0 Gy/次、近似剂量60-66 Gy/30-33次,放疗结束3个月后复查食管钡透、胸部CT及肿瘤标志物。RECIST标准判断近期疗效[5]。完全缓解(CR):食管钡餐提示原发肿瘤病灶消失,食管壁柔软,钡剂顺利通过,胸部CT扫描食管壁厚度小于5 mm,原肿大淋巴结消失,没有新发病灶出现;部分缓解(PR):食管钡餐、胸部CT扫描测量食管原发病灶基线最长径减少≥30%;疾病稳定(SD):根据食管钡餐、胸部CT扫描测量食管原发病灶基线减少未达到PR,或者增大未达到PD;疾病进展(PD):根据食管钡餐、胸部CT扫描测量得食管原发病灶基线最长径总和增大≥20%,或出现一个或多个新发病灶。CR+PR为放疗有效组,SD+PD为放疗无效组。
1.3 DNA提取和基因型分析
放疗前留取静脉血2 ml,乙二胺四乙酸钠抗凝采血管留存待检。用苯酚-氯仿法抽提白细胞DNA,-20℃低温冰箱保存备用。以限制性片段长度多态性聚合酶链反应(PCR-RFLP)方法进行XRCC1和APE1基因型分析。XRCC1的引物为:上游 5’-TCTCCCTTGGTCTCCAACCT-3’和下游5’-AGTAGTCTGCTGGCTCTGG-3’,产物大小为402 bp;APE1的引物为:上游5’-CTGTTTCATTTCTATAGGCTA-3’和下游 5’-AGGAACTTGCGAAAGGCTTC-3’,产物大小为164 bp。30μl体系,反应条件为:95℃预变性5 min,95℃ 30 s、62.3℃ 30 s和72℃ 1 min进行30个循环,72℃延伸7 min。分别取5μl PCR反应产物与限制性核酸内切酶MspⅠ或BfaⅠ于37℃孵育过夜,3%琼脂糖凝胶电泳,GDS-8000凝胶图像分析系统分析电泳图谱,判断各基因型。
第399密码子Arg/Gln突变后可被MspⅠ识别,酶切产物有269 bp和133 bp两个片段;杂合子则产生402 bp、269 bp、133 bp三个片段;而野生型只有402 bp一个片段。第148密码子Asp1/Glu突变后可被BfaⅠ识别,酶切产物有144 bp和20 bp两个片段;杂合子则产生164 bp、144 bp、20 bp三个片段;而野生型只有164 bp一个片段。我们同时采用直接测序的方式进行验证,确保引物分型准确。测序结果证实,引物扩增片段与预期符合,与PCRRFLP分型法一致。
1.4 统计学分析
数据处理采用SPSS 13.0软件进行,卡方检验分析XRCC1、APE1不同基因型之间放射治疗的疗效差异;非条件logistic回归模型计算OR值和95%CI,同时经患者年龄、性别、组织类型、临床分期等指标校正。双侧检验,以P<0.05为差异有显著性。
2 结果
2.1 放疗效果
150例食管鳞癌患者经根治性三维适形或调强放疗,有效125例,占83.3%;无效25例,占16.7%。不同年龄、性别、病理分化程度、临床分期患者间放疗有效率差异无统计学意义(P>0.05,见表1)。
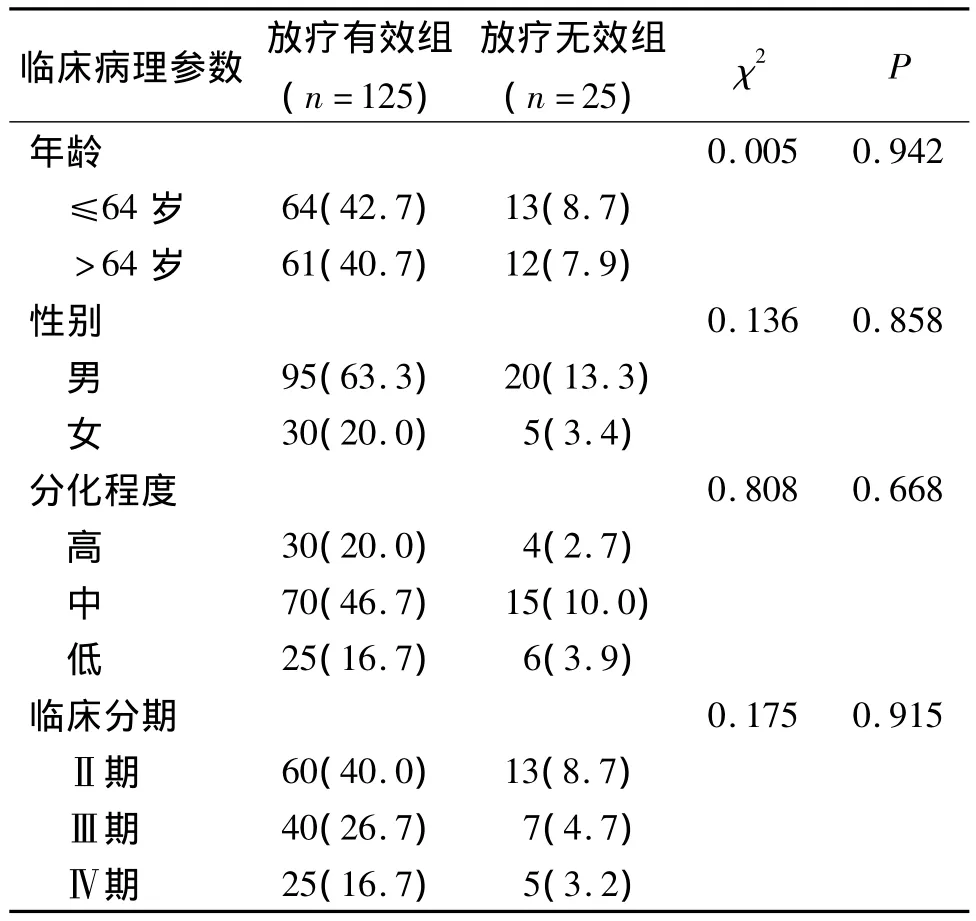
表1 食管癌放疗患者临床病理参数及疗效比较 例(%)Table 1 Comparison of clinicopathological parameters and clinical efficacy between radiosensitive group and radioresistant group cases(%)
2.2 基因型分布
本研究150例食管鳞癌患者中,携带 APE1 148Asp/Glu基因型者97例,占64.7%;53例携带Asp/Asp基因型,占35.3%;Glu/Glu突变纯合子未检测到。携带 XRCC1 399 Arg/Arg基因型32例(21.3%),携带 Arg/Gln 基因型 43 例(28.7%),携带Gln/Gln基因75例(50.0%)。以上多态性位点各等位基因分布符合Hardy-Weinberg平衡,该人群具有代表性。
2.3 基因多态性与化疗效果
XRCC1 399 Arg/Arg、Arg/Gln、Gln/Gln 基因型患者放射治疗有效率分别为 59.4%,88.4%和90.7%;三种基因型放疗效率差异有统计学价值(P=0.010<0.05)。XRCC1 399 Gln/Gln基因型患者放疗有效率是 Arg/Arg基因型患者的6.967倍(95%CI 1.849-27.917,P=0.016)。
Arg/Arg基因型携带患者与至少一个Gln等位基因携带患者放疗有效率间差异有统计学意义(P=0.039)。携带APE1 Asp/Glu基因型患者放疗有效率为 87.6%,高于Asp/Asp基因型患者(75.5%);其放疗有效率是携带Asp/Glu基因型患者的 2.451 倍(95%CI:0.806-7.564),差异无统计学价值(P=0.115)。APE1突变纯合型(Glu/Glu)本研究中未检测到(见表2)。
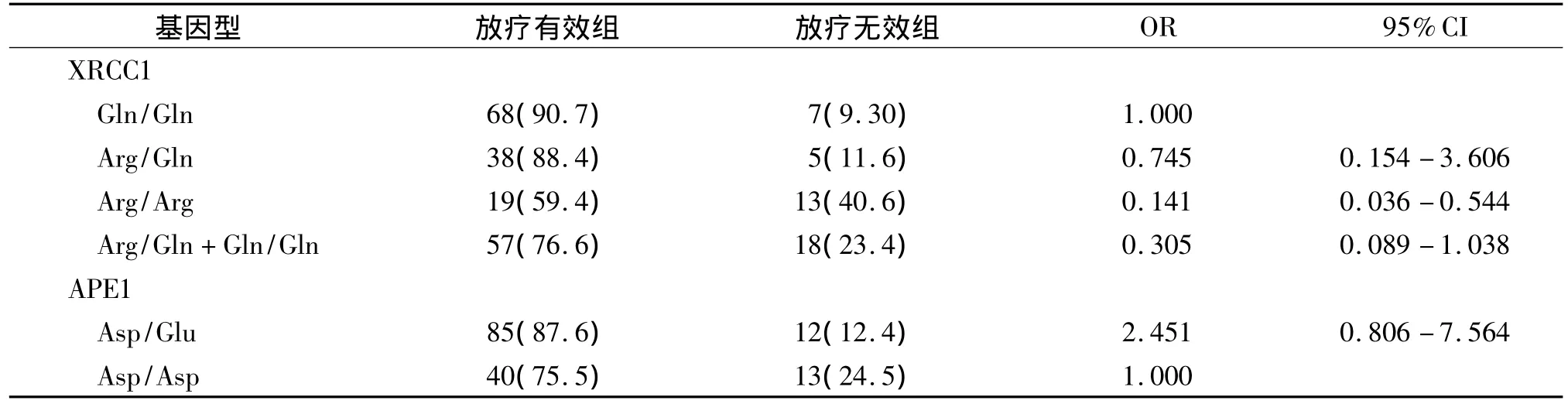
表2 XRCC1、APE1基因型与食管癌近期疗效关系 例(%)Table 2 Relationship between XRCC1,APE1 genotype and short-term efficacy in patients with esophageal cancer cases(%)
为进一步分析APE1和XRCC1基因的内在联系,我们比较了 APE1 Asp194Glu与 XRCC1 Arg399Gln两个位点基因型联合表达情况与放疗敏感性的关系。结果表明,同时携带APE1 194Asp/Glu和XRCC1 399Gln/Gln基因型的患者,其放疗有效率最高(达67.8%),明显高于携带其他基因型患者的疗效(P=0.02<0.05)。
3 讨论
中国食管癌发病率和死亡人数最高,占全球食管癌发病和死亡人数的53.86%和49.26%。食管癌死亡率在我国位于十大恶性肿瘤的第四位[6]。多数患者就诊时已属中晚期,丧失手术机会,放射治疗占有重要地位。临床上我们发现病理类型和临床分期均相同的患者,采用同样的放疗方案,其疗效有一定的差异。如果在治疗前能预测到这种放疗敏感性的差异,就可以制定个体化的放疗方案,提高治愈率。因此,依据遗传学特征选择合理的个体化治疗方案是目前食管癌治疗的热点问题之一[7]。
高能射线作用于细胞DNA,或直接损伤DNA分子链,引起DNA的单链、双链断裂;或通过OH-自由基对DNA分子链的作用,间接引起DNA分子链结构和功能的损伤,使转录、复制停止,诱导细胞周期阻滞,留待修复,无法修复的细胞将死亡。显然,DNA损伤修复的能力就决定了肿瘤对辐射的敏感性。因此,具有DNA损伤修复作用的类X射线交错互补修复基因1(XRCC1)及脱嘌呤/脱嘧啶核酸内切酶(APE1)基因成为受人关注的候选基因。
XRCC1基因参与离子辐射和化学诱变剂所致DNA损伤后的单链断裂修复和碱基切除修复,是重要的DNA修复基因[8]。XRCC1能通过自身的不同部位与多种碱基切除修复相关蛋白(如 DNA聚合酶β、PARP1等)结合并发生相互作用,促进对DNA损伤修复,对维持基因组的稳定起关键作用,并参与DDP或 CBP引起的 DNA损伤修复过程。文献报道主要是Arg399Gln位点的多态性改变与细胞DNA的损伤修复能力有关[9]。本研究发现XRCC1 Arg399Gln多态性与食管鳞状细胞癌放疗反应密切相关,Gln/Gln、Arg/Gln、Arg/Arg基因型患者放疗有效率分别为 90.7%,88.4% 和 59.4%;XRCC1 399Gln/Gln基因型患者放疗有效率是Arg/Arg基因型患者的6.967倍(95%CI1.849-27.917,P=0.016)。携带Arg/Arg基因型患者与携带至少一个Gln等位基因患者放疗有效率间差异有统计学意义(P=0.039)。我们推测XRCC1 28152位点核苷酸G→A转换引起编码的精氨酸(Arg)变成了谷氨酰胺(Gln),从而抑制了XRCC1蛋白的功能,进而减弱了DNA的修复能力,从而使患者对放疗具有更好的反应性。Chang-Claude等[10]进行了乳腺癌放疗敏感病例与非敏感病例的对比研究,发现放射敏感病例XRCC1 399位点的Gln的比例明显高于不敏感者。Cometta等[11]利用X线(2 Gy)照射健康人外周血细胞后立即采用慧星分析,同时测定XRCCl的基因型,结果发现携带399Gln/Gln纯合子的慧星尾部长于野生型和杂合型,体现其放射敏感性强于其他基因型。这些都进一步印证了我们的结论。此外,不同人群的遗传背景也可能会影响研究结果。张旭升等[12]针对新疆地区食管鳞癌患者的研究与我们的结论相反。他们发现携带Arg/Arg基因型的患者对放疗更为敏感。这提示研究对象的异质性也会影响SNP放疗效果。
APE1是BER通路的限速酶,对维护DNA修复起关键作用,负责修复氧化性损伤所导致的DNA脱嘌呤/脱嘧啶(AP)位点[13]。APE1基因最常见的多态性位点是T1349G(Asp148Glu),该位点突变会导致染色体损伤频率增加,减低DNA修复能力。不少研究发现APE1 T1349G多态性能改变肿瘤发生风险[14,15],但本研究仅发现同时携带 APE1 194Asp/Glu和XRCC1 399Gln/Gln基因型的患者,其放疗有效率最高,达67.8%,明显高于携带其他基因型患者的疗效;并未发现该多态性与食管癌放疗敏感性直接相关。
总之,本研究显示,XRCC1基因多态性与食管癌患者放疗近期疗效明显有关,APE1基因多态性可能与XRCC1有联合协同作用。外周血标本检测SNP简便易行,但是需要后续大样本前瞻性研究进一步证实XRCC1和APE1基因多态性的预测价值,我们有望利用XRCC1和APE1 SNP情况预测食管癌患者放射治疗疗效,从而更好地指导个体化治疗。
[1]ChiCW,Chen CC,Chen YJ.Therapeutic and radiosensitizing effects of armillaridin on human esophageal cancer cells[J].Evid Based Complement Alternat Med,2013,4(5):92-97.
[2]Yang C,Wang Y,Zhang F,etal.Inhibiting UHRF1 expression enhances radiosensitivity in human esophageal squamous cell carcinoma[J].Mol Biol Rep,2013,40(9):5225-5235.
[3]Qian D,Zhang B,He LR,etal.The telomere/telomerase binding factor PinX1 is a new target to improve the radiotherapy effect of oesophageal squamous cell carcinomas[J].J Pathol,2013,229(5):765-774.
[4]Yao Y,Shi J,Zhang Z,etal.The radiation-sensitizing effect of flavopiridol in the esophageal cancer cell line Eca109[J].Oncol Lett,2013,5(6):1872-1876.
[5]You Y,Liu J,Wang Z,etal.The enhancement of radiosensitivity in human esophageal squamous cell carcinoma cells by zoledronic acid and its potential mechanism[J].Cytotechnology,2013,19(3):112-123.
[6]Enzinger PC,Mayer RJ.Esophageal cancer[J].N Engl J Med,2003,49:2241-2252.
[7]Rousseau D,Capitain O,Denis F,etal.Esophageal cancer:outcome according to therapeutic strategy[J].Cancer Radiother,2013,17(1):10-20.
[8]Yoon HH,Gibson MK.Combined-modality therapy for esophageal and gastroesophageal junction cancers[J].Curr Oncol Rep,2007,9:184-192.
[9]Wang Y,Spitz MR,Lee JJ,etal.Nucleotide excision repair pathway genes and oral premalignant lesions[J].Clin Cancer Res,2007,13:3753-3758.
[10]Chang-Claude J,Ambrosone CB,Lilla C,etal.Genetic polymorphisms in DNA repair anddamage response genes and late normal tissue complications of radiotherapy for breast cancer[J].BrJ Cancer,2009,100:1680-1686.
[11]Cometta T,Festa F,Testa A,etal.DNA damage repair and genetic Polymorphisms:Assessment of individual sensitivity and repair capacity[J].Int J Radiat Oncol Biol Phys,2006,66(2):537-545.
[12]张旭升,阿合力,那斯肉拉,等.hOGG1、XRCC1、XRCC3单核苷酸多态性与食管癌放射敏感性的相关性研究[J].新疆医科大学学报,2010,33(5):473-481.
[13]Fareed KR,Al-Attar A,Soomro IN,etal.Tumour regression and ERCC1 nuclear protein expression predict clinical outcome in patients with gastro-oesophageal cancer treated with neoadjuvant chemotherapy[J].Br J Cancer,2010,102(11):1600-1607.
[14]Tse D,Zhai R,Zhou W,etal.Polymorphisms of the NER pathway genes,ERCC1 and XPD are associated with esophageal adenocarcinoma risk[J].Cancer Causes Control,2008,19(10):1077-1083.
[15]Al-Attar A,Gossage L,Fareed KR,etal.Human apurinic/apyrimidinic endonuclease(APE1)is a prognostic factor in ovarian,gastro-oesophageal and pancreatico-biliary cancers[J].Br J Cancer,2010,102(4):704-709.
