同种异体骨髓间充质干细胞在大鼠体内心肌缺血微环境中Nav1.5的表达
2014-11-21王亭忠倪雅娟马爱群
张 静,王亭忠,魏 峰,倪雅娟,马爱群*
(1新疆医科大学第四附属医院心脏中心,乌鲁木齐 830000;2西安交通大学医学院第一附属医院心内科;3西安交通大学医学院第二附属医院心内科;*通讯作者,E-mail:maaiqun@medmail.com.cn)
通过MSCs移植修复或替代严重受损或坏死的心肌细胞来改善缺血性心脏病心脏功能、逆转心肌重构已成为目前的研究热点[1]。大量动物实验[2-4]表明,心肌梗死区域 MSCs的局部移植可向心肌细胞分化,但也有研究[2]观察到心肌梗死患者接受MSCs移植后会发生心律失常。心律失常的发生发展与心肌上离子通道的分化表达有重要关系,钠离子通道对心肌细胞动作电位的产生、传导和维持动作电位时程等起到重要作用。其中,Nav1.5是钠离子通道孔形成的亚基单位,在心电活动中发挥重要作用[5]。该研究拟观察同种异体的MSCs移植到大鼠体内心肌缺血微环境后Nav1.5的表达情况,为移植后心律失常发生的研究提供实验基础。
1 材料与试剂
1.1 实验动物
80 g清洁级雄性SD大鼠1只,用于骨髓供体;180-200 g清洁级雄性SD大鼠50只,用于建立MI模型,均由西安交通大学医学院实验动物中心提供。
1.2 仪器及试剂
BL-420生物机能实验系统购于成都泰盟科技有限公司,HM325石蜡切片机购于德国MICROM公司,激光显微切割仪购于瑞士LEICA公司,BX51型正置光学显微镜购于日本Olympus公司,水合氯醛购于西安化学试剂厂,兔抗大鼠Nav1.5抗体购于美国Santa cruz公司,山羊抗兔IgG-Cy3购于北京康为世纪生物科技有限公司。
1.3 实验方法
1.3.1 MSCs的分离、标记及贴壁培养 采用Percoll’s密度梯度离心法结合贴壁培养法分离纯化SD大鼠 MSCs,采用文献[6]的方法,以携带 GFP的慢病毒载体转染标记,将GFP标记的MSCs悬液以5×105/ml接种于培养瓶中,放在37℃的5%CO2培养箱中孵育。24h后更换培养基,加入新鲜的含10%FBS的DMEM培养基,每3-4 d换液一次,直到细胞占瓶底的80%或接近融合时,用0.25%的胰蛋白酶消化,直到细胞回缩成圆形,倒掉胰蛋白酶,向培养瓶中加入DMEM培养基,吸管吹打,待细胞从瓶壁上脱落后,平分为两瓶,各加入新鲜的10%FBS,完成传代培养。
1.3.2 MI模型的建立 100 g/L水合氯醛以3 ml/kg的剂量通过腹腔注射麻醉健康成年SD大鼠(n=50),常规备皮、消毒、铺巾,剪开皮肤,钝性分离胸大肌和前锯肌,用血管弯钳穿透肋间肌进入胸腔并沿肋间隙方向撑开,另一血管弯钳沿垂直肋间隙方向撑开肋骨,适当用力将心脏挤出,迅速在左心耳与肺动脉圆锥交界处平左心耳下缘2 mm处,以7/0无损伤缝合线结扎LAD近端,结扎后立即将心脏归位并置入接注射器的引流管,对合皮肤的同时抽出胸腔内气体约2 ml维持胸腔负压,立即拔管并行胸外按压,体表心电图观察有无急性心肌梗死后ST段抬高的心电图改变,待心率、心律及呼吸正常且平稳后,缝合皮肤,术后连续3 d肌肉注射青霉素钠。
1.3.3 GFP标记的MSCs的体内移植 将成功建立MI模型的42只大鼠2周后接受MSCs移植,采用建立MI模型的同样方法麻醉、开胸、暴露心脏,用1 ml胰岛素注射器于心肌梗死局部发白区即MI周边区圆周分布均匀迅速注射6×106个MSCs(约0.15 ml细胞悬液),注射后的心脏归位等步骤同MI模型的建立。
1.3.4 心肌组织标本的提取 将再次成功建立移植模型的34只大鼠于移植后第3,5,7,9天分别随机处死 10,10,10,4 只。第 3,5,7 天处死的 10 只中,5只用于免疫荧光染色,5只用于Real-time PCR法检测,第9天处死的4只,用于TUNEL凋亡染色。
1.3.5 免疫荧光染色将第3,5,7天处死的大鼠心脏取出,冲洗,取注射部位的心肌组织,40 g/L多聚甲醛固定,200 ml/L蔗糖溶液脱水,OCT包埋,冰冻,连续组织切片,行常规免疫荧光染色;一抗浓度为兔抗大鼠Nav1.5(1∶100),二抗浓度为Cy3标记的山羊抗兔(1∶100);激光共聚焦显微镜观察其结果。
1.3.6 real-time PCR 检测 同 1.3.5 中方法取出心脏,取注射部位的心肌组织,制备组织切片,方法同免疫荧光染色。应用激光显微切割仪捕获切片上GFP标记的MSCs,消化酶消化未移植的MSCs及各时间点的RNA,并行逆转录,反应条件为25℃,10 min;50℃,20 min;85℃,5 min;real time-PCR反应条件为50℃,2 min;95℃,2 min;95℃,15 s;60℃,30 s,5个循环,内参基因为甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)。采用2-ΔΔCt的方法分别计算其相对表达量。
1.3.7 TUNEL 凋亡染色 处死9 d 的大鼠,同1.3.5中方法取出心脏,取注射部位的心肌组织,方法同免疫荧光染色,将组织吸附到用多聚赖氨酸处理过的载玻片上制备组织切片;添加20μg/ml蛋白酶K稀释液,室温孵育;再次固定,滴入Equilibration缓冲液后滴加rTdT反应混合物同时覆盖塑料盖膜,37℃湿盒中孵育;避光环境下加入Streptavidin HRP稀释液,室温孵育,PBS冲洗后加入DAB稀释液,室温干燥;荧光显微镜结合光学显微镜观察结果并拍照。
1.4 统计学处理
2 结果
2.1 GFP标记的MSCs的贴壁培养与标记
GFP标记的MSCs呈成纤维细胞样的长梭形,贴壁生长,分布均匀,增殖速度较快(见图1)。
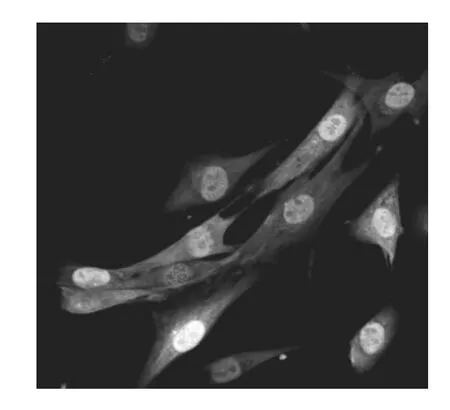
图1 GFP标记的MSCs的贴壁培养 (×600)Figure 1 Adherent culture of GFP-labeled MSCs(×600)
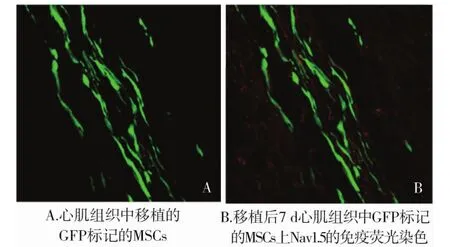
图2 体内移植的GFP标记的MSCs及其免疫荧光染色(×600)Figure 2 The transplanted GFP-labeled MSCs in vivo and their immunofluorescence staining(×600)
2.2 移植的MSCs局部分布特点及Nav1.5的免疫荧光染色
通过免疫荧光显微镜观察移植的GFP标记的MSCs,在心肌组织内排列方向与心肌细胞一致,呈带状分布(图2A,见第1001页),通过Nav1.5的免疫荧光染色观察到于移植后3,5,7 d均无Nav1.5的表达(见图2B,见第1001页)。
2.3 GFP标记的MSCs移植前后mRNA的表达
移植的MSCs上 Nav1.5 在移植后3,5,7 d之间比较及与未移植的MSCs相比,其相对表达量均无明显变化(P>0.05,见图3)。
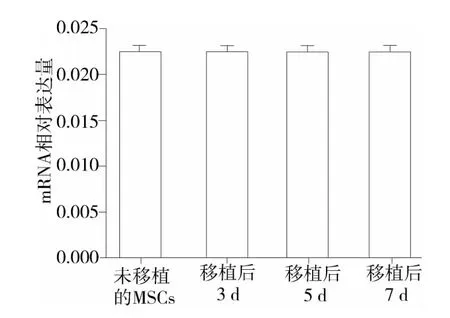
图3 GFP标记的 MSCs移植前后 Nav1.5 mRNA相对表达量Figure 3 Relative expression of Nav1.5 mRNA before and after transplantation
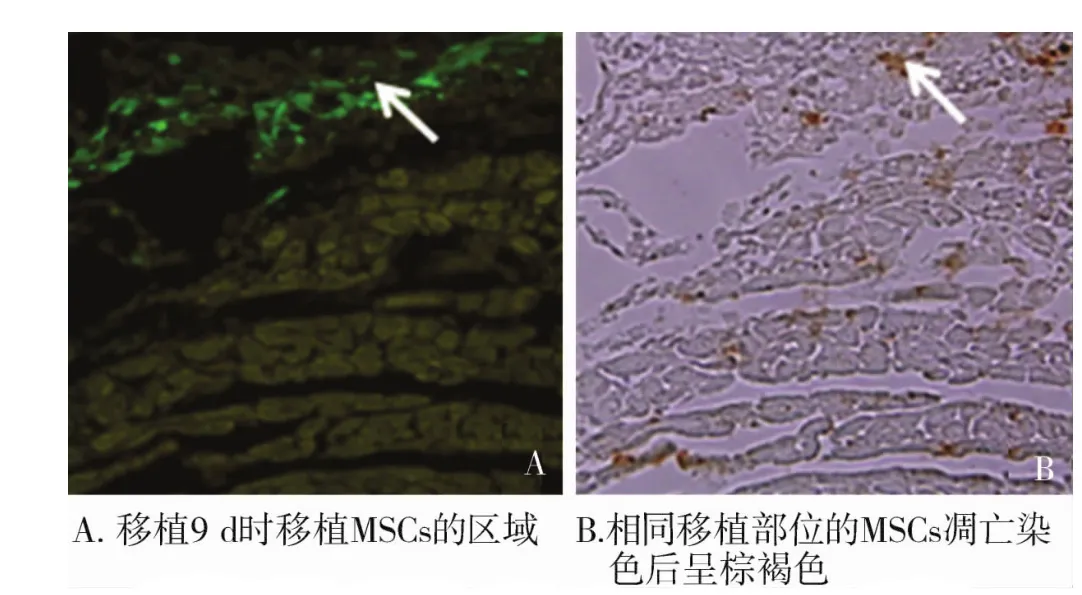
图4 移植的MSCs的TUNEL凋亡染色(×200)Figure 4 TUNEL staining of the transplanted MSCs(×200)
2.4 TUNEL 凋亡染色
移植的MSCs数量逐渐减少,移植后9 d,MSCs细胞数量明显减少,移植区域行TUNEL凋亡染色示移植区域的GFP标记的MSCs在光镜下呈棕褐色(图4,箭头所示,见第1001页)。
3 讨论
MSCs已成为移植领域的热点细胞[7],大量的动物实验、临床试验已证实MSCs的移植可以修复坏死的心肌细胞从而改善心脏功能。有实验证实移植的MSCs的分化具备环境诱导依赖性[8]。移植的MSCs所处环境是病态环境,周围既有正常的心肌细胞,也有受损或异常的心肌细胞以及纤维瘢痕组织等,MSCs具有多向分化潜能,是否能够向正常心肌细胞分化而具有正常心肌细胞的电生理特性有待证实。
电压门控型钠离子通道是维持心肌细胞电活动的主要离子通道之一,包括α和β两个亚基[9]。其中,Nav1.5是钠通道家族成员之一,是钠通道的主要α亚基,具有钠通道主要电生理特性,新近研究已证实许多心律失常的发生是由于Nav1.5不能正常分化表达而致心肌传导功能障碍所引起[10],如先天性或获得性长QT综合征、Brugada综合征、扩张性心肌病、病态窦房结综合征、心房颤动、心肌传导功能障碍及婴儿猝死综合征等[11,12]。影响 Nav1.5分化表达的因素不单是离子通道本身,还包括其相互作用蛋白,通过复杂的分子和细胞学机制精确调节Nav1.5表达和生物学功能而影响其电生理特性[13]。本实验证实移植的MSCs在体内心肌缺血微环境中不表达Nav1.5,其表达缺失是由于离子通道本身还是其相互作用蛋白的缺失所致尚不明确。本实验小组前期研究结果表明移植的MSCs在体内心肌缺血微环境中可以表达cTnI、MYH、Cx43等心肌特异性标志物,说明移植的MSCs在形态学上朝心肌细胞方向分化,但本实验结果提示移植的MSCs不能获得正常心肌细胞的钠离子通道的电生理特性,这可能会增加移植细胞与宿主心肌细胞间电生理偶联的异质性,会引起心电活动的异常,从而导致心律失常的发生。
本实验同时观察到随着移植时间的延长,移植的MSCs细胞数量逐渐减少,证实其在心肌缺血微环境中发生了凋亡,有动物试验发现MSCs移植后24 h,50%以上的移植细胞发生了凋亡,1周后超过90%的移植细胞发生了凋亡[14],推测微环境可能是影响MSCs凋亡的主要因素,其具体机制尚不明确,可能与移植区域周边心肌细胞因坏死而产生肌纤维的断裂、细胞间网格结构破坏及在微环境中缺乏足够的营养能量供给等相关,局部注射的移植方法本身也可能使移植区域细胞分布不均匀,引起周围炎症细胞聚集发生急性炎症反应致使移植细胞凋亡,其具体机制尚需进一步实验证实。
[1]Nabel EG,Braunwald E.A tale of coronary artery disease and myocardial infarction[J].N Engl JMed,2012,366:54-63.
[2]Fukushima S,Varela-Carver A,Coppen SR,etal.Direct intramyocardial but not intracoronary injection of bone marrow cells induces ventricular arrhythmias in a rat chronic ischemic heart failure model[J].Circulation,2007,115(17):2254-2261.
[3]Perin EC,Dohmann HF,Borojevic R,etal.Transendocardial,autologous bone marrow cell transplantation for severe,chronic ischemic heart failure[J].Circulation,2003,107(18):2294-302.
[4]Ben-Dor I,Fuchs S,Kornowski R.Potential hazards and technical considerations associated with myocardial cell transplantation protocols for ischemic myocardial syndrome[J].JAm Coll Cardiol,2006,48(8):1519-26.
[5]Camacho JA,Hensellek S,Rougier JS,etal.Modulation of Nav1.5 channel function by an alternatively spliced sequence in the DⅡ/DⅢ linker region[J].J Biol Chem,2006,281(14):9498-9506.
[6]魏峰,马爱群,王亭忠,等.慢病毒载体介导GFP标记大鼠骨髓间充质干细胞[J].西安交通大学学报:医学版,2010,31(3):288-92.
[7]Nasef A,Fouillard L,Ashammakhi N.Immunomodulatory effect of mesenchymal stromal cells:possible mechanisms[J].Regener Med,2008,3(4):531-46.
[8]Tosh D,Slack JM.How cells change their phenotype[J].Nature Rev Mol Cell Biol,2002,3(3):187-94.
[9]Abriel H,Kass RS.Regulation of the voltage-gated cardiac sodium channel Nav1.5 by interacting proteins[J].Trends Cardiovasc Med,2005,15(1):35-40.
[10]Plant LD,Bowers PN,Liu Q,etal.A commom cardiac sodium channel variant associated with sudden infant death in African A-mericans,SCN5A S1103Y[J].J Clin Invest,2006,116(2):430-435.
[11]Kerr NC,Gao Z,Holmes FE,et,al.The sodium channel Nav1.5a is the predominant isoform expressed in adult mouse dorsal root ganglia and exhibits distinct inactivation properties from the fulllength Nav1.5 channel[J].Mol Cell Neurosci,2007,35(2):283-291.
[12]Goldin AL.Resurgence of sodium channel research[J].Annu Rev Physiol,2001,63(1):871-894.
[13]Gavillet B,Rougier JS,Domenighetti AA,etal.Cardiac sodium channel Nav1.5 is regulated by a multiprotein complex composed of syntrophins and dystrophin[J].Circ Res,2006,18:407-414.
[14]Zhang M,Methot D,Poppa V,etal.Cardiomyocyte grafting for cardiac repair:graft cell death and anti-death strategies[J].J Mol Cell Cardiol,2001,33(5):907-21.
