1株尿素分解菌的分离及其生长特性
2014-10-25李广悦张振远丁德馨王永东
陈 杰,李广悦* ,张振远,丁德馨,王永东,胡 南
(1.南华大学铀矿冶生物技术国防重点学科实验室,湖南 衡阳 421001;2.南华大学 核资源工程学院,湖南 衡阳 421001)
为提高岩土工程的稳定性,岩土工程加固技术被广泛使用。然而现有的锚固、注浆等物理、化学方法通常需要昂贵的设备,且易造成岩土扰动和环境污染[1]。利用微生物诱导碳酸钙沉淀(MICP)进行岩土加固是一种绿色原位加固新技术[2-3]。MICP技术是通过向岩土中注入具有脲酶活性的微生物以及胶结液(尿素和氯化钙溶液),利用微生物产生的脲酶催化尿素水解为铵离子和碳酸根离子,将体系的pH提高,碳酸根离子与钙离子形成碳酸钙晶体,从而将岩土原位固化[4]。与传统的加固方法相比,MICP技术具有能耗低、扰动小、环境友好的优点,是新一代的岩土工程加固技术,已引起各国学者的广泛关注,并开展了大量的研究[5-8]。具有脲酶活性的尿素分解菌,是MICP技术中被广泛使用的细菌[9-10]。但由于生长环境的差异,不同地域微生物的生长特性也存在明显差异,而土著微生物更能适应本地域的环境条件。为获得MICP技术所需的土著微生物,本研究从当地土壤中分离了1株尿素分解菌,并研究了其生长特性,为细菌扩大培养提供了参数,为微生物胶结实验提供了控制条件。
1 材料与方法
1.1 材料
1.1.1 土样 用于细菌分离的土样采集自实验室附近的花木种植园。
1.1.2 培养基(g/L) 选择性培养基:酵母提取物10,硫酸铵 20,无水乙酸钠 8.2,尿素 60.6,自然pH值,过滤灭菌;NA-尿素固体培养基:蛋白胨10,牛肉膏3,尿素60.6,氯化钠 5,琼脂 15,1.6%溴甲酚紫2 mL/L,调pH=7。除琼脂外,其他成分采用过滤灭菌,将琼脂高压灭菌,待其冷却至50℃时,倒入液体培养基中,并迅速倒入平皿;NH4-YE培养基:酵母提取物20,氯化铵10,过滤灭菌。
1.2 方法
1.2.1 细菌分离与纯化 取土样5 g置于盛有100 mL选择性培养基的250 mL锥形瓶中,在30℃、200 r/min条件下培养24 h。取培养后的悬液稀释成 10-2、10-3、10-4三个浓度梯度,涂布于NA-尿素固体培养基,30℃静止培养48 h。挑取NA-尿素固体培养基上呈紫色的菌落,用选择性富集培养液培养后再涂于NA-尿素固体培养,培养结束后挑取紫色菌落进行再次纯化,按此方法反复纯化3次。
1.2.2 微生物浓度检测 使用蛋白核酸测定仪(Biophotometer eppendorf Germany)检测微生物浓度,所用波长为600 nm,所测值用OD600表示。
1.2.3 生长特性研究 ①初始pH对细菌生长的影响:将NH4-YE培养基pH分别调至6.0、7.0、8.0、9.0、10.0,分装于250 mL 三角瓶中,每瓶100 mL,接种量1%,30 ℃、200 r/min 分别培养 3、12、15、18、21、24 h,取样检测细菌浓度;②接种量对细菌生长的影响:将NH4-YE培养基pH调至8.5,分装于250 mL三角瓶中,每瓶100 mL,接种量分别为1%、2%、4%、8%和16%。于30℃、200 r/min 分别培养3、12、15、18、21、24 h,取样检测细菌浓度;③温度对细菌生长的影响:将NH4-YE培养基pH调至8.5,分装于250 mL三角瓶中,每瓶100 mL,接种量1%,分别于20、25、30、35 和40 ℃下,200 r/min 培养 3、12、15、18、21、24 h,取样检测细菌浓度;④摇床转速对细菌生长的影响:将NH4-YE培养基pH调至8.5,分装于250 mL三角瓶中,每瓶100 mL,接种量1%,30℃、转速分别为100、150、200 和250 r/min 下培养3、12、15、18、21、24 h,取样检测细菌浓度。
1.2.4 最适生长条件下细菌生长曲线 依据生长特性研究确定的最适生长条件进行细菌培养,定期取样检测细菌浓度。
2 结果与分析
2.1 细菌分离
培养2 d后NA-尿素固体培养基上开始出现菌落。由于培养基中含有尿素,当目标菌具有尿素分解能力时,可将尿素分解产生NH+4,从而使菌落周围pH升高,使溴甲酚紫显紫色。纯化后细菌长出的菌落圆形且边缘整齐,在菌落上滴加酚酞,菌落呈微红色。根据平板分离结果证明,分离的菌株具有尿素分解能力。
2.2 初始pH值对细菌生长的影响
培养基初始pH值对细菌生长的影响见图1。当pH为6.0时,细菌生长受到严重抑制,OD600的最大值仅为0.681,且在12 h后细菌开始衰亡。在 pH 为 7.0、8.0、9.0、10.0 时,细菌均生长较快。在pH为7.0~9.0范围内,随着培养基初始pH值的增大,细菌浓度随之升高。而pH进一步升高到10.0时,细菌的生长又受到一定的抑制。相关研究[11-12]表明碱性条件下(pH=8.0~10.0),可得到的巴氏芽胞杆菌诱导碳酸钙沉淀量较大,其中pH值最适值处于8.3~9.0之间。本实验结果得出,在较宽范围的碱性条件(pH=8.0~10.0)下,分离的尿素分解菌长势良好,培养最适pH值为9.0,因此分离的菌株适用于MICP技术。
2.3 接种量对细菌生长的影响
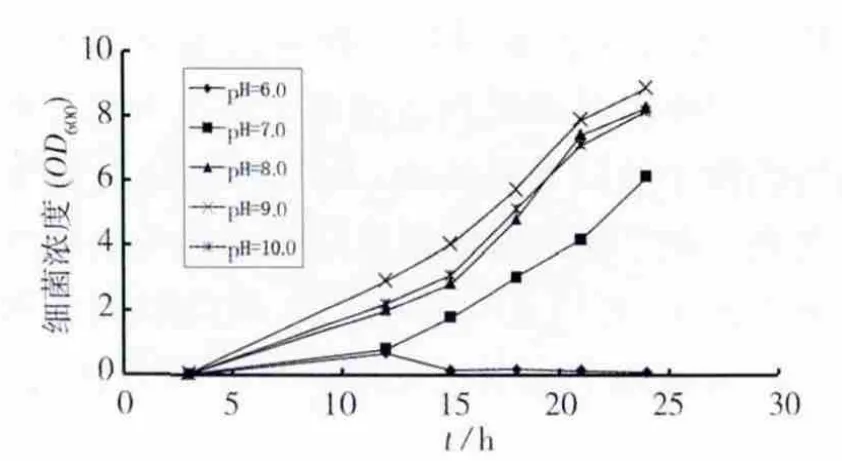
图1 初始pH值对细菌生长的影响Fig.1 Effect of initial pH on the growth of bacteria
接种量对细菌生长的影响见图2。在培养至15 h,接种量对细菌的生长无明显影响,15 h后,接种量为4%时,细菌生长最快,而10%时,细菌生长最慢。这可能是由于接种量过大,随菌液加入的代谢产物也增多,代谢产物对细菌的生长产生了抑制作用[13]。增大接种量,不但不经济,而且不能提高细菌的繁殖速度,对于分离的尿素分解菌,其最佳接种量为4%。
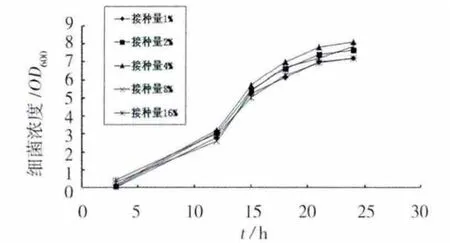
图2 接种量对细菌生长的影响Fig.2 Effect of inoculation volume on the growth of bacteria
2.4 温度对细菌生长的影响
培养温度对细菌生长的影响见图3。温度对细菌的生长有明显的影响,细菌在20℃时生长最为迟缓。在20~35℃范围内,随着温度上升,细菌生长速度随之加快。当温度提高到40℃时,细菌繁殖速度迅速下降,其繁殖速度比30℃时还低。结果表明,分离的尿素分解菌最适温度为35℃左右,其对高温和低温都较敏感。
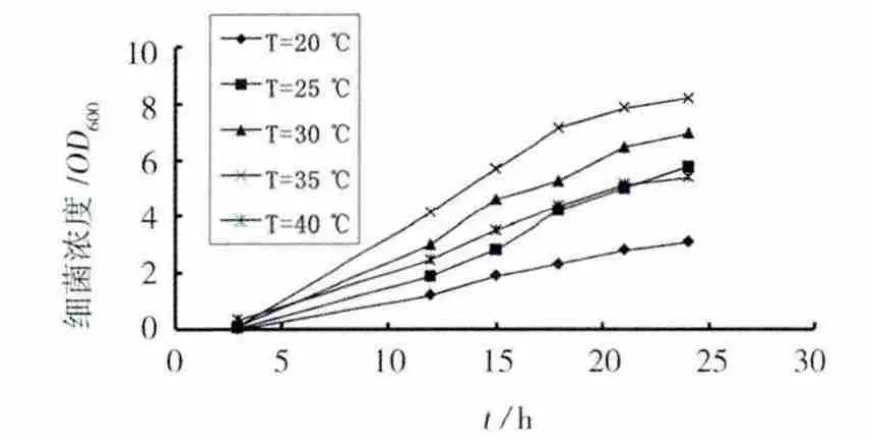
图3 温度对细菌生长的影响Fig.3 Effect of culture temperature on the growth of bacteria
2.5 摇床转速对细菌生长的影响
分离的尿素分解菌为好氧菌,提高摇床转速,可增加培养基中的溶解氧,有利于细菌的生长。但转速过高会产生较大的剪切作用抑制细菌生长,同时也会增加能耗。摇床转速对细菌生长的影响见图4。随着转速的提高,细菌生长繁殖增快,但转速提高至250 r/min后,生长速度有所下降,其最适转速为200 r/min左右。
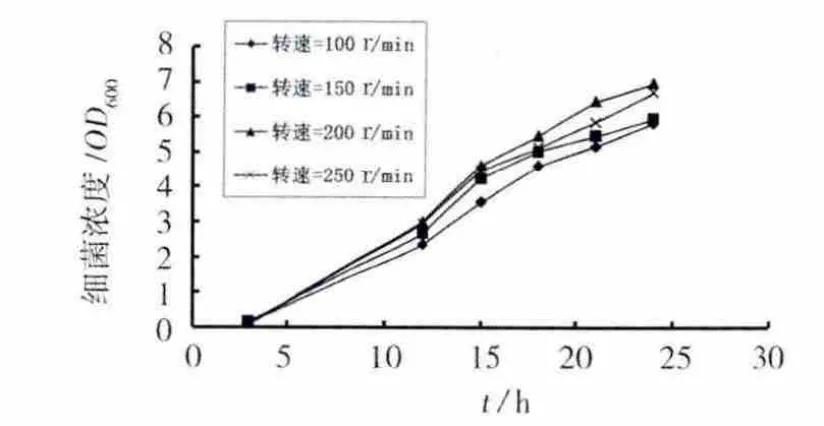
图4 摇床转速对细菌生长的影响Fig.4 Effect of rotation rate on the growth of bacteria
2.6 最适生长条件下细菌生长曲线
根据生长特性实验确定的最适合生长条件:初始pH值9,接种量4%,温度35℃,摇床转速200 r/min,测定了细菌生长曲线如图5。0~5 h内细菌生长缓慢,为延滞期;5 h后细菌生长速度急剧增加,进入对数期;12 h后曲线趋于平缓,进入稳定期;24 h后,生长呈下降趋势进入衰亡期。从生长曲线可以看出,细菌的衰亡期较长,且速度下降较慢,这可能是由于死亡的菌体不能完全自溶,而进行OD600值测量时无法对活菌进行单独测量而引起的误差所致。
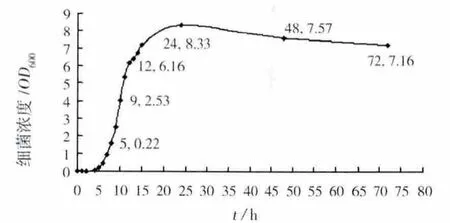
图5 最适生长条件下细菌生长曲线Fig.5 Growth curve under the suitable growth conditions
3 讨论
不同环境的微生物具有不同的生长特性,因而分离土著微生物并将其用于岩土工程的加固更具有实际意义。本研究采用富集培养和平板分离技术从土壤中分离出1株土著尿素分解菌,并研究了其生长特性,为MICP技术的研究提供了所需的菌株。
在进行岩土工程的原位加固时,由于土壤的环境条件(如温度、溶氧量等)不可能与微生物最适生长条件完全一致,因而如何使微生物在土壤中具有最大的活性以提高加固效果是MICP技术面临的一个重要课题。
温度是影响微生物生长繁殖的重要因素之一。在一定温度范围内,微生物的代谢活动与生长繁殖随着温度的上升而增加,而当温度上升到一定程度,就会抑制微生物的生长。每一种微生物都有其最适宜生长温度。由于受季节、地域等因素的影响,岩土介质的温度存在很大的差异性,因而提高微生物的环境适应性尤为重要。采用驯化、诱变、基因工程等育种手段对微生物进行改良可以提高其对环境温度的适应性,但也可能存在遗传稳定性和生态风险等问题[14]。而土著微生物长期生长在当地,对环境适应性强,无疑是首选的菌种[15]。
岩土介质的含氧量会随着深度的增加而减少,从而影响微生物的生长繁殖。因而,溶解氧的输送是应用MICP技术进行岩土工程原位加固的一个关键的限制性因素。目前,对MICP技术中溶解氧的输送问题尚无相关报道。采用H2O2和释氧化合物供氧可能是2种有效的供氧方式。采用H2O2供氧,加入方式简单,溶解氧浓度高,但H2O2的浓度过高对微生物有一定的毒性。研究表明[16],通过控制H2O2的浓度,可以使微生物不受损害,在满足微生物生长所需的溶解氧的同时,还可促进微生物的代谢。释氧化合物通过与水反应释放氧气的同时,使得体系的pH值升高,有利于碳酸钙沉淀的生成。
[1]Soon N W,Lee L M,Khun T C,et al.Improvements in engineering properties of soils through microbial-induced calcite precipitation[J].KSCE Journal of Civil Engineering,2013,17(4):718-728.
[2]Chou C W,Seagren E A,Aydilek A H,et al.Biocalcification of sand through ureolysis[J].Journal of Geotechnical and Geoenvironmental Engineering,2011,137(12):1179-1189.
[3]Cheng L,Cord-Ruwisch R.In situ soil cementation with ureolytic bacteria by surface percolation[J].Ecological Engineering,2012,42:64-72.
[4]Van Paassen L A,Ghose R,van der Linden T J M,et al.Quantifying biomediated ground improvement by ureolysis:large-scale biogrout experiment[J].Journal of geotechnical and geoenvironmental engineering,2010,136(12):1721-1728.
[5]Qian C X,Pan Q F,Wang R X.Cementation of sand grains based on carbonate precipitation induced by microorganism[J].Science China Technological Sciences,2010,53(8):2198-2206.
[6]Ng W S,Lee M L,Hii S L.An overview of the factors affecting microbial-induced calcite precipitation and its potential application in soil improvement[J].World Acad Sci Eng Technol,2012,62:723-729.
[7]沈吉云.微生物成因土工材料实验及应用研究[D].北京:清华大学,2009.
[8]李萌,程晓辉,杨钻,等.土壤中产脲酶细菌的分离及其在微生物砂浆制备中的应用[J].混凝土与水泥制品,2013,(8):13-16.
[9]Harkes M P,Van Paassen L A,Booster J L,et al.Fixation and distribution of bacterial activity in sand to induce carbonate precipitation for ground reinforcement[J].Ecological Engineering,2010,36(2):112-117.
[10]程晓辉,麻强,杨钻,等.微生物灌浆加固液化砂土地基的动力反应研究[J].岩土工程学报,2013,5(8):1486-1495.
[11]竹文坤,罗学刚.碳酸盐矿化菌诱导碳酸钙沉淀条件的优化[J].非金属矿,2012,35(3):1-4,8.
[12]黄琰,罗学刚,杜菲.微生物诱导方解石沉积加固的影响因素[J].西南科技大学学报,2009,24(3):87-93.
[13]施大林,孙梅,潘良坤,等.地衣芽胞杆菌培养条件的研究[J].微生物学杂志,2009,29(5):89-94.
[14]杨丽丽,尹宝华,侯文菊,等.芽孢杆菌诱变育种研究进展[J].山西农业科学,2012,40(7):804-806.
[15]Malcolm B.Burbank,Thomas J.Weaver,Tonia L.Green,et al.Precipitation of Calcite by Indigenous Microorganisms to Strengthen Liquefiable Soils[J].Geomicrobiology Journal,2011,28(4):301-312.
[16]李书良,焦鹏,曹竹安.流加H2O2对提高供氧及微生物代谢的影响[J].微生物学报,2002,42(1):129-132.
