杏鲍菇菌种遗传多态性的ISSR分析
2014-10-25刘艳玲李剑梅王艳华朱万芹
李 莹,李 莉,刘艳玲,李剑梅,王艳华,朱万芹
(1.沈阳农业大学土地与环境学院,辽宁 沈阳 110086;2.辽宁省微生物科学研究院,辽宁 朝阳 122000)
杏 鲍 菇 (Pleurotus eryngii(DC.et.Fr.)Quèl.)又名刺芹侧耳,因其主要发生于伞形花科(Umbelliferae)、刺芹属(Eryngium)、刺芹(Eryngium campestre)枯死的植株根上而得名,是一类分布广范的木腐生真菌,主要分布于北非、南欧、中亚地区的高山、草原、沙漠地带,在我国新疆、青海、四川等地也有分布[1]。其子实体含有丰富的营养成分,具有重要的经济价值,是近年来开发栽培成功的集食用、药用、食疗于一体的珍稀食用菌[2]。简单序列重复区间扩增多态性(Inter-simple Sequence Repeat,ISSR)是 Zietkiewicz等基于SSR技术发展起来的一种新型的微卫星类分子标记技术,其基本原理是在SSR序列的3'端或5'端加锚1~4个随机的碱基为引物,对两侧具有反向排列的简单序列间的基因片段进行扩增[3]。ISSR分子标记技术适用于任何物种,可同时提供多位点信息,并揭示不同位点个体间变异的信息[4],该标记通常为显性标记,符合孟德尔遗传,稳定性和可重复性高,引物具有通用性[5]。由于ISSR分子标记技术能够从基因水平揭示菌株间亲缘关系和遗传差异[6],并具有简单、快速、通用性好、稳定性高等优点[7],已在食用菌种质资源研究、菌株鉴别和菌株遗传多样性等方面得到了广泛应用[8]。本实验利用ISSR分子标记技术对20株杏鲍菇菌种进行遗传多样性分析,可为杏鲍菇遗传资源的保护、利用及育种奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种 本实验共收集了20株杏鲍菇菌种(表1),其中12株是保藏菌种(编号1~12),8株是工厂化栽培菌种(编号13~20)。
表1 20株杏鲍菇菌种Table 1 20 strains of Pleurotus eryngii
1.1.2 PDA综合培养基(g/L) 马铃薯200,葡萄糖 20,琼脂 15,蛋白胨 5,KH2PO43,MgSO41.5,VB11 片。
1.1.3 主要试剂和仪器 电泳仪(DDY-III,北京六一仪器厂),手动型生物安全柜(SPX-safe-1200,上海博迅实业有限公司医疗设备厂),PCR仪(Applied Biosystems GeneAmpPCR System 2700),CTAB(天津博迪化工有限公司),Tris碱(国药集团化学试剂有限公司),Taq DNA聚合酶、dNTP、琼脂糖(北京康为世纪公司生物科技有限公司),ISSR引物(北京华大基因)。
1.2 方法
1.2.1 菌丝培养 将纯化的20株杏鲍菇菌种接于PDA综合培养基中,25℃培养。菌丝长满后,刮下菌丝放入-20℃冰箱保藏备用。
1.2.2 DNA提取 供试菌种基因组DNA的提取采用 CTAB 法[9]。收集菌丝约 0.2 g,置于 1.5 mL离心管中,加入0.2 g灭菌的石英砂,研磨5~10 min,再加入500 μL 65 ℃预热的2 ×CTAB,65℃水浴60 min,每隔5~10 min颠倒1次;加500 μL氯仿 ∶异戊醇(24∶ 1),颠倒混匀10 min,12000 r/min,4℃离心10 min,取上清,加等体积氯仿∶异戊醇(24∶1),混匀,12000 r/min,4℃离心10 min,重复1次;取上清加入2/3体积的-20℃异丙醇,1/10体积的3 mol/L NaAc(pH 5.2),混匀,-20℃放置90 min至过夜;12000 r/min,4℃离心 10 min,出现沉淀,弃液相,加入-20℃的75%乙醇500 μL,上下颠倒洗涤,重复1次;弃乙醇,晾干,加入 100 μL TE 溶解 DNA,-20℃保存备用。
1.2.3 ISSR-PCR扩增 按照DNA序列的排列规律,加拿大哥伦比亚大学(University Of British Columbia,UBC)公布了一套(100条)ISSR引物,可针对研究材料选择合适的引物[10]。本实验从UBC提供的引物序列中选择了22条ISSR引物(表2),交由华大基因合成。由于可能缺乏同源位点,导致ISSR扩增无产物,为了简化实验并得到清晰有效的ISSR分子标记,以杏1、杏9为DNA模板,对22条引物进行了初步筛选以及ISSR-PCR反应体系的优化。通过筛选得到扩增条带清晰、反应稳定、多态性丰富的ISSR的引物,并对20株杏鲍菇菌种进行ISSR-PCR扩增。
25 μL 反应体系:10 ×Taq PCR Buffer 2.5 μL,dNTP 2 μL,Primer 2 μL,Taq DNA 聚合酶 0.5 μL,DNA 模板 1.5 μL,ddH2O 16.5 μL。PCR 扩增程序:94 ℃预变性4 min,94 ℃变性30 s,退火45 s,72℃延伸2 min,35个循环,72℃延伸7 min。PCR产物用含有0.1 μL/mL嗅化乙锭(EB)的1.0%的琼脂糖凝胶进行电泳,100 V恒压30 min,电泳缓冲液为1×Tris-乙酸(TAE),拍照记录。
表2 ISSR引物序列(5'~3')Table 2 ISSR primer sequences(5'~3')
1.2.4 ISSR-PCR 数据统计分析 以“0”和“1”的方式记录电泳结果条带的位置,有条带赋值“1”,无条带赋值“0”,构建0/1初始数据矩阵,在NTSYSpc 2.10e 软件中,Similarity-Qualitative data程序的SM计算品种的遗传相似系数,Clustering-SHAN程序中的非加权组平均法(Unweightedpairgroup method with arithmetic means,UPGMA)进行聚类分析,通过Graphics-Tree plot程序构建20株杏鲍菇菌种的聚类分析图谱。
2 结果与分析
2.1 ISSR多态性分析
通过对22条引物的初步筛选以及ISSR-PCR反应体系的优化,得到 11 条(807、810、818、826、835、836、840(图1)、841、842、889、891)扩增条带清晰、反应稳定、多态性丰富的ISSR引物,每条引物的扩增实验均重复3次,以保证准确性。结果显示,每条引物对不同菌种扩增的DNA条带数目不等,在2~9条之间,产物片段大小在100~5000 bp之间。11个引物共获得74个ISSR标记位点,多态性位点51个,多态比率为68.92%,平均每个引物扩增出6.73个位点。
2.2 遗传相似性分析
菌株间的遗传相似系数(geneticsimilarity,GS)是指两个体间共同分子标记位点占两个体总位点的比率,用于衡量两个体间遗传差距的大小。结果显示(表3),20株杏鲍菇菌种的遗传相似系数变异范围为0.53~0.95,遗传差异变化较大,遗传背景丰富。杏3与DM2、杏6与杏9、杏3寿与杏1(内)两两之间的相似系数最大为0.95,表明它们之间的遗传差异最小,亲缘关系最近;杏5X-42与杏丰68的相似系数最小为0.53,说明二者的遗传差异最大,亲缘关系最远。
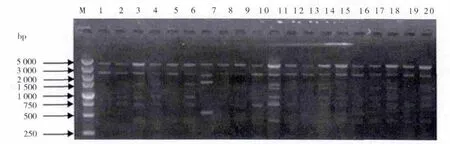
图1 ISSR引物840对20株杏鲍菇菌种的扩增图谱Fig.1 The ISSR profiles of 20 strains of Pleurotus eryngii by primer 840
2.3 ISSR聚类分析
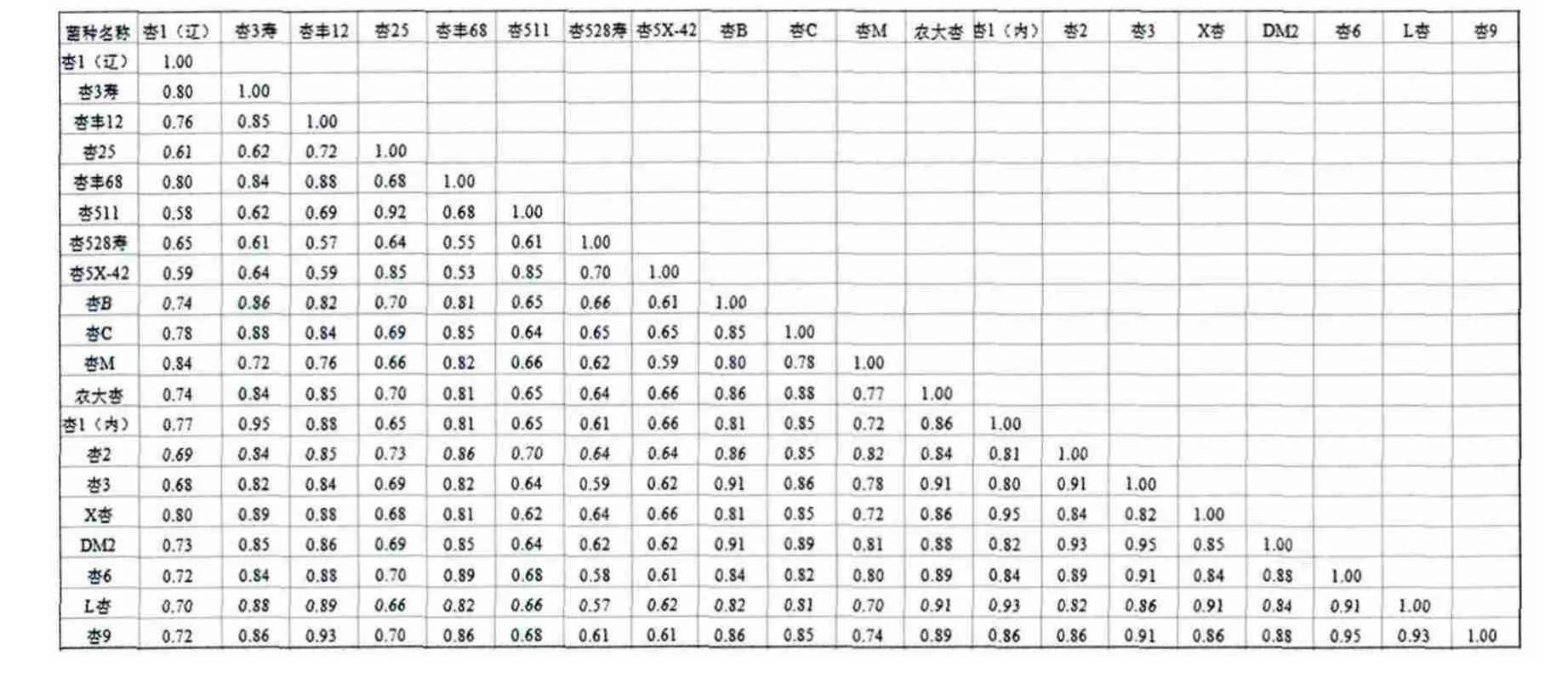
表3 20株杏鲍菇菌种间的相似系数Table 3 Similarity coefficients among 20 strains of Pleurotus eryngii
电泳图谱中的每1条扩增条带均代表了引物与模板DNA互补的一对结合位点,同一引物扩增的产物中电泳迁移率一致的条带被认为属于同一位点[11]。结果显示(图2),20株杏鲍菇菌种的相似系数在0.62~0.95之间,当遗传相似系数为0.828时聚为4个类群,遗传相似系数为0.896时聚为12个类群,其中杏528寿与其他菌种的亲缘系数最远,具有独立的遗传体系。遗传相似系数大说明二者的遗传差异小,当遗传相似系数为0.95时,来源地不同的杏1(内)与X杏、杏6与杏9,及来源地相同的杏3与DM2,两两之间亲缘关系较近,可能为同种异名[12],说明ISSR分组与菌株的不同地理来源之间无明显的相关性,同时也说明菌种命名存在同种异名和同名异种的混乱现象,通过分子标记的方法进行分析,为杏鲍菇品种鉴定提供借鉴,有助于规范杏鲍菇菌种市场,保护广大种植户的利益。
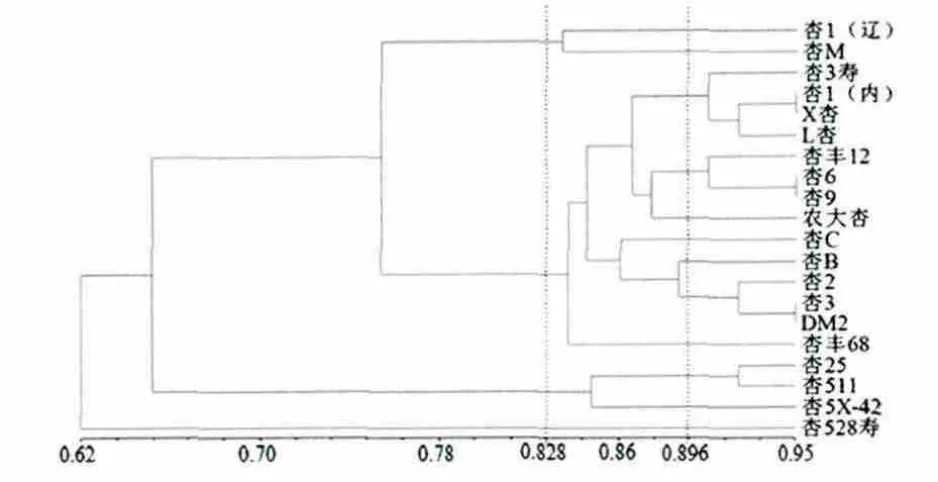
图2 20株杏鲍菇菌种的ISSR遗传分析聚类图Fig.2 Dendrogram of cluster among 20 Pleurotus eryngii strains based on ISSR analysis
3 讨论
分子标记是以生物个体间核苷酸序列变异为基础的遗传标记,在生物发育的不同阶段,不同组织的DNA都可用于标记分析,受外界环境的影响较小[13]。ISSR分子标记是一种新型的DNA分子标记技术,由于其具有快速、稳定、重复性好、通用性强等优点而被广泛应用于种质资源鉴定、遗传作图、基因定位、系统发育等方面,尤其是在品种鉴定和亲缘关系分析方面,因其具有较高的多态性,可有效地进行种间、种内亲缘关系的鉴定。
本实验从22条引物中筛选出11条扩增条带清晰、多态性好的ISSR引物,这11条引物均为二核苷酸的重复序列,说明在选择ISSR引物时,应以二核苷酸重复序列为主,少选寡聚三核苷酸、四核苷酸重复序列的引物。对20株杏鲍菇菌种进行11条引物的ISSR-PCR扩增,共获得74个标记位点,其中有 51个多态性位点,多态性为68.92%。聚类分析的结果表明,当系数为0.896时,20株菌种被分为12个类群,杏528寿与其他菌株亲缘系数最远,具有独立的遗传体系。实验表明,ISSR分子标记能较好地反映杏鲍菇菌种间丰富的遗传多样性,进一步为ISSR标记在杏鲍菇遗传多样性上的应用提供理论依据。
[1]中国科学院青藏高原综合科学考察队.横断山区真菌[M].北京:科学出版社,1996:334.
[2]郭美英.珍稀食用菌杏鲍菇生物学特性的研究[J].福建农业学报,1998,13(3):44-49.
[3]Zietkiewicz E,Rafalski A,Labuda D.Genome fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J].Genome,1994,20(2):176-183.
[4]边银丙,宋小亚.几种新型DNA分子标记及其在食用菌研究中的应用[J].食用菌学报,2006,1(l):78-81.
[5]Tusumura Y,Ohba K,Strauss S H.Diversity and inheritance of inter-simple sequence repeatpolymorphisms in Douglas-fir(Pseudotsuga menziessii)and sugi(Cryptomeria japonica)[J].TheorAppl Genet,1996,92:40-45.
[6]冯伟林,蔡为明,金群力,等.ISSR分子标记分析杏鲍菇菌株遗传差异研究[J].中国食用菌,2009,28(1):47-49.
[7]黎裕,贾继增,王天宇.分子标记的种类及其发展[J].生物技术通报,1999,15(4):19-22.
[8]宫志远,任海霞,姚强,等.35个山东主栽平菇菌株的ISSR遗传差异分析[J].基因组学与应用生物学,2010,29(3):507-512.
[9]秦莲花,张红,陈明杰,等.微卫星(TATG)n基序在香菇菌种中的验证[J].微生物学报,2004,44(4):474-478.
[10]张青林,罗正荣.ISSR及其在果树上的应用[J].果树学报,2004,21(1):54-55.
[11]刘华晶,许修宏,李春艳,等.ISSR和 ITS分子标记在黑龙江省野生黑木耳遗传多样性上的应用[J].东北农业大学学报,2012,43(8):94-100.
[12]唐利华,肖扬,边银丙.中国黑木耳主要栽培菌株ISSR指纹分析及 SCAR 标记[J].菌物学报,2008,27(2):243-251.
[13]马富英,罗信昌.分子标记在食用蕈菌遗传育种中的应用[J].菌物系统,2002,21(1):147-151.
