海洋链霉菌Streptomyces sp.B-17卤化酶基因的克隆及生物信息学分析
2014-10-25薛永常蔡宏明
薛永常,蔡宏明,李 根
(大连工业大学生物工程学院,辽宁 大连 116034)
放线菌是生理活性物质尤其是天然药物的重要来源。海洋放线菌因其在高盐、高压、低温、低氧、低光照和寡营养的选择压力下可能会调整其次生代谢途径,从而产生并积累具有特殊化学结构和生物活性的功能物质,成为研究抗生素的重点来源菌株,1998年以来从海洋放线菌中发现的新药数量连年均超过了陆地放线菌[1-3]。在抗生素生物合成途径中,卤化酶催化的卤化作用起着重要的作用[4-6],而放线菌的次生代谢产物的卤化更极大提高了代谢产物的抑菌活性,此卤化过程常常是通过依赖FADH2的卤化酶催化[7]。第一个卤化酶是从卡尔里霉素的产生菌Caldariomyces fumago中发现的,此后又陆续发现分离到了其他一些含血红素的氯化、溴化和碘化过氧化酶[8]。研究发现,海洋链霉菌产生的卤化酶具有催化次生代谢物卤化的遗传和生理潜力[9-10],因此从海洋链霉菌中筛选FADH2依赖性卤化酶基因,对于探讨卤化酶的催化机理具有重要的意义。本文是在前期已对大连海域海洋放线菌多样性及分类鉴定[11]进行探讨的基础上,从分离鉴定的链霉菌Streptomyces sp.B-17基因组 DNA中扩增出FADH2依赖性卤化酶基因片段,并分析其生物信息学特征,以期对海洋链霉菌的综合利用及卤化药物的基因定向筛选提供指导意义。
1 材料与方法
1.1 材料
1.1.1 实验用链霉菌 自大连海域海泥中分离纯化,并经16S rDNA鉴定的菌株Streptomyces sp.B-17[11]。
1.1.2 试剂 细菌基因组DNA提取试剂盒(溶液型)购自北京百泰克生物技术有限公司,超薄琼脂糖凝胶 DNA回收试剂盒(离心柱型)、DNA Marker、dNTP、Taq DNA polymerase、X-Gal、IPTG 和Amp购自天根科技(北京)有限公司,pMD-19T载体、内切酶Hind III、Cla I购自宝生物(大连)生物工程有限公司。
1.2 方法
1.2.1 基因组DNA的提取及卤化酶基因的PCR扩增 链霉菌基因组DNA提取按细菌基因组DNA提取试剂盒(溶液型)方法。卤化酶扩增引物采用Hornung[12]等设计的色氨酸-7-卤代酶特异引物 P1和 P2:引物:P1:5'-TTCCCSCGSTACCASATTCGGSGAG-3',P2:5'-GSGGGATSWMCCAGWACCASCC-3'。PCR扩增体系:PCR反应体系为10 × Taq reaction buffer 2 μL,dNTP(2.5 mmol/L)1 μL,P1、P2(10 μmol/L)各 0.7 μL,基因组 DNA 1 μL,Taq DNA polymerase(2.5 U/μL)0.4 μL,ddH2O补足20 μL;其扩增条件:预变性95℃ 3 min;变性94℃ 30 s,退火57℃ 45 s,延伸72℃90 s,共35个循环;扩增产物进行1%琼脂糖凝胶电泳,利用凝胶成像系统观察电泳结果。
1.2.2 PCR产物的回收及目的片段与pMD-19T载体的连接及转化 PCR产物回收按照超薄琼脂糖凝胶DNA回收试剂盒(离心柱型)说明书进行。与pMD-19T载体的连接参考T载体说明书,大肠埃希菌感受态细胞制备及质粒转化参考文献[13]。
1.2.3 重组质粒的鉴定及序列分析 利用特异引物对重组质粒进行扩增,同时利用pMD-19T载体克隆位点两侧的Hind III、Cla I对重组质粒进行双酶切鉴定并测序。应用ClustalX 2.0、DNAMAN、MEGA4.1等在线分析工具和软件分析目的片段的序列,进行比对分析和构建进化树。
2 结果与分析
2.1 目的片段的PCR扩增及其鉴定
以P1、P2为引物,B-17菌的基因组 DNA为模板进行梯度PCR,以确定最适退火温度,结果见图1。从图1可以看出,3号和10号泳道在约600 bp处扩增出较清晰整齐的条带,其大小与预期目的片段一致,因此选择56℃为最佳退火温度,经优化最终PCR产物经1.0%的琼脂糖凝胶电泳,见图2。
回收约500 bp左右的目的扩增片段,与pMD-19T载体进行连接,转化大肠埃希菌JM109感受态细胞,在含有X-Gal、Amp和IPTG的LB固体培养基上进行培养,筛选白色单菌落提取质粒进行电泳,在约3 kb处有1条清晰整齐的DNA条带,为重组质粒DNA的电泳条带;重组质粒经特异引物扩增(图3)及Hind III/Cla I双酶切鉴定(图4),证明插入到pMD-19T载体的DNA为目的片段,将所得质粒进行测序鉴定。
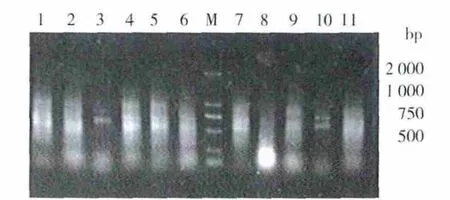
图1 B-17基因组DNA的PCR退火温度优化的电泳图谱Fig.1 Agarose gel electrophoresis of optimization of PCR annealing temperature of DNA extracted from B-17
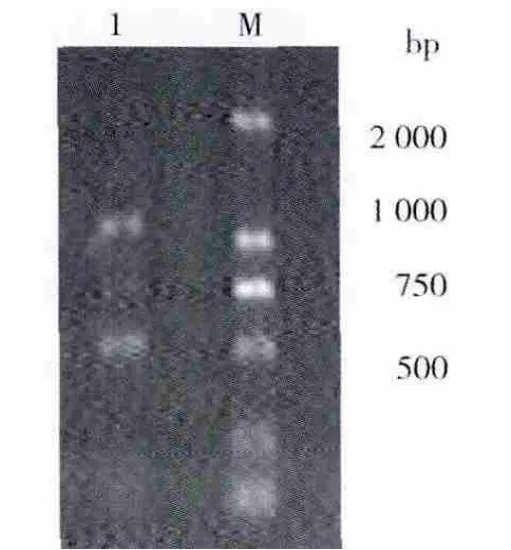
图2 扩增DNA片段电泳图谱Fig.2 Agarose gel electrophoresis of amplified DNA fragment from B-17 Genomic DNA
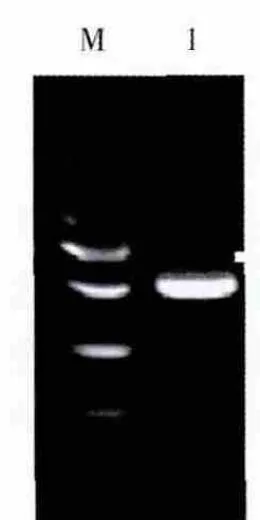
图3 重组质粒的PCR扩增图Fig.3 Agarose gel electrophoresis of amplified fragment from the recombinant plasmid DNA
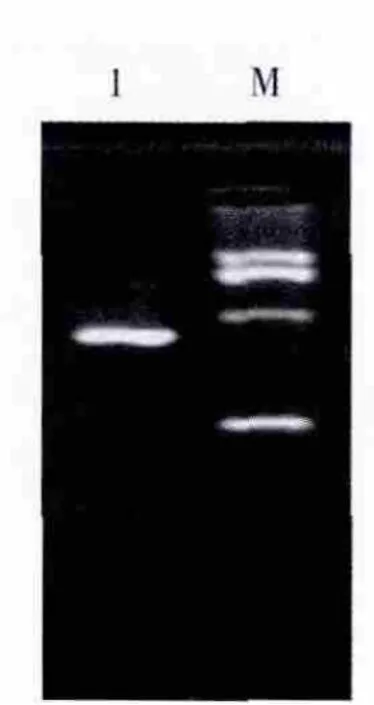
图4 重组质粒的酶切电泳图Fig.4 Agarose gel electrophoresis of the recombinant plasmid DNA cut by Hind III and Cla I
2.2 目的片段的生物信息学分析
重组质粒测序结果表明该扩增片段大小为524 bp,与预期片段大小一致,且正向插入到pMD-19T载体,证明是插入片段为目的 DNA片段。
应用Clustal X 2.0软件将该序列与从NCBI数据库中已登陆的11个卤代酶基因进行同源性比对,并用MEGA4.1采用邻接法(NJ法)构建进化树(图5)。结果显示,所得序列的同源性与一种未鉴定菌种U.microorgainism拟表达卤代酶序列较为相近。
将克隆片段序列利用NCBI在线工具nucleotide blast进行同源序列搜索,结果发现克隆片段与Actinocorallia herbida DSM 44252依赖FADH2的2个卤化酶基因的同源性为88%(图6),与Clum,A等(2010)发表的 Pirellula staleyi DMD 6068编码色氨酸卤化酶基因序列(CP001848)的相似性也达到74%,证明所克隆的基因片段为卤化酶基因片段。
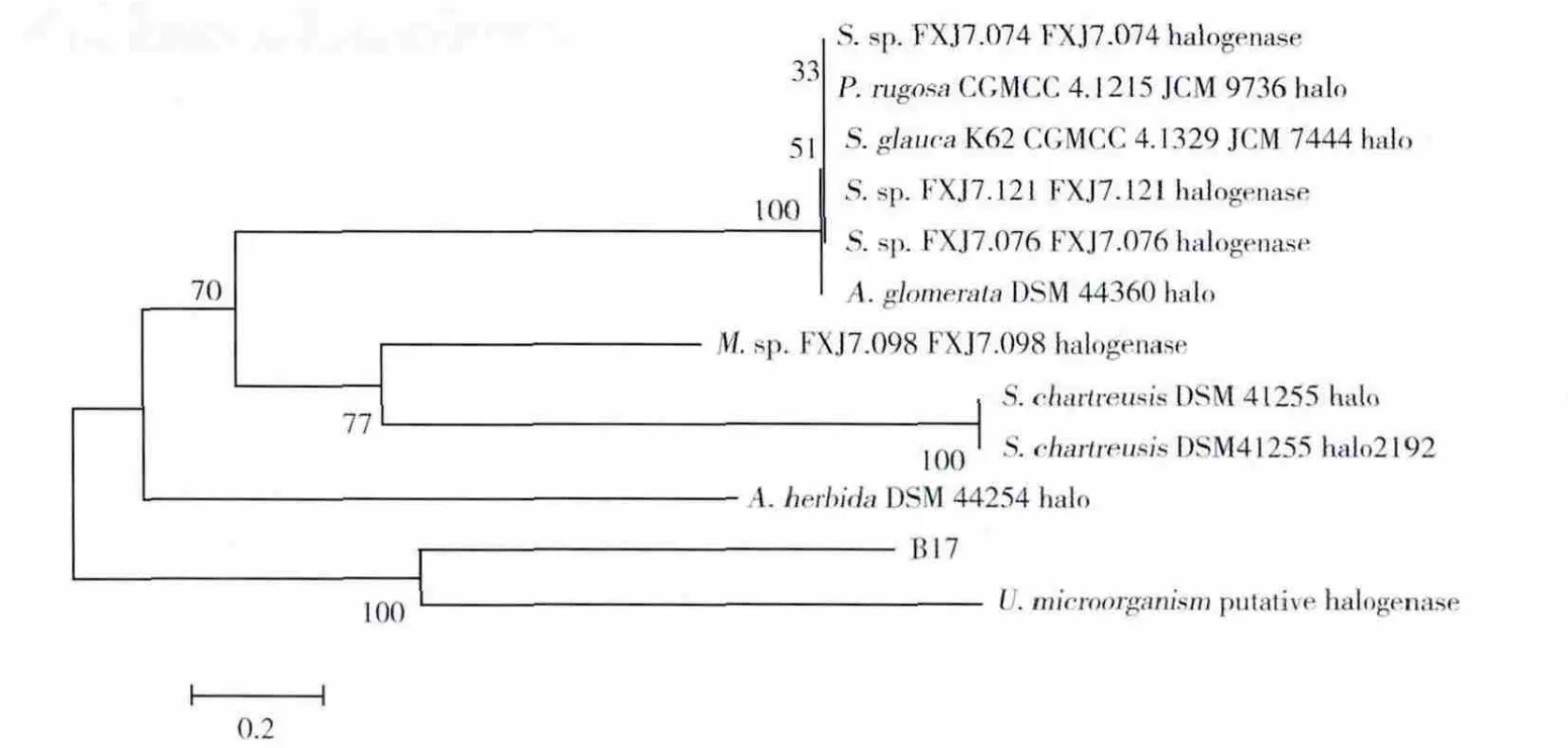
图5 目的基因序列与其他卤代酶基因的NJ进化树分析Fig.5 NJ phylogenetic tree based on the relationship of target gene sequence with other halogenase generated by MEGA4.1 program
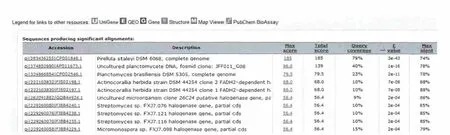
图6 序列在BLAST的比对结果部分图Fig.6 Part result of sequences in the BLAST
利用NCBI在线ORF fider软件,对克隆片段核苷酸序列进行分析,将DNA序列翻译为氨基酸序列,其编码的氨基酸序列为:

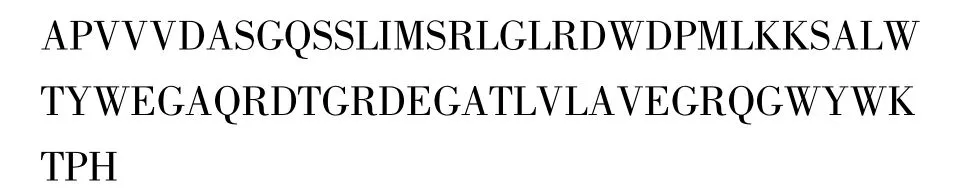
将该片段拟表达的氨基酸序列与模板序列进行同源性比较,结果见图7。在163个氨基酸中有116个相同,同源性达到71%。

图7 克隆的卤代酶基因拟表达氨基酸序列比对Fig.7 Alignment of predict halogenase amino acid sequence with the sequences from tryptophan halogenase
3 讨论
从核苷酸序列和氨基酸序列的比对及同源性分析可以看出,本研究所克隆的序列和已发现的卤代酶序列有极高的同源性,蛋白质比对重复性也达到了71%,所以本实验中从B-17基因组内克隆到的基因片段可初步断定为卤代酶基因片段,为后续的基因功能分析及表达奠定了基础。但是此结果与高鹏等[9]分离得到的大多卤化酶在氨基酸序列上与已知卤化酶明显不同的实验结果不一致,因此需要研究更多的实验材料才能得出统计学数据。同时,海洋放线菌作为未来重要的抗生素产生来源菌,其产生的卤化酶又具有催化产生新的卤代产物的潜力,从海洋放线菌可能更容易分离到新的卤代化合物,这就为新的生理活性物质的筛选提出了新的方向。
[1]李航,朱丽,陈代杰.参与抗生素生物合成的FADH2依赖型卤化酶研究进展[J].中国抗生素杂志,2010,35(l):1-6.
[2]马艳玲,邓海,魏菁菁,等.稀有海洋放线菌Salinispora arenicola非核糖体肽合成酶和卤代酶生物合成基因簇核心区的克隆及序列分析[J].生物技术通报,2011,2:157-162.
[3]罗明和,汪中文,黄洪波,等.海洋链霉菌 Streptomyces sp.SCSIO1672及其代谢产物水杨酸的分离鉴定[J].微生物学杂志,2010,30(6):22-26.
[4]Wynands Ina ,van Pée Karl-Heinz.A novel halogenase gene from the pentachloropseudilin producer Actinoplanes sp.ATCC 33002 and detection of in vitro halogenase activity[J].FEMS Microbiology Letters,2004,237:363-367.
[5]Dorrestein Pieter C.,Yeh Ellen,Garneau-Tsodikova Sylvie,et al.Dichlorination of a pyrrolyl-S-carrier protein by FADH2-dependent halogenase PltA during pyoluteorin biosynthesis[J].PNAS,2005,102(39):13843-13848.
[6]Foulston Lucy C.,Bibb Mervyn J.Microbisporicin gene cluster reveals unusual features of lantibiotic biosynthesis in actinomycetes[J].PNAS,2010,107(30):13461-13466.
[7]Eustáquio Alessandra S,Pojer Florence,Noel Joseph P,et al.Discovery and characterization of a marine bacterial SAM-dependent chlorinase[J].Nat Chem Biol.,2008,4(1):69-74.
[8]Murphy C.D.New frontiers in biological halogenation[J].Journal of Applied Microbiology,2003,94,539-548.
[9]高鹏,郗丽君,朴玉华,等.不同生境放线菌的卤化酶基因分析及其对卤代产物筛选的意义[J].微生物学报,2009,49(10):1367-1373.
[10]Gao Peng,Huang Ying.Detection,distribution,and organohalogen compound discovery implications of the reduced flavin adenine dinucleotide-dependent halogenase gene in major filamentous actinomycete taxonomic groups[J].Applied and Environmental Microbiology,2009,75(14):4813-4820.
[11]薛永常,蔡宏明,唐婧媛,等.大连海域海洋放线菌多样性及分类鉴定初探[J].微生物学杂志,2013,33(4):30-33.
[12]Hornung Andreas,Bertazzo Marcelo,Dziarnowski Agnieszka,et al.A genomic screening approach to the structure-guided identification of drug candidates from natural sources[J].Chem-BioChem,2007,8:757-766.
[13]Sambrook J著,黄培堂(译).分子克隆实验指南(第3版)[M].北京:科学出版社,2008.
