1株耐氯霉素腐败微生物的16S rRNA基因序列与碳源代谢指纹图谱分析
2014-10-25王友升何欣萌陈玉娟
王友升,何欣萌,张 燕,陈玉娟
(北京工商大学食品学院食品质量与安全北京实验室北京市食品风味化学重点实验室,北京 100048)
虽然化妆品产品设计时普遍采用防腐挑战试验,模拟生产、使用过程中受到高强度的微生物污染的潜在可能性,避免由微生物污染造成的损失[1],但不同类型、不同地区产品的污染菌及优势菌株并不完全相同。为了解特定产品中的主要腐败微生物,有针对性地控制微生物污染,常需要从染菌的产品中分离腐败微生物,并加以鉴定。编码原核生物核糖体小亚基rRNA(16S rRNA)的基因包含10个可变区(variable region)和11个恒定区(constant region),大小约为1500 bp,所含信息量大且序列高度保守,可变区因细菌而异,能揭示生物物种特征核酸序列,是细菌种属鉴定的分子基础[2-3]。Biolog鉴定系统以四氮唑紫为指示剂,微生物利用或氧化碳源时四氮类染料从无色还原为紫色,从而在鉴定板上形成该微生物的特征代谢模式或指纹,常用于病原菌检测鉴定等[4]。本研究对某化妆品公司提供的已腐败变质的膏霜样品进行了微生物的分离纯化,获得了1株具有氯霉素抗性的革兰阴性菌,并通过16S rRNA基因序列表分析和Biolog系统进行了鉴定。
1 材料与方法
1.1 材料
1.1.1 菌种来源 菌种来自上海某化妆品公司提供的腐败膏霜样品。将污染样品进行梯度稀释铺板,取单菌落划线,分离到1株光滑、整齐的菌落,命名为213#。
1.2 方法
1.2.1 菌落及菌体形态观察 将分离菌同时在营养琼脂培养基和孟加拉红培养基(含氯霉素100 μg/mL)上划线,分别于37和28℃培养,24、48 h后观察菌落生长情况及菌落形态。通过革兰染色、显微镜检观察菌体形态。
1.2.2 基因组 DNA的提取和16S rRNA基因PCR扩增及序列测定 将213#菌株接种于LB液体培养基中,37℃、200 r/min振荡培养12 h。过滤收集菌体,洗涤,CTAB/NaCl法提取基因组DNA作为PCR反应的模板。1%琼脂糖凝胶电泳法检测模板DNA的质量。以细菌保守序列16S rRNA基因的通用引物,27f和1492r扩增细菌16S基因序列。其中27f:5'-AGAGTTTGATCCTGGCTCAG-3'和1492r:5'-GGTTACCTTGTTACGACTT-3',50 μL 体系 PCR 扩增:模板 5 μL;10 × 扩增缓冲液 5 μL;dNTP(2.5 mmol/L)4 μL;引物 (10 μmol/L)各2 μL;Taq DNA 聚合酶 (2.5 U/μL)2 μL;DMSO 3 μL;无菌超纯水补足总体积 50 μL。PCR反应程序:94℃预变性3 min,94℃变性1 min,61 ℃ 退火 1 min,72 ℃ 延伸 1 min,30 个循环。然后,72℃延伸10 min,使反应产物扩增充分。取5 μL PCR产物加1 μL 6×溴酚蓝上样缓冲液,在1.0%琼脂糖凝胶上180 V电泳30 min进行检测,EB染色后于紫外灯下观察电泳条带,送样测序。
1.2.3 序列比对和系统发育树的构建 PCR产物经脱盐纯化后,由华大基因公司进行测序。将测序结果在GenBank数据库中进行同源序列搜索。根据同源序列搜索结果,提取相关模式菌株的ITS区基因序列,与实验菌株序列一起用Clustal X软件进行匹配排列(align),用 MEGA3.1软件按照相关参数和模型进行进化树的构建。
1.2.4 碳源代谢指纹图谱分析 待鉴定菌种用Biolog推荐的BUG培养基培养24 h,用GN/GP-IF接种液配制菌悬液,调节T=52%,在GN2微孔板中每孔加150 μL菌悬液,保持一定湿度,30℃培养24 h后读数,获得待鉴定菌的代谢指纹图谱。
2 结果与分析
2.1 在含氯霉素培养基上的生长情况
213#菌株在营养琼脂培养基上,24 h即可看到明显的菌落(图1a),在含有100 μg/mL氯霉素的孟加拉红培养基上培养48 h后,也出现明显生长 (图1b)。
2.2 基因组提取和PCR扩增
使用 CTAB/NaCl法提取213#菌株的 DNA(图2A)。以27f和1492r引物对16S rRNA基因保守序列进行扩增,获得PCR扩增片段在1500 bp左右(图2B)。
2.3 16S rRNA同源性比对与系统发育分析
图1 待鉴定菌株213#在营养琼脂培养基(a)和孟加拉红培养基(b)的生长情况Fig.1 Growth of strain 213#cultured on Nutrient agar(a)and Rose bengal medium(100 μg/mL chloramphenicol)(b)for 24 h and 48 h,respectively
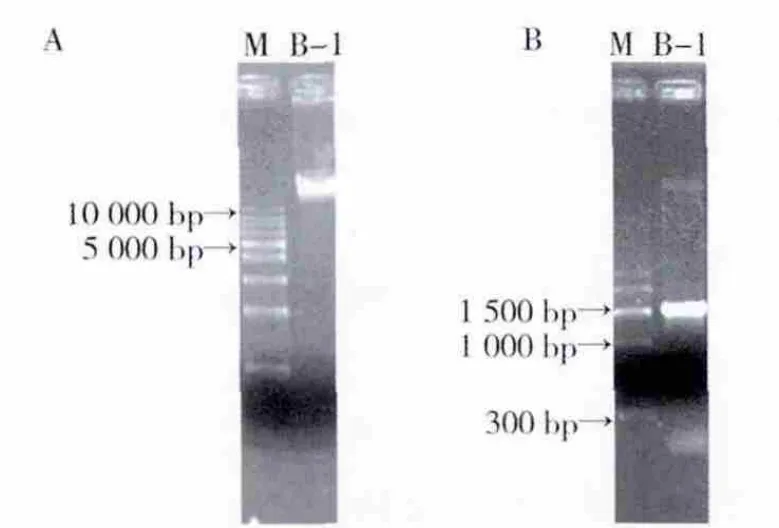
图2 菌株213#的DNA基因组(A)和16S rRNA基因PCR扩增(B)结果Fig.2 Electrophoretogram of total DNA(A)and PCR product(B)of 16S rRNA gene of strain 213#
213#菌株的上述PCR产物测序结果经Clustal X软件和MEGA3.1软件构建系统发育树(图3)。结果表明,213#菌株与Burkholderia cenocepa-cia、Burkholderia cepacia、Burkholderia anthina(B.andropogonis)、Burkholderia vietnamiensis和 Burkholderi apyrrocinia的同源性均在98.0%以上,其中与Burkholderia cepacia(GQ248182)在同一分枝上,且通过Bootstraps的验证表明它们具有较高的置信度,支持率可达100%。因此,可将分离菌株213#确定为洋葱伯克霍尔德菌(Burkholderia cepacia)。

图3 以16S rRNA基因序列为分子标记的细菌系统进化树Fig.3 Analysis of bacteria phylogenetic tree based on 16S rRNA gene sequence
2.4 碳源代谢指纹图谱分析
由表1可以看出,培养24 h后,菌株213#有最适碳源71种,不可利用碳源24种,无可利用碳源;Burkholderia cepacia有最适碳源76种,可利用碳源2种,不可利用碳源17种。二者对95种碳源的代谢指纹图谱相近,其中利用情况一致的碳源可达75种,包括 D-果糖、L-海藻糖、蔗糖等64种最适碳源,α-环式糊精、α-D-乳糖、麦芽糖等11种不可利用碳源,表明213#与Burkholderia cepacia有较近的亲缘关系。
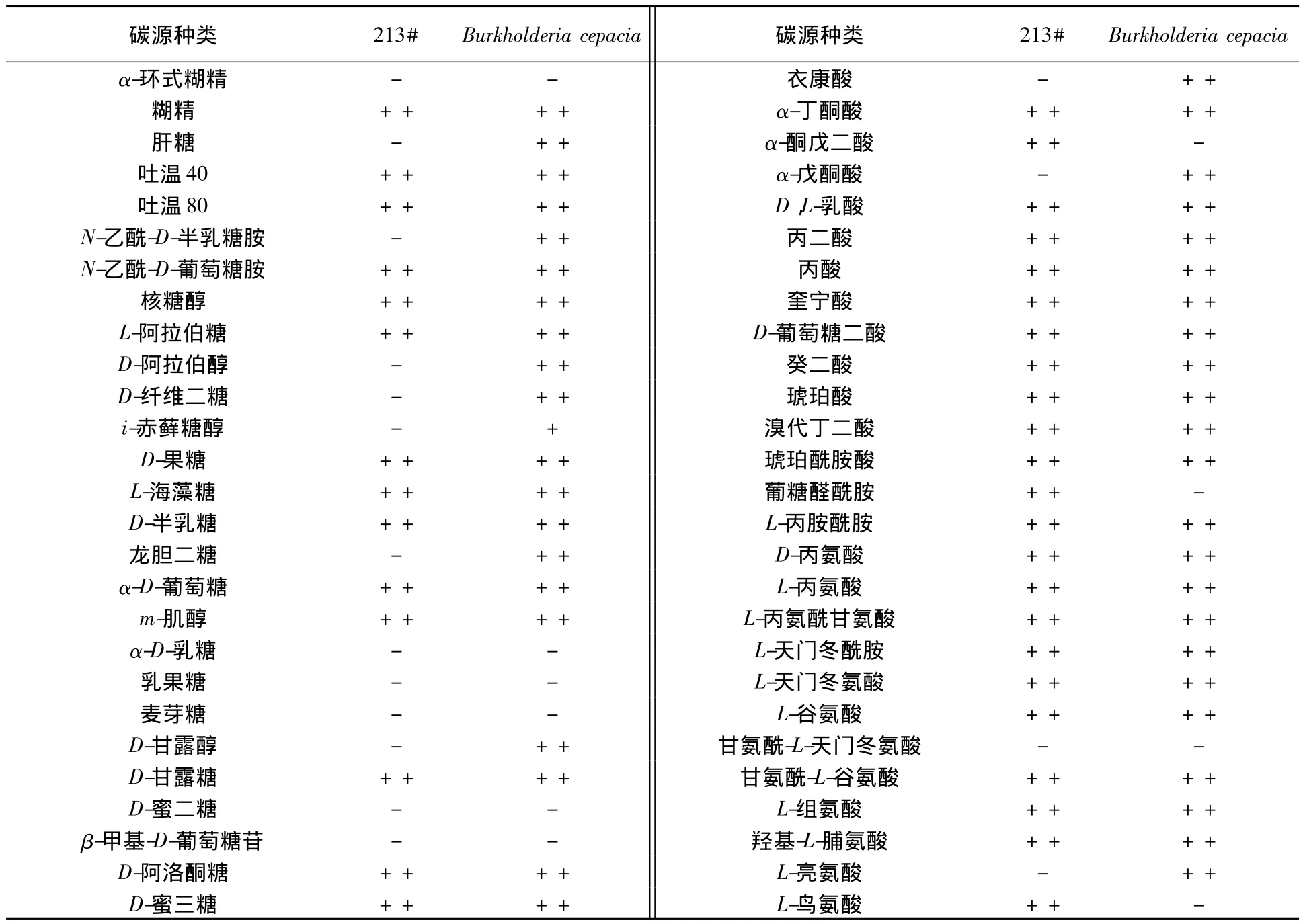
表1 菌株213#与标准菌株Burkholderia cepacia的碳源代谢指纹图谱Table 1 Carbon source metabolism analysis of strain 213#and the standard of Burkholderia cepacia

续表
3 讨论
据报道,洋葱伯克霍尔德菌原为植物病原菌,因引起洋葱球茎腐烂而得名,常存在于土壤、水和医院环境中,在动、植物组织中有定殖能力[5]。此外,该菌也可污染医院用水及器械,引起特殊人群的获得性感染[6]。但目前未见自腐败膏霜类化妆品中分离的报道。研究表明,B.cepacia外膜通透性差,阻碍亲水性抗生素通过,此外B.cepacia可产生 β-内酰胺酶[7],因而对大多数常用抗生素不敏感。有研究表明,洋葱伯克霍尔德菌引起的感染耐药程度较高[8],尤其是对氨基糖苷类抗菌药物具有很高的耐药性,对阿米卡星、庆大霉素和妥布霉素耐药率均 >80.0%[9]。
据推测,B.cepacia可能通过以下途径污染化妆品:①B.cepacia具有生物防治、生物降解和促进植物生长等多种功能[10],因此存在污染化妆品动植物性原料的潜在可能;②在生产环节中染菌,包括生产设备卫生、操作人员自身卫生等。
[1]施昌松,蔡晓真,张洪广,等.化妆品中微生物与防腐体系的构建[J].日用化学品科学,2006,29(12):12-16.
[2]陈国忠,李文均,徐丽华,等.16S rRNA二级结构的研究进展及其在系统分类中的应用[J].微生物学杂志,2005,25(5):54-57.
[3]何亮,陈群,曾忠铭,等.通过特异PCR扩增和16S rDNA序列分析检测动弯杆菌[J].微生物学报,2005,45(1):27-30.
[4]冯瑞华,樊蕙,李力,等.Biolog细菌自动鉴定系统应用初探[J].微生物学杂志,2000,20(2):36-38.
[5]Jones A M,Dodd M E,Webb A K.Burkholderia cepacia:current clinical issues,environmental controveresies and ethical dilemmas[J].Eur Respir J,2001,17(2):295-301.
[6]Bressler A M,Kaye K S,Lipuma J J,et al.Risk factors for Burkholderia cepacia complex bacteremia among intensie care unit patients without cystic fibrosis:a case-control study[J].Infect Control Hosp Epidemiol,2007,28(8):951.
[7]徐爱平,单伟国,胡庆丰.洋葱伯克霍尔德菌对m内酰胺类耐药性分析[J].实验与检验医学,2008,26(3):249-250.
[8]金法祥,李水法,王红华.80株临床分离洋葱伯克霍尔德菌的耐药性分析[J].中华感染学杂志,2008,18(10):1475.
[9]刘成,孙宁.洋葱伯克霍尔德菌感染33例临床及药敏分析[J].临床内科杂志,2004,21(3):208.
[10]Parke J L,Gurian·scherman D.Diversity of the Burkholderia cepacia complex and implications for risk assessment of biological control strains[J].Annual Review of Phytopathology,2001,39:225-258.
