survivin-siRNA重组腺病毒质粒与结直肠癌细胞剂量和时间的相关性
2014-09-13李日恒张爱民宋艳敏赵立华吴建飞谢天浩安宇亮程树杰
李日恒 张爱民 宋艳敏 赵立华 李 娟 张 娜 张 涛 陈 治 吴建飞 谢天浩 安宇亮 程树杰
(河北大学附属医院,河北 保定 071000)
结直肠癌发病是多基因、多因素共同参与的结果,其治疗除了手术、放化疗、中药等方法外,人们也积极致力于研究其他治疗方式,如基因治疗,其理论基础为癌基因与抑癌基因的失衡是导致肿瘤形成的重要原因。survivin是凋亡抑制蛋白家族(IAP)中的一员,在人的胚胎、胸腺、生殖腺、甲状腺、神经干细胞、结肠上皮细胞等正常组织少量存在,在多种恶性肿瘤组织中高表达,在人类正常分化的组织中不表达〔1~4〕。相关研究表明,survivin高表达的肿瘤预后差〔5~8〕。本研究通过RNA干扰(RNAi)技术将肿瘤相关基因survivin沉默,抑制结直肠癌细胞,探讨survivin-siRNA重组腺病毒质粒最佳抑制浓度和时间。
1 材料和方法
1.1材料 已构建成功的重组腺病毒质粒pBAsi-survivin,人类结直肠癌细胞株SW480(中国医学科学院肿瘤细胞库)培养基 RPMI1640,5%胎牛血清,0.25%胰酶(北京清大天一科技有限公司)。
1.2仪器 低温高速离心机(湖南湘立科技仪器有限公司),核酸电泳仪、电泳槽、垂直板电泳槽、电转仪(北京六一仪器厂),紫外分光光度仪(上海精密仪器有限公司)。PCR仪(Thermo 北京科誉兴业科技发展有限公司),Trizol试剂,PrimerScript 1st Strand cDNA Synthesis Kit试剂盒,survivin引物和内参GAPDH引物均由大连宝生物公司合成及提供。
凝胶成像系统(Biorad GelDoc XR 上海旦鼎国际贸易有限公司),水平摇床(上海乔跃电子有限公司)。PVDF膜,封闭液,洗脱液、脱脂奶粉,一抗、酶标二抗,显色液,显影定影液,蛋白提取液及相关抗体(碧云天生物研究所)。酶标仪(BIO-RAD 上海普林斯顿生物科技发展有限公司),DMSO、MTT液、96孔板(北京世纪奥利生物技术有限公司)。
1.3方法
1.3.1重组质粒构建及转染浓度、时间 靶向survivin 基因寡核苷酸的设计参考shRNA 的设计策略,选择survivin 基因(基因序号为NM_001168.2),survivin-shRNA的有效序列 GGCTGGCTTCATCCACTGC (86-104) 上游引物:5′-GTGTCACTAGGCGGGAACAC-3′;下游引物5′-TTATTCCCATGCGACGGTATC-3′,重组载体命名为pBAsi-survivin。经测序证实survivin重组腺病毒质粒成功构建。
将已经构建好的腺病毒由293T 细胞包装制备完成后,检测其病毒滴度,分别感染SW480细胞,将pBAsi-survivin 由腺病毒载体介导导入细胞内。按浓度分别为50、100、150、200、250、300 nmol/L,6个浓度梯度转染人类结直肠癌细胞株SW480,在最适浓度下检测转染12、24、36、48、60、72 h 6个时间梯度。
1.3.2RT-PCR检测survivin mRNA表达水平 按Trizol法提取细胞中的总RNA, 1%琼脂糖凝胶电泳,110 V电压,30 min。Gelred染色液染色,在紫外分光光度仪下进行分析。按cDNA第一链试剂盒步骤合成cDNA, survivin上游引物:5′-CAGATTTGAATCGCGGGACCC-3′,下游引物:5′-CCAGAGTCTGGCTCGTTCTCAG-3′,产物长度206 bp; 内参GAPDH 上游引物:5′-GGAAGGTGAAGGTCGGAGT-3′,下游引物:5′-GACCACCTGGTGCTCAGTGT-3′,产物长度295 bp。PCR扩增条件:95℃ 30 s,95℃ 5 s,60℃ 1 min共30个循环,产物由PCR仪进行定量分析〔9〕。
1.3.3Western印迹测定survivin蛋白情况 提取总蛋白,制备浓缩胶和分离胶,将蛋白经电泳分离,电转移至PVDF膜上,用5%脱脂奶粉封闭1.5 h ,分别与1∶100稀释的一抗 4℃孵育过夜,TTBS洗膜,1∶200稀释的二抗孵育1.5 h, TTBS洗膜,以β-actin为内参,化学发光 ,洗片,观察survivin蛋白表达强度的变化〔10,11〕。
1.3.4MTT法检测细胞生长情况 用0.25%的胰酶制成单细胞悬液,转入96孔板,37℃、5% CO2培养箱中培养68 h;加入10 μl MTT液/孔,继续培养4 h;吸弃孔内培养液后,加入DMSO液,150 μl/孔,将培养板置于微孔板振荡器上振荡10 min,使结晶物溶解;用酶标仪检 测波长570 nm处各孔OD值,测定细胞的凋亡率。
2 结 果
2.1转染前后结直肠癌SW480细胞镜下情况,转染后,细胞逐渐融合,胞体数量减少,随时间推移,细胞形态变成椭圆透亮型,见图1。
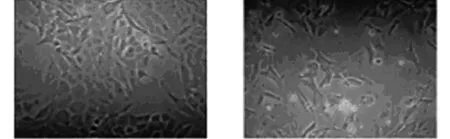
转染前 转染后
2.2RT-PCR检测survivin mRNA水平的变化 与空白对照组比较,浓度100、150、200、250、300 nmol/L时survivin mRNA的相对表达抑制率分别为39.01%、32.15%、26.43%、24.13%、23.32%,表明suvivin-siRNA重组腺病毒对survivin mRNA的最适浓度为100 nmol/L(P<0.05)。在浓度为100 nmol/L时,转染时间在48 h时转染效果最好,mRNA表达抑制率为67.19%,转率时间在24、36、60、72 h时mRNA表达抑制率分别为42.14%、54.26%、56.79%、48.46%。
2.3Western印迹检测survivin 蛋白的表达 浓度为100 nmol/L时survivin蛋白表达抑制率为47.83%,明显高于其余浓度,50、150、200、250、300 nmol/L时蛋白抑制率分别为30.32%、39.15%、31.43%、29.23%、27.34%。转染时间在48 h转染效果最好,蛋白抑制率为68.24%,明显高于其他转染时间,12、24、36、60、72 h蛋白表达抑制率分别为24.54%、32.83%、49.15%、47.83%、35.34%。
2.4MTT法检测处理后的结肠癌细胞的凋亡情况 suvivin-siRNA重组腺病毒在浓度为100 nmol/L时细胞生长抑制率最高〔(15.1±1.0)%〕,50、150、200、250、300 nmol/L时细胞生长抑制率分别为(7.2±0.8)、(14.3±0.9)、(12.2±1.2)、(11.2±0.7)、(9.4±0.6)%。48 h对人结直肠癌SW480细胞的抑制作用最强为(37.0±2.7)%,12、24、36、60、72 h生长抑制率分别为(8.5±1.3)、(15.1±1.0)、(23.4±1.3)、(36.5±1.4)、(35.6±2.1)%。
3 讨 论
肿瘤的发生是促凋亡与抗凋亡失衡的结果,抗凋亡的失衡是导致肿瘤形成的重要原因,survivin是目前发现分子量最小、作用最强的凋亡抑制因子,研究表明Survivin在结直肠癌、胰腺癌、乳腺癌、肺癌、淋巴瘤、皮肤癌、前列腺癌、血管瘤等多种肿瘤组织中高度表达〔5〕,Survivin高度表达的肿瘤患者生存期明显缩短〔5,7~9〕。结直肠癌是一种严重威胁人类生存的恶性肿瘤之一,采用以手术切除为主、放化疗为辅的综合治疗。手术常难以清除微小病灶,放、化疗仍有敏感性低、副作用大的缺点。研究表明survivin在结直肠癌中的总阳性表达率为53.2%〔6〕。基于survivin在肿瘤细胞中高表达的特性,随着目前RNA干扰技术的发展,通过RNA干扰技术沉默survivin用以达到抑制肿瘤生长的目的,其优点是特异性强、副作用小。Yan等〔12〕构建的腺病毒载体的siRNA用于转染肝癌细胞HepG2后,surivivin的mRNA和蛋白的表达明显降低,细胞凋亡增加。Wen等〔13〕用RNAi技术将用沙门菌质粒将survivin基因沉默的同时,并将GRIM-19表达,并转染入喉癌裸鼠移植瘤中,能明显抑制喉癌细胞的增殖,抑制率为53.4%。结合survivin沉默和GRIM-19的表达,喉癌移植瘤能达到消失的效果。张海霞等〔14〕利用脂质体介导的survivin基因沉默作用于裸鼠人卵巢癌细胞,结果显示survivin基因沉默可以促进人卵巢癌细胞株SKOV3细胞凋亡,进而抑制裸鼠移植瘤的生长。
本研究结果显示pBAsi-survivin浓度为100 nmol/L时是体外抑制结直肠癌SW480细胞的最适宜浓度。转染pBAsi-survivin 48 h后凋亡抑制作用最好。同时在浓度为100 nmol/L时转染48 h后作用最明显,随着时间的迁移,细胞代谢产物增加会对pBAsi-survivin的抑制作用有影响。但这是否是最适宜的体内抑制浓度,过高的浓度对体内重要脏器的影响,还需要进一步研究。
4 参考文献
1Yue ZJ, Carvalho A, Xu ZJ,etal. Deconstructing survivin: comprehensive genetic analysis of survivin function by conditional knockout in a vertebrate cell line〔J〕.J Cell Biol,2008;183(2):279-96.
2Wu SF, Zhang JW, Qian WY,etal.Altered expression of survivin, Fas and FasL contributed to cervical cancer development and metastasis 〔J〕.Eur Rev Pharmacol Sci,2012;16(15): 2044-50.
3Hori M, Miki T, Okamoto M,etal.The detergent-soluble cytoplasmic pool of survivin suppresses anoikis and its expression is associated with metastatic disease of human colon cancer〔J〕. PLoS One,2013;8(2): e55710.
4Wang YQ , Zhang HH, Liu CL,etal.Correlation between auto-antibodies to survivin and MUC1 variable number tandem repeats in colorectal cancer〔J〕.Asian Pac J Cancer Prev,2012;13(11):5557-62.
5Rosa AC, Nancy BS, Eric M,etal. Antisense inhibition of survivin expression as a cancer therapeutic〔J〕. Mol Cancer Ther,2011;10(2):221-32.
6Kawasaki H, Altieri DC, Lu CD,etal. Inhibition of apoptosis by survivin predicts shorter survival rates in colorectal cancer〔J〕,Cancer Res,1998;58(22):5071-4.
7Hingorani P, Dickman P, Garcia-Filion P,etal.BIRC5 expression is a poor prognostic marker in Ewing sarcoma〔J〕 .Pediatr Blood Cancer,2013;60(1):35-40.
8Choi J, Chang H. The expression of MAGE and SSX, and correlation of COX2, VEGF, and survivin in colorectal cancer 〔J〕. Anticancer Res,2012;32:559-64.
9Porebska I, Sobańska E, Kosacka M,etal. Apoptotic regulators: P53 and survivin expression in non-small cell lung cancer〔J〕. Cancer Genomics Proteomics,2010;7(6): 331-5.
10郭玥馨, 毛成刚, 罗 庆,等. Livin siRNA重组腺病毒的构建及其对K562细胞增殖、凋亡和耐药的影响〔J〕.第三军医大学学报,2009;31(14):1353-7.
11Yoon MJ, Park SS, Kang YJ,etal. Aurora B confers cancer cell resistance to trail-induced apoptosis via phosphorylation of survivin 〔J〕. Carcinogenesis,2012;33(3):492-500.
12Yan G,Duan RH,Yin K,etal. Inhibition of surviving expression to induce the apoptosis of hepatocarcinoma cells by adenovirus-mediated siRNA 〔J〕.Bio Sci Trends,2008;2(2):88-93.
13Wen LJ, Gao LF, Jin CS,etal. Small interfering RNA survivin and GRIM-19 co-expression salmonella plasmid inhibited the growth of laryngeal cancer cells in vitro and in vivo〔J〕.Int J Clin Exp Pathol,2013;6(10):2071-81.
14张海霞,赵宏伟. Survivin 基因沉默对裸鼠人卵巢癌细胞移植瘤凋亡的影响〔J〕. 中国药物与临床,2012;12(8):996-8.
