西兰花多肽组分II诱导神经胶质瘤细胞凋亡的作用及其机制研究*
2014-08-09徐俊杰赵东海纪朋艳王玮瑶吕士杰
齐 玲, 徐俊杰, 赵东海, 韩 磊, 纪朋艳, 王玮瑶, 吕士杰
(吉林医药学院,吉林 吉林132013)
多肽是由10~100个氨基酸分子经脱水缩合而成的化合物,它在生物界中的存在十分广泛。多肽除了具有营养、调节机体的代谢和生理功能外[1-2],还可以作为药物来发挥作用。多肽药物具有活性高、用量小和易产业化等优点,现已成为药物研发的热点之一。西兰花是具有明确抗癌特性的食物,它因含有多种营养成分而被称为“营养素的宝库”。研究表明,西兰花中的维生素、多酚类和黄酮类物质具有明确的抗氧化活性,硫代葡萄糖苷则能降低癌症的患病风险[3-4],而硫苷的水解产物异硫氰酸盐具有明确的抗癌作用[5],但关于西兰花多肽成分抗癌的研究较少。本实验在以往工作的基础上,将西兰花多肽提取物经凝胶过滤层析分离获得4个主要洗脱峰,取其中第II峰即西兰花多肽组分II(CII)多肽含量最高的洗脱物用于后续实验研究[6]。本实验进一步研究西兰花中多肽组分II对神经胶质瘤的作用及可能的机制。
材 料 和 方 法
1 材料
1.1细胞株 人神经胶质瘤SHG-44细胞株,由吉林大学基础医学院提供。
1.2主要试剂 RPMI-1640细胞培养基 (HyClone);0.25%胰蛋白酶和小牛血清(Gibco);四甲基偶氮唑(MTT)和二甲基亚砜(DMSO)(Sigma);西兰花多肽组分II(冻干粉,吉林医药学院制备);免疫组化试剂盒(北京中杉公司);β-actin、Bax、Bcl-2和caspase-3 抗体(Santa Cruz)。
1.3主要仪器 CB150型CO2培养箱(Binder);J-26XP型超低温高速离心机(贝克曼);MDF-U53V型超低温冰箱(三洋);PLUS 384型全自动酶标仪(MDC);IX-70型倒置显微镜(Olympus);DNA蛋白电泳系统(Bio-Rad);Image-Pro Plus 图像分析管理系统 (Media Cybernetics)。
2 方法
2.1细胞培养 预热含10%小牛血清的RPMI-1640培养液。从液氮罐中取出神经胶质瘤SHG-44细胞株,迅速置于37 ℃水浴振荡至融化,离心后弃上清,将细胞用1 mL培养液轻轻混匀,将含细胞的培养液吸出后放入培养瓶中,再加入9 mL新鲜的培养液,轻轻混匀后置入5% CO2、37 ℃培养箱中,饱和湿度下进行培养。待细胞密度达80%~90% 汇合时,按1∶2进行传代。
2.2MTT分析细胞活性 取适量西兰花多肽组分II,将其配制成终浓度分别为3、10、30和100 mg/L的含药培养液。基础培养液为含5%小牛血清的RPMI-1640培养液。将SHG-44细胞消化后,以8×103cells/well的密度均匀种于96孔板中,置入37 ℃、5% CO2培养箱中培养过夜。在24 h、48 h和72 h时分别加入含药和不含药的培养液,每个浓度重复5次。作用结束时,每孔加入MTT 20 μL,继续孵育4 h终止培养,弃上清后,每孔加入150 μL DMSO,15 min后在酶联免疫检测仪490 nm波长处测定各孔吸光度(A),以时间为横坐标,A值为纵坐标绘制细胞生长曲线。
2.3细胞凋亡率的检测 将SHG-44细胞按每孔2×105细胞接种于6 孔板,4个实验组均加入西兰花多肽组分II,使其终浓度分别为3、10、30和100 mg/L,空白对照组加入基础培养液,置于37 ℃、5% CO2培养箱中培养72 h,收集细胞,PBS 洗涤2 次。按照说明书操作,用1∶4 binding buffer 缓冲液190μL 重悬细胞,调整细胞浓度为(2~5)×108/L,然后加入FITC标记的Annexin V-FITC 5 μL和20 mg/L PI 10 μL,冰浴10 min,流式细胞术检测每个样品中每10 000个细胞中细胞的凋亡率。
2.4细胞凋亡的形态学观察 将SHG-44细胞以5 000 cells/well的密度接种于24孔板中培养过夜,次日加入西兰花多肽组分II(3、10、30和100 mg/L),设空白对照组,加药后继续培养72 h,取出培养板后在倒置显微镜下观察并拍照。
2.5免疫细胞化学法检测凋亡相关蛋白 将SHG-44细胞按5 000 cells/well的密度接种于置有玻片的24孔板中,实验设空白对照组和西兰花多肽组分II(3、10、30和100 mg/L)组,均作用72 h,玻片固定,灭活封闭,Ⅰ抗过夜,Ⅱ抗室温孵育2 h,DAB显色,脱水和透明后封片。每组各取3张切片,随机选择3个不同视野,应用Image-Pro Plus分析软件分析蛋白阳性产物的积分吸光度值,取平均值做统计分析。
2.6Western blotting法检测凋亡相关蛋白的表达 将SHG-44细胞以1×108/L密度接种于25 cm2培养瓶中。分别加入西兰花多肽组分II,使其终浓度为3、10、30和100 mg/L,空白对照组加入基础培养基,均作用72 h。收集细胞,PBS洗涤细胞后用50 μL细胞裂解液裂解细胞。提取蛋白后测定浓度,SDS-PAGE分离蛋白,转膜封闭,加入β-actin、Bcl-2、Bax和caspase-3 抗体,4 ℃孵育过夜。Ⅱ抗室温孵育1 h,胶片曝光拍照。实验结果采用Image-Pro Plus图像分析软件进行分析,以特异性条带平均吸光度与面积的乘积来反映蛋白的表达水平。
3 统计学处理
采用SPSS 17.0 统计软件分析,计量资料以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(ANOVA),以P<0.05 为差异有统计学意义。
结 果
1 西兰花多肽组分II对SHG-44细胞活性的影响
MTT结果显示,24 h时,100 mg/L 西兰花多肽组分II组SHG-44细胞活性降低(P<0.05);48h时,10、30和100 mg/L西兰花多肽组分II组SHG-44细胞活性均降低(P<0.05);72 h时,西兰花多肽组分II各浓度组SHG-44细胞活性均下降(P<0.01)。并且,西兰花多肽组分II对细胞活性的影响呈现时间-剂量效应关系,见图1。根据MTT结果,不同浓度的西兰花多肽组分II作用SHG-44细胞后72 h时作用最为明显,因此选取72 h作为后续实验的时间。
2 SHG-44细胞凋亡率的变化
3、10、30和100 mg/L西兰花多肽组分II 作用于SHG-44细胞72 h后,Annexin V/PI分析各用药组凋亡率分别为(15.34±2.48)%、(19.64±3.35)%、(40.38±5.29)%和(63.21±3.17)%,各组凋亡率均明显高于同期空白对照组(1.81±0.74)%,30和100 mg/L组较对照组差异有统计学意义(P<0. 05),各用药组的凋亡率随着药物剂量的增加而显著升高,见图2。
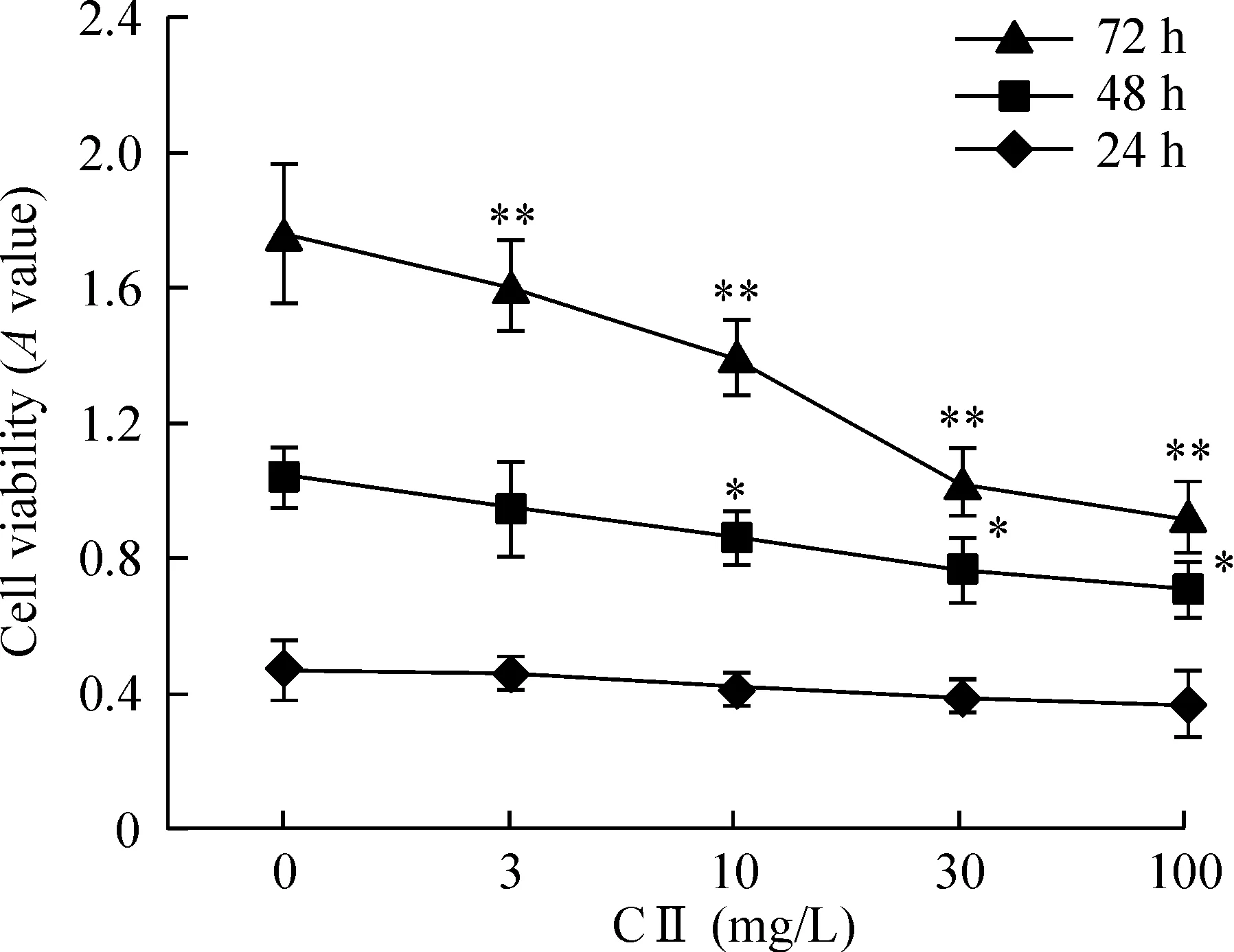
Figure 1. Effect of component Ⅱ (CⅡ) of broccoli polypeptide on the viability of SHG-44 cells. Mean±SD. n=5.*P<0.05,**P<0.01 vs 0 mg/L.
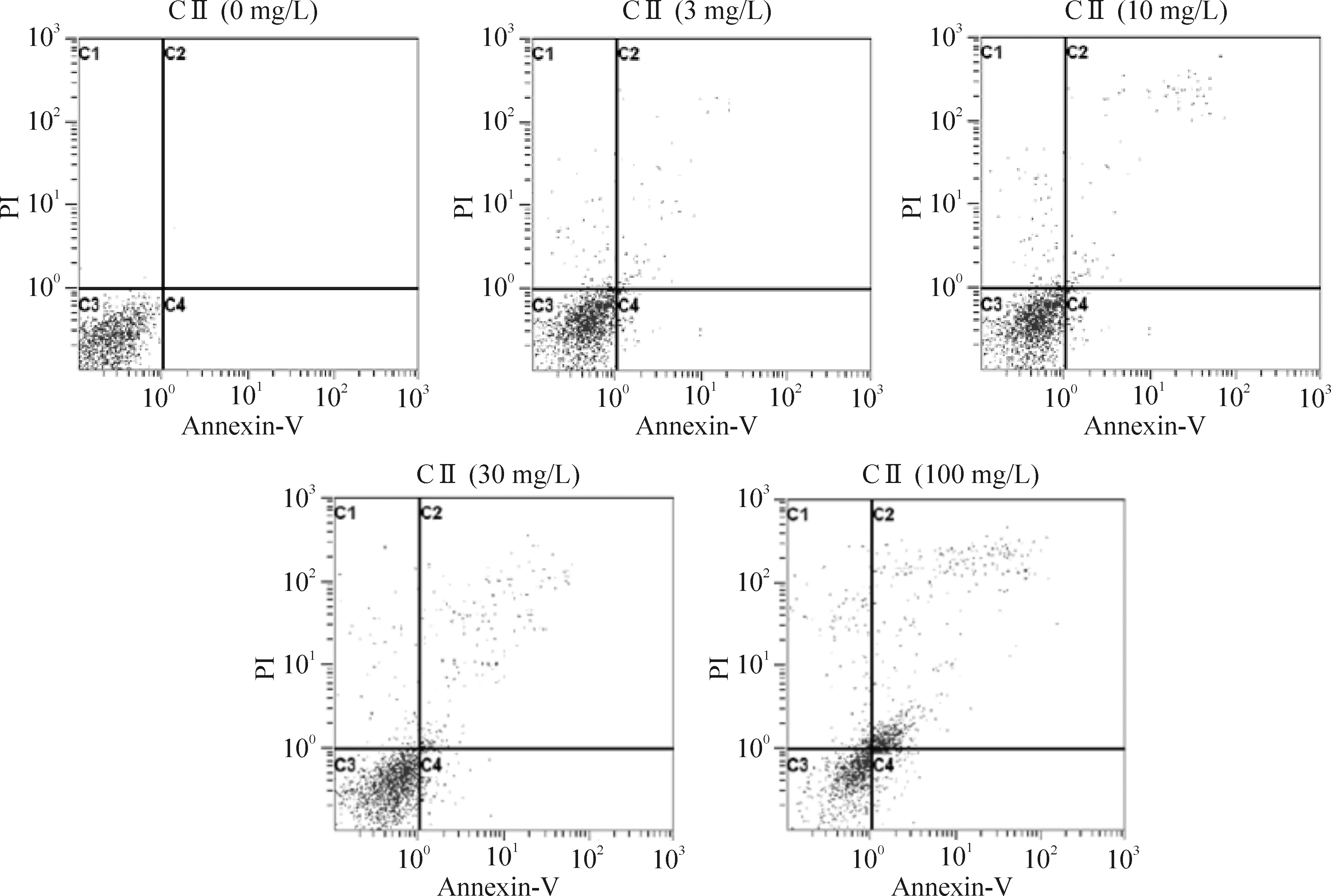
Figure 2. Effects of component II (CⅡ) of broccoli polypeptide on apoptosis of SHG-44 glioma cells.
3 SHG-44细胞凋亡的形态学变化
倒置显微镜下观察,西兰花多肽组分II(0、3、10、30和100 mg/L)作用于SHG-44细胞72 h后,对照组生长良好,各用药组随浓度升高细胞数量明显减少,以100 mg/L西兰花多肽组分II组最为明显,镜下可见到明显的凋亡小体,见图3。
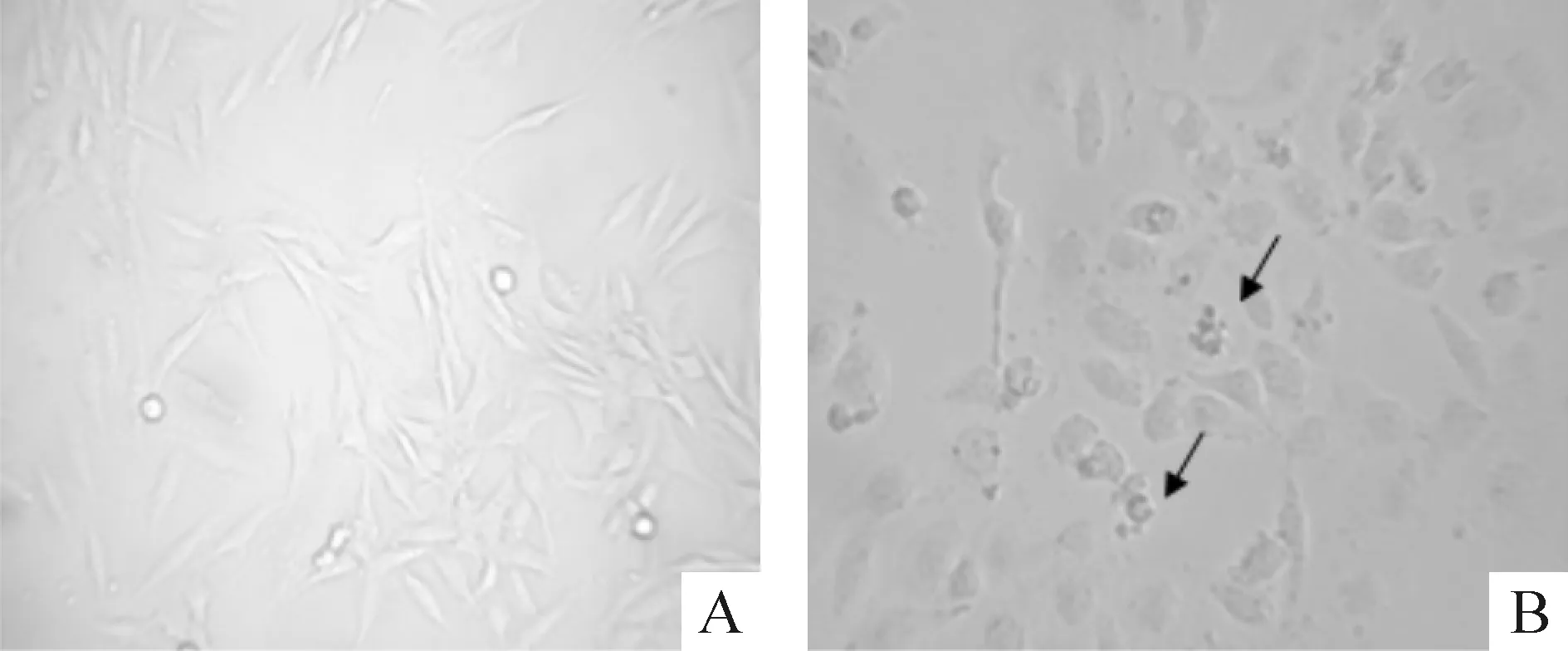
Figure 3. Apoptotic morphology of SHG-44 cells was observed after treated with component II of broccoli polypeptide (×200).A: control group; B: 100 mg/L group.
4 SHG-44细胞凋亡相关蛋白的变化
免疫细胞化学结果显示,3、10、30和100 mg/L西兰花多肽组分II作用于SHG-44细胞72 h后,细胞Bax蛋白表达逐渐增加,Bcl-2蛋白表达逐渐减少,与空白对照组比较,差异均有统计学意义(P<0.01);计算Bax/Bcl-2的比值发现,随着药物浓度升高,Bax/Bcl-2比值明显升高,与空白对照组比较,差异具有统计学意义(P<0.01),见图4。
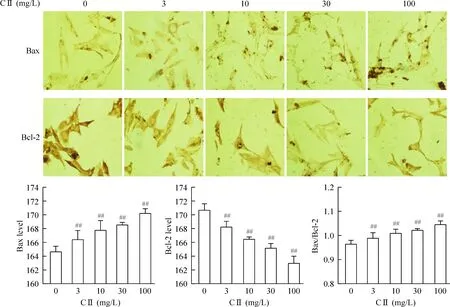
Figure 4. Expression of Bax and Bcl-2 proteins in SHG-44 cells after treated with component Ⅱ (CⅡ) of broccoli polypeptide (×200). Mean±SD. n=3.##P<0.01 vs 0 mg/L.
Western blotting结果显示:3、10、30和100 mg/L西兰花多肽组分II作用于SHG-44细胞72 h后,细胞表达Bax蛋白呈上升趋势,与空白对照组比较,差异具有统计学意义(P<0.05或P<0.01);细胞表达Bcl-2蛋白减少,与对照组比较,各药物组差异均具有统计学意义(P<0.01)。检测细胞caspase-3蛋白表达发现,各药物组细胞表达量均增加,与空白对照组比较,30和100 mg/L西兰花多肽组分II组差异有统计学意义(P<0.01)。计算Bax/Bcl-2比值发现,与空白对照组比较,各药物组比值均明显增加(P<0.05或P<0.01),见图5。
讨 论
神经胶质瘤是颅内肿瘤的最常见类型,它具有发病率、复发率、死亡率高而治愈率低的“三高一低”的特点。由于神经胶质瘤发生于颅内,它对人的生命和健康的威胁极大[6]。神经胶质瘤一经诊断,首选手术疗法,术后再尽早辅以放、化疗或联合替莫唑胺等疗法。结合手术和放化疗方法,患者的中位生存率也仅达14.6个月[7]。因此,如何延长神经胶质瘤患者的生存时间,提高患者的生存质量是目前胶质瘤治疗的难点。有研究发现,恶性神经胶质瘤细胞由于激活了细胞的生长途径和/或抑制细胞的凋亡途径而对治疗产生抵抗[8]。
多肽分为人工合成多肽和生物活性多肽两种,它具有多种用途,可以应用于多个领域,因此,开发多肽产品具有广泛的市场前景。西兰花是著名的抗癌食物之一,在此前研究中,本实验组提取西兰花多肽成分,得到4个组分,其中以组分Ⅱ的生物活性最高[9],并发现其可以抑制胶质瘤细胞的增殖。本研究进一步研究西兰花多肽组分II在不同剂量时对神经胶质瘤细胞的作用,发现西兰花多肽组分II作用SHG-44细胞24 h、48 h 和72 h均可以明显地降低细胞活力,72 h时细胞活性降低最为明显。以上结果说明,西兰花多肽组分II作用不同胶质瘤细胞后随着作用时间及剂量的增加,细胞活性降低更加明显,药物作用具有时间-剂量效应关系。
肿瘤细胞的生长受抑制可能是由于细胞凋亡或增殖受抑制所引起。因此,我们应用Annexin V/PI 检测细胞的凋亡率结果发现,3、10、30和100 mg/L西兰花多肽组分II均可以诱导SHG-44细胞发生凋亡,并且随着剂量的增加,凋亡率亦明显增加。进一步观察SHG-44细胞凋亡的形态学变化发现,西兰花多肽组分II作用于SHG-44细胞后,细胞密度随药物浓度升高而明显减少,并可见到明显的凋亡小体,100 mg/L西兰花多肽组分II浓度组最多。以上结果说明,西兰花多肽组分II在作用细胞后可以通过诱导细胞凋亡而抑制肿瘤细胞的生长,作用具有剂量依赖性。
在药物促使细胞发生凋亡过程中,凋亡相关蛋白Bax、Bcl-2表达的量和两者比值往往决定了细胞是否容易发生凋亡。Bax是最常见的促凋亡相关蛋白之一,细胞在受到凋亡因子刺激时,Bax等会在线粒体膜上进行同源寡聚,使线粒体膜上的大孔通道开放,从而使细胞色素C等线粒体蛋白释放到胞质中,促使凋亡发生[10-12]。本实验中免疫细胞化学和Western blotting方法结果显示细胞表达Bax蛋白逐渐增加,表达Bcl-2蛋白逐渐减少,并且随着药物浓度升高,Bax/Bcl-2比值明显升高(P<0.01)。以上结果表明,西兰花多肽组分II可以促进凋亡相关蛋白Bax的表达,抑制抗凋亡蛋白Bcl-2的表达,使Bax/Bcl-2比值增加。
Caspase-3是凋亡途径下游主要的效应因子,是凋亡的具体执行者。当凋亡发生时,caspase-3活性片段表达量会增加[13-14]。Western blotting检测caspase-3蛋白的表达显示,各用药组细胞caspase-3蛋白活性片段表达量均增加,尤其是30和100 mg/L西兰花多肽组分II组作用明显(P<0.01)。这一结果表明,西兰花多肽组分II促进SHG-44细胞caspase-3蛋白的活化,使凋亡得以发生。
总之,西兰花多肽组分II通过促进神经胶质瘤细胞凋亡而抑制肿瘤细胞的生长,这可能是通过药物作用后,促进肿瘤细胞促凋亡蛋白Bax和抑制抗凋亡蛋白Bcl-2的表达,使Bax/Bcl-2比值明显增加,再通过线粒体途径的激活使caspase-3蛋白活化增加,进而促进肿瘤细胞凋亡。但更深一步的机制,还需在今后的实验中继续研究。
[参 考 文 献]
[1] Klompong V, Benjakul S, Yachai M, et al. Amino acid composition and antioxidative peptides from protein hydro-lysates of yellow stripe trevally (Selaroidesleptolepis)[J]. J Food Sci, 2009, 74(2):126-133.
[2] 李鸿梅. 玉米功能肽的制备及其生理活性的研究[D]. 长春:吉林大学, 2008.
[3] Jeffery EH, Brown AF, Kurilich AC, et al. Variation in content of bioactive components in broccoli[J]. J Food Compos Anal, 2003, 16(3):323-330.
[4] Zareba G, Serradell N. Chemoprotective effects of broccoli and other Brassica vegetables[J]. Drug Future, 2004, 29(11): 1097-1104.
[5] 邹 翔, 郎 朗, 武晓丹, 等. 西兰花中葡萄糖异硫氰酸盐诱导人胃腺癌SGC-7901 细胞凋亡的初步研究[J]. 中草药, 2006, 38(2):228-231.
[6] 曹志友, 金 宏, 田 晶, 等. 白附子提取物对胶质瘤细胞的增殖抑制和诱导凋亡作用及其机制[J]. 吉林大学学报:医学版, 2013, 39(4):649-652.
[7] Stupp R, Warren P, Martin J, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J]. N Engl J Med, 2005, 352(10):987-996.
[8] Qi L, Bellail AC, Rossi MR, et al. Heterogeneity of primary glioblastoma cells in the expression of caspase-8 and the response to TRAIL-induced apoptosis[J]. Apoptosis, 2011, 16(11):1150-1164.
[9] 徐俊杰, 于洪泉, 赵 伟, 等. 西兰花多肽对C6胶质瘤细胞的诱导凋亡作用[J]. 吉林大学学报:医学版, 2013, 39(1):8-11.
[10] Szegezdi E, MacDonald DC, Ní Chonqhaile T, et al. Bcl-2 family on guard at the ER[J]. Am J Physiol Cell Physiol, 2009, 296(5):C941-C953.
[11] 周开宇, 毛天明, 陈 茜, 等. 苦参碱对人髓母细胞瘤 D341 细胞凋亡及相关蛋白表达的影响[J]. 中国病理生理杂志, 2014, 30(4): 629-634.
[12] 李 军, 王国荣, 张秀芹, 等. 二苯乙烯苷对同型半胱氨酸诱导血管内皮细胞凋亡及 Bcl-2、Bax 和caspase- 3 表达的影响[J]. 中国病理生理杂志, 2013, 29(4):743-747.
[13] Devi DG, Cibin TR, Abraham A. Bis (3,5-diiodo-2,4,6-trihydroxyphenyl) squaraine photodynamic therapy inducesinvivotumor ablation by triggering cytochrome c dependent mitochondria mediated apoptosis[J]. Photodiagnosis Photodyn Ther, 2013, 10(4):510-517.
[14] 钟 越, 齐 玲, 沈 楠, 等. 越桔原花青素调控脑胶质瘤细胞生长的机制研究[J]. 中国病理生理杂志, 2014, 30(4):603-608.
