聚精氨酸及其衍生物作为基因载体应用的研究进展
2014-08-06台宗光朱全刚戴子渊
台宗光,朱全刚,戴子渊,高 申
(1.第二军医大学长海医院药学部,上海 200433;2.解放军92330部队医院药房,青岛 266102;3.上海中医药大学附属岳阳中西医结合医院药剂科,上海 200437;4.复旦大学附属儿科医院药剂科,上海 201102)
基因治疗是将基因(主要为DNA或siRNA)传递到病人特定细胞中,从而促进或抑制目标蛋白质的表达,达到治疗人类疾病的目的[1]。由于基因片段容易被核酸酶降解,且带负电荷,相对分子质量较大,很难通过带负电荷的细胞膜,这就需要利用基因载体来保护并传递基因片段进入到细胞内[2]。基因载体既要保证高的转染效率,又要有较低的细胞毒性。因此,发展低毒高效的基因传递载体是基因治疗成功应用的重要前提。
基因载体分病毒载体和非病毒载体两大类[2]。病毒载体的优点是靶基因表达效率高,但同时也有免疫原性、可能激活原癌基因引发肿瘤,及难以大量制备等缺点,从而限制了其临床应用。非病毒基因载体的优势在于免疫原性弱,制备方便,对基因材料的要求限制少[3]。非病毒基因载体分为聚合物和脂质体两大类,前者包括聚乙烯亚胺(polyethylenimine,PEI)、壳聚糖(chitosan)、聚氨基酸(polyamino acid,PAA)、树枝状大分子等;后者有阳离子脂质体、DNA脂质涂层复合物、类脂质体等。非病毒基因载体中的PAA可以被体内的酶降解,在器官内很少蓄积,是一类非常有应用前景的基因载体。PAA中的聚精氨酸(polyarginine,PLR)由于在溶液中带正电,可以携带带负电的基因片段跨膜转运入细胞中[4],这一特性让PLR可用作基因治疗的载体。本文综述了PLR及其衍生物作为基因载体应用的研究进展。
1 PLR作为基因载体的优势
精氨酸是人体半(条件)必需氨基酸,在生理条件下带正电荷。PLR由多个精氨酸上的氨基和羧基脱水缩合形成(见图1),是一种能够跨膜转运的多肽,PLR和精氨酸可以促进药物穿过细胞膜,增加进入细胞内的药物比例。精氨酸是细胞膜穿透肽 (membrane penetrating peptides,MPPs) 中发挥主要作用的一种氨基酸[5],也在蛋白质转导区域 (protein transduction domains,PTDs) 和HIV Tat蛋白质中大量存在。
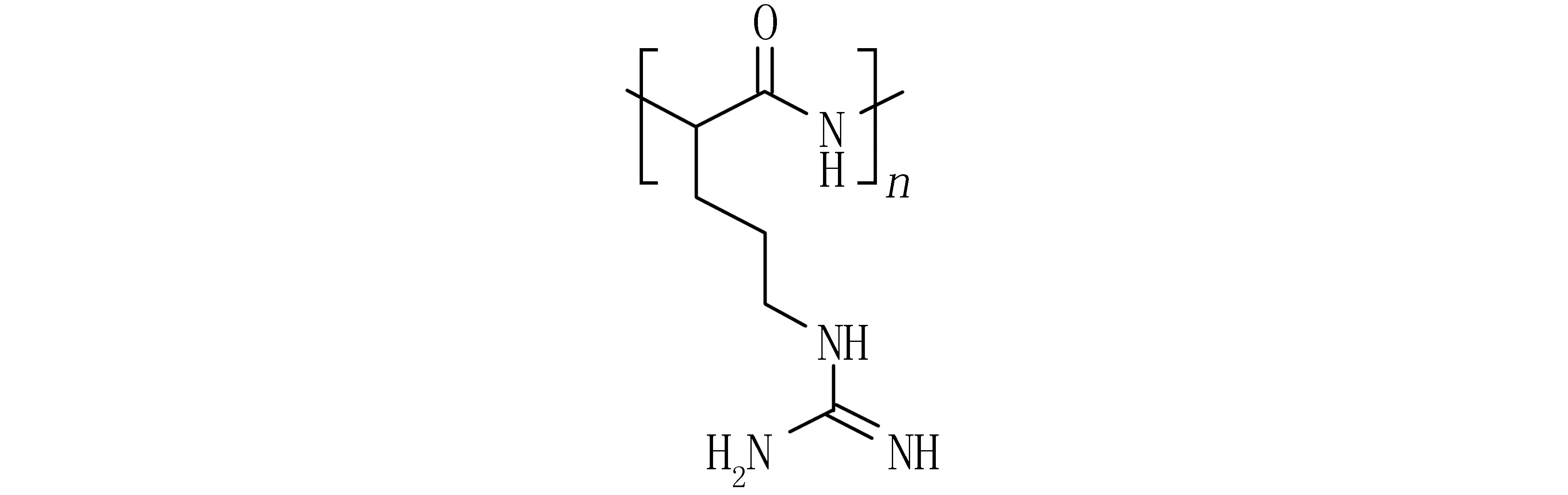
图1 聚精氨酸的化学结构式
在众多的基因载体材料中,虽然部分材料有较高的基因转染效率,但是这些材料本身不能完全解决免疫原性、生物相容性及体内降解性等问题。为了解决这些问题,最好能采用人体自身组成分子,使材料最接近人体的组成。基于这一思路,氨基酸均聚与共聚材料可以成为潜在的理想基因载体。PLR有很好的生物相容性,毒性较低;易于降解,降解产物为精氨酸,可以被人体利用;体外研究发现其基因转染的效率较高;价格相对较低,容易制备,通过控制条件合成不同分子质量的PLR,给研究和应用带来了极大的便利。
2 PLR作为基因载体应用的相关研究
2.1 PLR进入细胞的途径 生理条件下PLR分子带正电,细胞膜表面有大量带有负电的糖蛋白及磷脂,两者可以通过静电作用相互吸引结合,再经内吞过程进入细胞内。Fuchs等[6]研究发现,PLR的入胞途径有以下几步:(1)与细胞表面的硫酸类肝素(heparan sulfate,HS)结合,生成硫酸类肝素蛋白质多糖(HSPGs),另外由于PLR带正电,还可以与细胞表面带负电的糖类结合;(2)HSPGs通过HS介导的细胞内吞作用,以囊泡的形式进入到细胞内;(3)在囊泡转运的过程,HSPGs中的HS被细胞内的类肝素酶水解,释放出游离PLR;(4)PLR浓度足够高时,能够破坏囊泡的双脂质层,从而进入到细胞质中。
2.2 PLR相对分子质量与基因转染效率的关系 对于聚合物基因载体,相对分子质量是影响基因转染效率的重要因素[7,8]。同一类载体的相对分子质量越高越容易与基因片段结合,荷载基因片段的能力越强,但由于高相对分子质量载体不易与基因片段解离,进入细胞内难以释放出基因片段,转染效率反而会降低,并且载体的细胞毒性也与高相对分子质量密切相关。而低相对分子质量的基因载体形成的载体-基因片段复合物在水溶液中容易解体[9],荷载基因片段的能力不强,也无法达到较高的转染效率。Hashimoto等[10]研究了聚合度分别为60、180和730的3种PLR,发现PLR载基因的转染效率与PLR中阳离子基团(cationic groups)数与基因片段中阴离子基团(anionic groups)数之比(C/A)有关,当C/A为6时,3种PLR的转染效率最高;另外,PLR的转染效率与相对分子质量有关,相对分子质量越大,基因转染效率越高。因此,要使转染效率达到最高,需要选择较高相对分子质量的PLR。Koo等[11]利用HEK293细胞对平均相对分子质量分别为1.0×104、4.1×104和8.3×104的3种PLR基因转染效率进行了比较,发现相对分子质量高(4.1×104和8.3×104)PLR的基因转染效率是相对分子质量低(1.0×104)PLR的100倍,转染效率与PLR的胍基(N)和基因片段的磷酸基团(P)数量比(N/P)有关,N/P为10左右时,基因转染效率最高。在细胞毒性方面,相对分子质量高的PLR的毒性比相对分子质量低的PLR大,相对分子质量为8.3×104和4.1×104的PLR,IC50值分别为70和100 μg/ml,而相对分子质量为1.0×104的PLR在浓度为100 μg/ml时未显示出明显的细胞毒性。总体来说,PLR载体相对分子质量增大后,基因转染效率随之提高,但细胞毒性也会增加,PLR作为基因载体应用需要选择合适的相对分子质量。
2.3 PLR衍生物的结构优化与应用
2.3.1 PLR直接作为基因载体 相对分子质量高的PLR由于细胞毒性较大,不适合直接作为基因载体使用,而相对分子质量低的PLR细胞毒性低,可以直接用作基因载体。Kim等[5]以15聚精氨酸(R15)为siRNA载体,在体外和体内进行了RNA干扰研究,发现R15与siRNA可形成稳定的复合物,能够被体外培养细胞有效摄取,细胞转染24 h后,siRNA出现在细胞核周围区域,提示siRNA在胞内形成了RNA诱导的沉默复合物(RNA-induced silencing complex,RISC),后者可以阻断mRNA的翻译过程。对SKOV-3细胞移植瘤小鼠瘤内注射原癌基因人类表皮生长因子受体2(human epidermal growth factor receptor,HER-2)特异性siRNA/肽复合物,小鼠的肿瘤明显小于对照组,处理组肿瘤细胞中的HER-2基因表达也明显下降。
D型和L型精氨酸形成的PLR与单一构型精氨酸聚合物相比,由于结构更为复杂,在溶液中近似于球状,正电荷更多地分布于分子内部,分子表面的正电荷数量减少,从而降低了对细胞的毒性。Ma等[12]对一系列的D型和L型精氨酸聚合物载体进行了研究,单纯的L型精氨酸(R)组成的8聚体(R8)细胞摄取率并不高,但毒性最小。R8中D型精氨酸(r)数量增加后,细胞摄取率会有较大提高,但细胞毒性也随之提高。R8组成序列为(rR)3R2时,细胞摄取率较高而毒性较低。D型精氨酸(r)的数量不超过4个的几种R8,浓度100 μmol/L时与细胞孵育12 h后,超过75%的细胞仍能存活。对小鼠的毒性研究中也发现了同样的现象。研究者认为序列为(rR)3R2的R8是最有潜力的载体。
2.3.2 精氨酸功能化的树枝状大分子作为基因载体 聚酰胺胺(polyamidoamine,PAMAM)树枝状大分子为第一个合成的树状大分子,已广泛应用于基因载体研究,具有转染效率高、毒性低等优点。精氨酸和聚酰胺-胺类似,可以通过反应形成聚合型的树枝状大分子。Luo等[13]应用点击化学法以精氨酸为基本单元合成了5代(G5A)和6代(G6A)的多肽型树枝状大分子,并对其介导的体外和体内基因转染进行了研究。该基因载体与质粒DNA形成的复合物粒径为180~250 nm,载体能有效地保护质粒DNA(pDNA)不被核酸酶降解。对比研究显示,G5A的细胞毒性远低于PEI,G5A/DNA对Hela等8种细胞株的转染率高于PEI/DNA,其中对Hela细胞株的转染率最高,为PEI/DNA的2.3倍。体内研究也有同样的发现,荷瘤小鼠肿瘤内注射G5A/DNA复合物,肿瘤中树枝状G5A组DNA的表达为PEI组的6倍。
2.3.3 二硫键桥连的PLR作为基因载体 阳离子聚合物载体由二硫键桥连后,可以降低载体的细胞毒性,增加基因转染效率[14],并且由于二硫键在细胞质内很快被酶打开,基因片段的释放也会加快[3]。为克服相对分子质量低的PLR基因转染效率较低的问题,将相对分子质量低的PLR分子经过二硫键桥连后加以克服,同时又能保持较低的细胞毒性。Won等[15]把两端为半胱氨酸(Cys)的D型9聚精氨酸[Cys-(D-R9)-Cys]通过分子间氧化合成了二硫键桥接的聚精氨酸[poly-(oligo-D-arginine),rPOA],数均(Mn)和质均(Mw)相对分子质量分别为9.475 7×104和9.620 4×104,rPOA与DNA形成的复合物,平均粒径在150 nm左右,N/P为14时Zeta电位15 mV,能保护复合物中的DNA不被胎牛血清中的酶降解。体外对照研究显示,rPOA在H9c2细胞株中的转染效率要小于PEI,而在HEK293和L2细胞中转染效率与PEI相当,均显著高于相对分子质量高的多聚D型精氨酸[poly(D-arginine),PDR]和D-R9,而且二硫键的引入降低了载体的毒性,rPOA的细胞毒性远小于PEI。体内转染荧光素酶DNA的效率方面,rPOA是PEI的20倍,是裸DNA的100倍。Won等[16]又对rPOA进一步研究发现,siRNA/rPOA>7.5时,rPOA能完全与siRNA缩合;siRNA/rPOA≥5时,rPOA能保护siRNA不被小鼠血清降解,siRNA/rPOA复合物平均粒径为(90.3±2.5) nm,Zeta电位为(36.7±6.4) mV。SCC细胞对rPOA的摄取率与PEI相当,高于PLR,毒性却小很多。用转染血管内皮生长因子(VEGF)的siRNA(siVEGF)/rPOA处理的SCC细胞,VEGF的分泌减少了50%,比siVEGF/PEI组还少30%(siVEGF/PEI组VEGF的分泌减少20%)。研究还发现谷胱甘肽可促进siVEGF/rPOA的降解,这增强了siRNA在细胞内的靶向性。肿瘤内注射siVEGF/rPOA能抑制小鼠SCC细胞皮下移植瘤的生长,移植瘤中的VEGF表达水平仅为裸siVEGF组的50%。
2.3.4 PLR-硫酸葡聚糖复合物作为基因载体 硫酸葡聚糖(dextran sulfate)广泛被用作核酸分子杂交促进剂,能够提高核酸探针的杂交率,PLR经硫酸葡聚糖修饰后,可以提高所荷载基因的细胞内转染效率。Cho等[17]利用PLR和硫酸葡聚糖组成的复合物(PLR-DEX),传递表皮生长因子受体(EGFR) siRNA进行了治疗咽、喉肿瘤的实验研究:制备的载体/siRNA复合物,平均粒径<200 nm,载体∶siRNA质量比为15∶1。经共聚焦激光扫描显微镜和流式细胞分析发现,与PLR/EGFR siRNA复合物比较,PLR-DEX/EGFR siRNA复合物中的EGFR siRNA被喉癌细胞(Hep-2细胞)和人咽癌细胞(FaDu细胞)系摄取率较高,故两种细胞系中EGFR基因沉默效率也最高。在FaDu移植瘤小鼠模型中,肿瘤内注射PLR-DEX/siEGFR复合物能抑制肿瘤的生长,移植瘤中EGFR基因表达也受到抑制。
2.3.5 PLR-透明质酸复合物作为基因载体 透明质酸(hyaluronic acid,HA)是天然存在的有黏膜黏附作用的多糖,在体内关节、眼、肺、小肠等部位大量分布,可被生物降解,在体液中带负电荷。HA能与细胞表面的CD44 受体结合,在许多上皮来源性肿瘤中CD44 受体表达上调[18],因此,HA可以增强载体的肿瘤靶向作用。当带正电的PLR和带负电的HA混合后,两者会在溶液中形成团状的纳米结构,HA可以降低PLR的细胞毒性。Oyarzun-Ampuero等[19]利用PLR和HA在水溶液中混合制备了球状的纳米粒载体,并对其进行了评价:平均粒径范围为116~155 nm,Zeta电位与两者的比例有关,为(+31.3~-35.9) mV,用相对分子质量高的HA和PLR制备的纳米粒在生理条件下比较稳定,符合作为基因载体的要求。Kim等[20]对PLR和HA物理混合组成的基因载体HP101进行了研究,其 HA和PLA的质量比(w∶w)为50%∶50%,与单纯的PLR相比,HP101对siRNA的传递效率增加,siRNA/HP101复合物对B16F10细胞的半数中毒量(TC50值)比siRNA/PLR增加了23倍,细胞毒性大大降低,而细胞对两者及其基因复合物的摄取率相差不大。在红色荧光蛋白质(red fluorescent protein,RFP)表达的B16F10细胞,经siRFP/HP101复合物转染处理后,RFP基因的表达水平降低了80%;对B16F10细胞移植瘤内注射siRFP/HP101复合物后,RFP基因在肿瘤组织的表达减少,并且siRNA在CD44+细胞中转染效率高于CD44-细胞,显示出一定的靶向作用。
2.3.6 mPEG-聚乳酸-b-PLR作为基因载体 聚乙二醇(PEG)具有无毒、无刺激性及良好亲水性的特点,能与阳离子聚合物连接以增加后者在血浆中的稳定性,降低其毒性,也能避免聚合物被网状内皮系统(RES)清除[21],但同时也会减少细胞摄取和内涵体逃逸[22]。聚乳酸(polylactic acid,PLA)是乳酸脱水聚合物,可生物降解,有良好的生物相容性,溶于普通溶剂,因此在生物医学领域被广泛应用[23],PLA修饰基因载体后可以降低其细胞毒性。Zhao等[24]合成了聚乙二醇-聚乳酸-b-聚精氨酸(mPEG-PLA-b-R15)基因载体,该载体形成的纳米粒粒径54.3 nm,Zeta电位34.8 mV。mPEG-PLA-b-R15对MCF-7细胞的毒性要远小于PEI和R15,1000 μg/ml的mPEG-PLA-b-R15和R15处理MCF-7细胞24 h后,细胞存活率分别为83.4%和69.9%,而100 μg/ml的PEI处理MCF-7细胞24 h后,细胞存活率为0%,前者显示出较低的细胞毒性,这可能与PLA、PLR可以降解和合适的Zeta电位有关。mPEG-PLA-b-R15与EGFR-siRNA形成的复合物能使MCF-7细胞EGFR的表达减少65%,静脉注射该复合物能显著地抑制荷瘤(MCF-7细胞)小鼠移植瘤的生长及EGFR的表达,且裸鼠未发生固有性免疫应答和体重下降现象,表明该载体对裸鼠几乎没有毒性。
2.3.7 壳聚糖-PLR作为基因载体 壳聚糖带正电荷,本身可以作为基因载体,具有生物可降解性和良好生物相容性的特点,还有黏膜黏附和穿透增强的作用,但壳聚糖作为基因载体的缺点是转染效率比较低[25]。壳聚糖与PLR连接后,既可以降低PLR的细胞毒性,又能产生较高的转染效率。Noh等[26]把PEG、PLR与壳聚糖相连,制备了一种新型的基因载体,并与壳聚糖、PEG-PLR和壳聚糖-PLR进行了比较,发现PEG-PLR-壳聚糖对细胞的毒性比壳聚糖-PLR和PLR低,15 μg/ml的PEG-壳聚糖-PLR/siGL2处理A549细胞,细胞存活率为83.5%。壳聚糖与PLR相连后提高了基因的转染效率,壳聚糖-PLR(77.89%)和PEG-PLR-壳聚糖(79.55%)的基因转染效率明显高于壳聚糖(1.55%)、PEG-壳聚糖(2.67%)和PEG-PLR(2.62%),也高于PLR(26.19%)。荷瘤(B16F10-RFP细胞)小鼠肿瘤内注射PEG-PLR-壳聚糖/siRFP能明显降低移植瘤中RFP基因表达。由此可见,利用PEG和壳聚糖对PLR进行修饰可以降低毒性,同时提高基因转染效率。
3 PLR作为基因载体应用的前景和所面临的问题
在基因治疗领域,开发能够高效、安全传递基因进入细胞并发挥作用的载体系统是一个主要研究方向。PLR及其衍生物是一个很有前景的载体系统,大量的体内外研究证实,PLR及其衍生物是合适的非病毒基因载体材料,特别是对PLR结构进行修饰优化后,保持了其生物相容性和可降解性的优点,初步克服了基因转染效率低,细胞毒性大的缺点。虽然各国科学家在PLR基因载体研究中取得了进展,但离实际应用还有一段距离,未来的研究要解决的问题是:(1)降低载体成本,高纯度的PLR及其衍生物价格仍然较高,限制了其广泛应用和研究;(2)载体的进一步优化,以提高载体的转染效率;(3)载体的特性改进,根据需要改善载体材料的性能,如降解时间、基因与载体的解离部位等;(4)载体的靶向性,确保基因片段能在特定的细胞中发挥作用,减少对其他细胞的影响;(5)载体的转染效率与细胞类型有关,而目前研究仍限于少数细胞系,需要在更多的细胞系中进行实验研究。迄今为止,PLR及其衍生物作为基因载体的研究仅在细胞和动物层面进行,离实际的临床应用还有很长的路要走,相信经过研究者不懈的努力,PLR及其衍生物作为基因载体一定会在基因治疗中取得长足的进展。
【参考文献】
[1]Nam H Y,Nam K,Lee M,etal.Dendrimer type bio-reducible polymer for efficient gene delivery[J].J Control Release,2012,160(3):592-600.
[2]Eguchi A,Dowdy S F.siRNA delivery using peptide transduction domains[J].Trends Pharmacol Sci,2009,30(7):341-345.
[3]Kim T I,Ou M,Lee M,etal.Arginine-grafted bioreducible poly(disulfide amine) for gene delivery systems[J].Biomaterials,2009,30(4):658-664.
[4]Lundberg M,Wikström S,Johansson M.Cell surface adherence and endocytosis of protein transduction domains[J].Mol Ther,2003,8(1):143-150.
[5]Kim S W,Kim N Y,Choi Y B,etal.RNA interferenceinvitroandinvivousing an arginine peptide/siRNA complex system[J].J Control Release,2010,143(3):335-343.
[6]Fuchs S M,Raines R T.Pathway for polyarginine entry into mammalian cells[J].Biochemistry,2004,43(9):2438-2444.
[7]Kunath K,von Harpe A,Fischer D,etal.Low-molecular-weight polyethylenimine as a non-viral vector for DNA delivery:comparison of physicochemical properties,transfection efficiency andinvivodistribution with high-molecular-weight polyethylenimine[J].J Control Release,2003,89(1):113-125.
[8]Breunig M,Lungwitz U,Liebl R,etal.Gene delivery with low molecular weight linear polyethylenimines[J].J Gene Med,2005,7(10):1287-1298.
[10]Hashimoto T,Kawazu T,Nagasaki T,etal.Quantitative comparison between poly (L-arginine) and poly (L-lysine) at each step of polyplex-based gene transfection using a microinjection technique[J].Sci Technol Adv Mater,2012,13(1):015009.
[11]Koo H,Kang H,Lee Y.Analysis of the relationship between the molecular weight and transfection efficiency/cytotoxicity of poly-L-arginine on a mammalian cell line[J].Bull Korean Chem Soc,2009,30(4):927-930.
[12]Ma Yan,Gong Cheng,Ma YiLong,etal.Direct cytosolic delivery of cargoesinvivoby a chimera consisting ofD- andL-arginine residues[J].J Control Release,2012,162(2):286-294.
[13]Luo Kui,Li CaiXia,Li Li,etal.Arginine functionalized peptide dendrimers as potential gene delivery vehicles[J].Biomaterials,2012,33(19):4917-4927.
[14]Tanaka K,Kanazawa T,Ogawa T,etal.Disulfide crosslinked stearoyl carrier peptides containing arginine and histidine enhance siRNA uptake and gene silencing[J].Int J Pharm,2010,398(1-2):219-224.
[15]Won Y W,Kim H A,Lee M,etal.Reducible poly(oligo-D-arginine) for enhanced gene expression in mouse lung by intratracheal injection[J].Mol Ther,2010,18(4):734-742.
[16]Won Y W,Yoon S M,Lee K M,etal.Poly(oligo-D-arginine) with internal disulfide linkages as a cytoplasm-sensitive carrier for siRNA delivery[J].Mol Ther,2011,19(2):372-380.
[17]Cho H J,Chong S,Chung S J,etal.Poly-L-arginine and dextran sulfate-based nanocomplex for epidermal growth factor receptor (EGFR) siRNA delivery:its application for head and neck cancer treatment[J].Pharm Res,2012,29(4):1007-1019.
[18]Platt V M,Szoka F C Jr.Anticancer therapeutics:targeting macromolecules and nanocarriers to hyaluronan or CD44,a hyaluronan receptor[J].Mol Pharm,2008,5(4):474-486.
[19]Oyarzun-Ampuero F A,Goycoolea F M,Torres D,etal.A new drug nanocarrier consisting of polyarginine and hyaluronic acid[J].Eur J Pharm Biopharm,2011,79(1):54-57.
[20]Kim E J,Shim G,Kim K,etal.Hyaluronic acid complexed to biodegradable polyL-arginine for targeted delivery of siRNAs[J].J Gene Med,2009,11(9):791-803.
[21]Sato A,Choi S W,Hirai M,etal.Polymer brush-stabilized polyplex for a siRNA carrier with long circulatory half-life[J].J Control Release,2007,122(3):209-216.
[22]Ayano E,Karaki M,Ishihara T,etal.Poly (N-isopropylacrylamide)-PLA and PLA blend nanoparticles for temperature-controllable drug release and intracellular uptake[J].Colloids Surf B:Biointerfaces,2012,99:67-73.
[23]Efthimiadou E K,Tziveleka L A,Bilalis P,etal.Novel PLA modification of organic microcontainers based on ring opening polymerization:synthesis,characterization,biocompatibility and drug loading/release properties[J].Int J Pharm,2012,428(1-2):134-142.
[24]Zhao ZhiXia,Gao ShanYun,Wang JianCheng,etal.Self-assembly nanomicelles based on cationic mPEG-PLA-b-Polyarginine(R15) triblock copolymer for siRNA delivery[J].Biomaterials,2012,33(28):6793-6807.
[25]Mao ShiRui,Sun Wei,Kissel T.Chitosan-based formulations for delivery of DNA and siRNA[J].Adv Drug Deliv Rev,2010,62(1):12-27.
[26]Noh S M,Park M O,Shim G,etal.Pegylated poly-L-arginine derivatives of chitosan for effective delivery of siRNA[J].J Control Release,2010,145(2):159-164.
