TAT-Cytoglobin融合蛋白的原核表达、纯化及生物活性分析
2014-06-24张如婧李招发施伟杰许瑞安
张如婧,李招发,2,施伟杰,许瑞安,2
1 华侨大学生物医学学院,福建 泉州 362021
2 分子药物教育部工程研究中心,福建 泉州 362021
医学与免疫生物技术
TAT-Cytoglobin融合蛋白的原核表达、纯化及生物活性分析
张如婧1,李招发1,2,施伟杰1,许瑞安1,2
1 华侨大学生物医学学院,福建 泉州 362021
2 分子药物教育部工程研究中心,福建 泉州 362021
旨在利用细胞穿膜肽TAT的穿膜作用和细胞珠蛋白 (Cytoglobin, Cygb) 的抗衰老、抗纤维化的功能,将二者通过基因工程的手段融合在一起,以期获得能够穿透细胞屏障的Cygb。通过两次重叠PCR技术获得了TAT-Cygb DNA,将其插入原核表达载体pET22b质粒中,转化至大肠杆菌BL-21, 筛选出可表达TAT-Cygb融合蛋白的大肠杆菌工程菌株。经乳糖诱导表达TAT-Cygb,CM阳离子交换层析 (CM Sepharose Fast Flow Protocol) 获得纯度高达95%的TAT-Cygb融合蛋白,分子量约23 kDa。生物活性实验显示,TAT-Cygb过氧化物酶比活力达到(422.30±0.36) U/mg。TAT-Cygb预处理的Hacat细胞可免受H2O2氧化应激的损伤 (RGR=100%),同时TAT-Cygb可治疗已被H2O2氧化损伤的细胞 (RGR=98%),与Cygb处理组相比具有显著差异 (RGR=79%)。该研究首次成功利用大肠杆菌表达系统表达了可穿透细胞膜的、有生物活性的TAT-Cygb融合蛋白,为继续开展Cygb在抗衰老、抗纤维化和抗癌领域的研究奠定了基础。
细胞穿膜肽,细胞珠蛋白,融合蛋白,纯化,氧化应激
细胞珠蛋白 (Cytoglobin, Cygb) 是由190个氨基酸组成、分子量为21.4 kDa的一种细胞内球蛋白,在高等脊椎动物各组织中广泛分布[1],最初由Kawada等在大鼠肝星状细胞 (Hepatic stellate cells,HSC) 中发现[2]。研究表明Cygb具有过氧化物酶活性,可清除氧自由基,因此可保护组织免受氧化应激的损伤[3-6]。本课题组曾通过siRNA干扰内源性Cygb基因,在人肝星状细胞系LX-2内过表达Cygb,证明内源性Cygb对过氧化氢及铁过载两种氧化应激模型导致的肝星状细胞损伤都具有显著性的保护作用,而体外Cygb对细胞内的活性氧清除效果不理想,推测与Cygb进出细胞缺乏相应的主动运输机制有关[7]。因此体外表达的Cygb成功进入细胞便成为发挥Cygb作用的前提和关键。
细胞穿膜肽,即CPPs,又称为蛋白转导域或膜转导肽,是一种由30个或者更少氨基酸组成的能够穿透细胞膜的多肽,能够运载生物活性物质如肽、蛋白、反义核苷酸和脂质体等许多物质[8-10]。TAT是最短的CPPs之一,含有11个氨基酸,已证明通过TAT的N端连接的融合蛋白能够在体外转导几乎所有检测过的细胞类型[11-13]。本实验通过将TAT与人源Cygb融合表达,使Cygb在TAT介导下转入细胞,并表现出很好的过氧化物酶等生物活性,有望应用于护肤品行业,同时促进了Cygb在抗衰老、抗纤维化和抗癌方面的研究[14-15]。
1 材料与方法
1.1 材料
人Cygb质粒、pET22b(+)、大肠杆菌Escherichia coli DH5α和E. coli BL21 (DE3) 均为本实验室保存。Pfu、T4 DNA连接酶、DNA纯化凝胶回收试剂盒购自碧云天生物技术有限公司。NdeⅠ、EcoRⅠ购自大连宝生物工程有限公司。1 kb DNA Ladder购自北京索莱宝科技有限公司。DNA Marker V购自北京庄盟国际生物基因科技有限公司。基因工程引物TAT-1、TAT-2和TAT-3由上海赛百盛基因技术有限公司合成。鼠抗Cygb一抗和羊抗鼠HRP-IgG抗体购自Santa Cruz。CM-Sepharose购自GE医疗生物科学公司。人正常肝细胞株Chang Liver购自复旦大学。人永生化角质细胞Hacat购买自中国科学院昆明细胞库。
1.2 方法
1.2.1 原核表达载体pET22b-TAT-Cygb的构建
通过两次PCR,利用特异引物基因序列 (表1) 将编码穿膜肽TAT (YGRKKRRQRRR)以及TAT和Cygb之间的Linker (GGGGSGGGGS) 的核苷酸序列添加到Cygb基因的5′端,并在引物TAT-2和TAT-3中分别加入NdeⅠ和EcoRⅠ限制性酶切位点。第一次PCR以人Cygb质粒为模板,用上游引物TAT-1和下游引物TAT-3进行扩增;第二次PCR以经凝胶回收的第一次PCR产物作为模板,用上游引物TAT-2和下游引物TAT-3扩增,得到TAT-Cygb成熟蛋白对应的DNA。目的片段回收、酶切后插入至pET22b(+) 载体的NdeⅠ/EcoRⅠ位点之间。转化入E. coli DH5α后经菌落 PCR、酶切等方法筛选出符合要求的阳性克隆,委托南京金斯瑞公司对pET22b(+)中插入的TAT-Cygb基因序列进行测序。
1.2.2 TAT-Cygb融合蛋白的诱导表达与纯化
将pET22b-TAT-Cygb表达载体转入感受态的E. coli BL21宿主菌,菌落PCR鉴定。取阳性克隆接种于乳糖诱导培养基中培养20 h,10 000 r/min离心收集菌体沉淀,并置于–80 ℃和4 ℃反复冻融两次裂解细菌,用Tris-HCl上样缓冲液 (20 mmol/L Tris-HCl,pH 8.0) 重悬全菌蛋白。15 000 r/min、4 ℃离心15 min收集上清。由于TAT中含有多个带正电的氨基酸,使融合蛋白TAT-Cygb等电点升高,因此可通过阳离子交换层析 (CM Sepharose Fast Flow Protocol) 纯化蛋白。样品过柱后,用清洗缓冲液 (20 mmol/L Tris-HCl,100 mmol/L NaCl,pH 8.0) 洗去杂蛋白,再用洗脱缓冲液 (20 mmol/L Tris-HCl,500 mmol/L NaCl,pH 8.0) 洗脱,收集唯一的洗脱峰即为融合蛋白。经Sephadex G-25凝胶过滤层析脱盐后,SDS-PAGE电泳检测纯度。
1.2.3 免疫印迹鉴定
纯化的融合蛋白经SDS-PAGE分离后电转至硝酸纤维素膜上,用5%脱脂奶粉封闭2 h,滴加鼠抗Cygb一抗 (1∶300),4 ℃孵育过夜,TBST洗膜3次,再滴加HRP标记的羊抗鼠抗体 (1∶1 000),37 ℃孵育2 h,TBST和PBS各洗膜3次,最后使用BeyoECL荧光检测试剂检测目的蛋白,X胶片曝光后显影、定影。

表1 构建融合蛋白TAT-Cygb原核表达载体所用引物序列Table 1 Primer sequences for the construction of TAT-Cygb expression vectors
1.2.4 细胞免疫化学验证TAT-Cygb的穿膜能力
取对数生长期的Chang liver细胞消化后,按30 000细胞/孔接种于24孔板中,2 mL/孔。培养48 h后,加药作用细胞,空白对照加无血清培养基,阴性对照加10 μmol/L Cygb的无血清培养基,实验组加含10 μmol/L TAT-Cygb的无血清培养基。加药作用1.5 h后,PBS洗3次;固定液室温作用15 min后,PBS洗3次;通透液室温孵育20 min后,PBS洗3次;内源性过氧化物酶阻断剂室温作用15 min后,PBS洗3次;封闭液37 ℃孵育1 h后,PBS洗3次;加入抗Cygb鼠抗 (1∶200) 4 ℃孵育过夜后,PBS洗3次;加入HRP标记的羊抗鼠抗体 (1∶1 000) 37 ℃孵育2 h后,PBS洗3次。DAB方法进行显色,具体方法见迈新DAB显色试剂盒。显色完全后用中性树脂封藏。
1.2.5 表达产物活性分析
1) TAT-Cygb蛋白过氧化物酶活性的测定:利用愈创木酚法测定重组TAT-Cygb蛋白的过氧化物酶活性。将波长470 nm处反应体系每分钟吸光值A变化0.01定义为一个过氧化物酶活力单位。每毫克蛋白所含的酶活力单位数为比活力。实验重复3次,得出纯化后的重组TAT-Cygb蛋白过氧化物酶活性。
2) TAT-Cygb对人永生化角质细胞Hacat增殖的影响:取对数生长期的Hacat细胞消化后,按10 000细胞/孔接种于96孔板中,100 μL/孔。贴壁后加入TAT-Cygb蛋白 (终浓度依次为10、20、30、40、50、60 mg/L),对照组加等体积PBS,于37 ℃作用48 h,PBS洗3次,加入10 μL 5 mg/mL MTT (工作浓度0.5 mg/mL),37 ℃孵育4 h。弃掉MTT,加DMSO 150 μL,微量振荡器上振荡10 min。以DMSO调零,在酶联免疫检测仪于492 nm波长测定OD值,参照波长630 nm。
3) TAT-Cygb蛋白抗氧化作用:利用H2O2对Hacat细胞的氧化模型来研究TAT-Cygb蛋白抗氧化作用。取对数生长期的Hacat细胞消化后,按10 000细胞/孔接种于96孔板中,100 μL/孔。贴壁后加入终浓度为200 μmol/L的H2O2于37 ℃作用48 h,进行MTT检验。TAT-Cygb (60 mg/L,20 mg/L) 或Cygb (60 mg/L,20 mg/L) 分别于H2O2处理前30 min或H2O2处理后30 min加入培养液中。
2 结果与分析
2.1 表达载体pET22b-TAT-Cygb的构建与鉴定
通过两次PCR法从人Cygb质粒中扩增Cygb基因序列,并连接上穿膜肽TAT序列得到TAT-Cygb序列,回收DNA片段长度约654 bp,与预计值相符。将Nde/ⅠEcoRⅠ酶切PCR产物插入pET22b (+),成功构建pET22b-TAT-Cygb原核表达载体,并转化至E. coli DH5α感受态细胞。菌落PCR、质粒酶切图谱 (图1A) 及测序结果显示pET22b-TAT-Cygb重组质粒构建成功。
2.2 TAT-Cygb融合蛋白的表达纯化与鉴定
将pET22b-TAT-Cygb表达载体转入感受态的E. coli BL21宿主菌,涂布LB平板,经菌落PCR扩增出的654 bp片段的菌落为阳性克隆(图1B)。菌体裂解后的上清,经过阳离子交换(CM Sepharose Fast Flow Protocol) 层析,并经Sephadex G-25凝胶过滤层析脱盐、过滤除菌后就得到TAT-Cygb蛋白原液。通过该纯化工艺,可以获得纯度大于95%的TAT-Cygb蛋白。纯化过程中TAT-Cygb蛋白产物的纯度分析见图2A。目的蛋白TAT-Cygb蛋白分子量约为23 kDa,由于TAT中碱性氨基酸比例较高,使其在SDS-PAGE上的迁移率变小,因此显示的分子量略有偏大。Western blotting分析表明,TAT-Cygb融合蛋白可与鼠抗Cygb发生特异性反应,说明纯化的融合蛋白是有活性的TAT-Cygb (图2B)。用BCA蛋白检测试剂盒测定TAT-Cygb蛋白原液浓度为2.105 g/L。
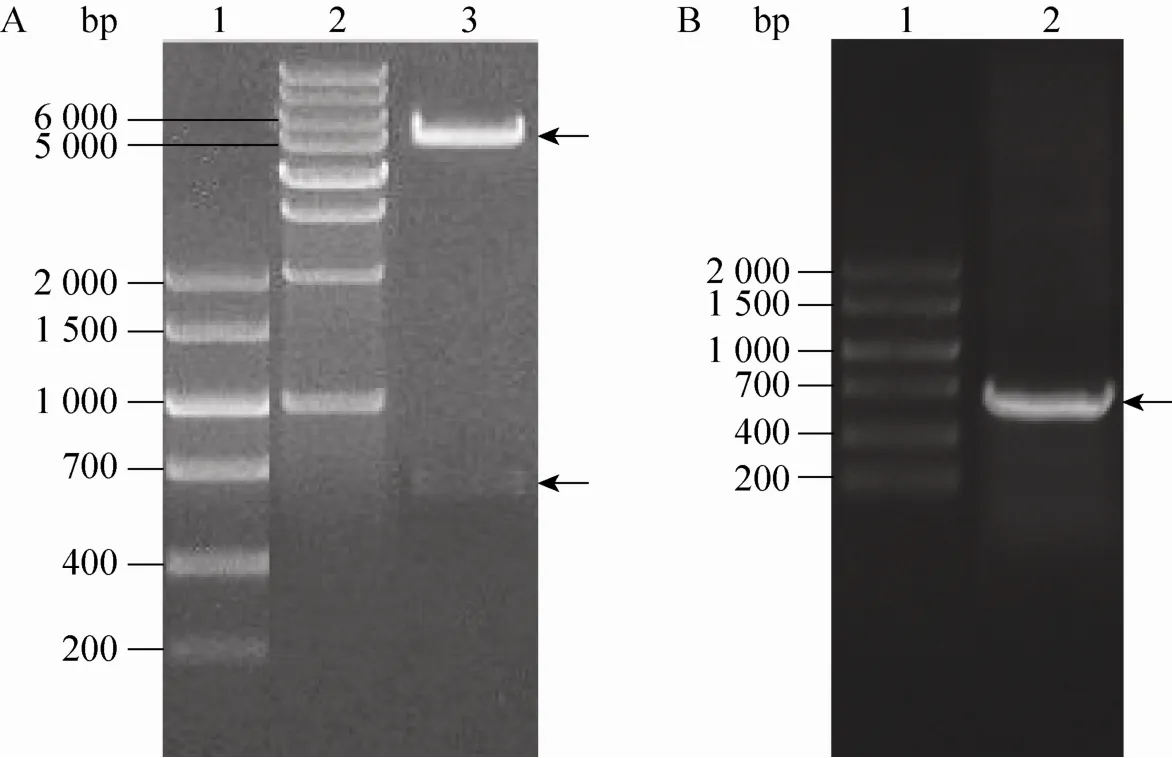
图1 重组表达质粒pET22b-TAT-Cygb和BL21阳性转化子的鉴定Fig. 1 Identification of recombinant expression vector pET22b-TAT-Cygb and BL21 positive transformants. (A) PCR and restriction analysis of pET22b-TAT-Cygb. 1: DNA marker V; 2: 1 kb DNA ladder; 3: pET22b-TAT-Cygb digested with EcoRⅠand NdeⅠ. (B) PCR analysis of BL21 positive transformants. 1:DNA marker V; 2: BL21/pET22b-TAT-Cygb cDNA.
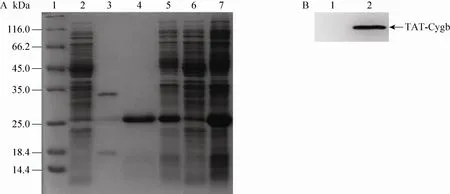
图2 融合蛋白TAT-Cygb的纯化及Western blotting分析Fig. 2 Analysis of the TAT-Cygb fusion proteins purified by CM Sepharose Fast Flow Protocol. (A) SDS-PAGE analysis. 1: protein marker; 2: flow-though; 3: the eluted fractions with 100 mmol/L NaCl; 4: the eluted fractions with 500 mmol/L NaCl; 5: lysate of E. coli BL21 transformed with pET22b-TAT-Cygb; 6, 7: supernatant and sediment of lysate from E. coli BL21 transformed with pET22b-TAT-Cygb. (B) Western blotting analysis. 1: sample from BL21/pET22b; 2: sample from BL21/pET22b-TAT-Cygb.
2.3 细胞免疫化学
将人正常肝细胞株Chang Liver分别用含一定浓度Cygb和TAT-Cygb的无血清DMEM处理后的细胞免疫化学结果表明,Cygb处理组细胞内Cygb含量与空白对照组相差不大,细胞中含有少量的内源性Cygb蛋白,呈略微的淡棕黄色(图3A,3B);而TAT-Cygb处理组细胞与空白对照组和Cygb处理组相比,着色程度明显加深,说明穿膜肽TAT可以很好地运输Cygb进入细胞(图3C)。

图3 ICC鉴定TAT-Cygb的穿膜作用Fig. 3 Transmembrane ability of TAT-Cygb identified by immunocytochemistry. (A–C) The level of Cygb in Chang Liver. (A1, A2) control Chang Liver. (B1, B2) Chang Liver treated with Cygb. (C1, C2) Chang Liver treated with TAT-Cygb. (A1, B1, C1 magnification 10×; A2, B2, C2 magnification 40×).
2.4 活性分析
2.4.1 过氧化物酶活性测定
利用愈创木酚法测得纯化后的TAT-Cygb蛋白的过氧化物酶的比活为(422.30±0.36) U/mg。
2.4.2 TAT-Cygb对人永生化角质细胞Hacat增殖的影响
如图4所示,随着作用于细胞的TAT-Cygb浓度增大,细胞相对增殖率呈小幅上升趋势,表明在一定浓度范围内,TAT-Cygb不仅对Hacat细胞无毒性,还有助于提高细胞增殖能力。
2.4.3 TAT-Cygb对氧化反应引起的细胞损伤的作用
如图5所示,200 μmol/L H2O2对Hacat细胞表现出明显的毒性,抑制率约24%。在预处理TAT-Cygb和Cygb蛋白实验组中,高、低浓度的TAT-Cygb和Cygb蛋白都能在一定程度上保护细胞免受H2O2氧化应激损伤;在提前30 min加入H2O2处理的治疗性实验组中,高、低浓度的TAT-Cygb蛋白能缓和H2O2对细胞造成的损伤,细胞相对增殖率分别为98%和88% (P<0.01),而加入Cygb蛋白的细胞相对增殖率仅为79%,与H2O2氧化应激模型组相比未表现出显著性差异 (P>0.05)。这表明与TAT-Cygb相比,Cygb由于缺乏主动进入细胞的能力,只能在预处理Cygb的情况下保护细胞,并不能治疗被H2O2作用30 min后损伤的细胞,而TAT-Cygb蛋白不仅可以保护细胞免受氧化攻击,还能穿透细胞屏障治疗已氧化损伤的细胞。

图4 TAT-Cygb蛋白对Hacat细胞增殖的影响Fig. 4 Effects of TAT-Cygb protein on Hacat cell proliferation. **P<0.01.

图5 TAT-Cygb蛋白的抗氧化作用Fig. 5 The antioxidation of TAT-Cygb protein. 1: normal control; 2: 200 μmol/L H2O2; 3: 20 mg/L protein before 200 μmol/L H2O2; 4: 60 mg/L protein before 200 μmol/L H2O2; 5: 20 mg/L protein after 200 μmol/L H2O2; 6: 60 mg/L protein after 200 μmol/L H2O2. *P<0.05; **P<0.01.
3 讨论
体外表达胞内Cygb已经有不少成功的报道[16-20],但Cygb作为一种胞浆蛋白,尚缺乏进出细胞相应的主动运输机制[21-24]。本实验采用基因工程手段在 Cygb 蛋白上连接小分子穿膜肽TAT,即可促使胞内蛋白Cygb穿透细胞膜进入胞内发挥生物学功能。通过构建pET22b-TATCygb/E. coli BL21表达工程菌,采用廉价的乳糖诱导培养基成功诱导表达TAT-Cygb蛋白。由于TAT含有多个带正电的氨基酸,使得TAT-Cygb融合蛋白等电点升高,下游纯化非常方便,粗分离的蛋白只需经过一步CM Sepharose FastFlow Protocol层析就能得到纯度高达95%的目的蛋白。
因TAT-Cygb蛋白的融合性,需要分别考察组成TAT-Cygb的蛋白或多肽部分的活性。只有确定了TAT能够将Cygb导入细胞,才能考究Cygb对于细胞的作用。本实验首先利用Western blotting确定了TAT-Cygb能与Cygb抗体结合,再通过免疫细胞化学实验证明了TAT-Cygb的穿膜能力。这在考察TAT穿膜能力的同时验证了TAT-Cygb中Cygb结构和功能的正确性。
Cygb蛋白具有过氧化酶活性及氧自由基清除剂的作用。本课题组曾用重组Cygb蛋白作用于过氧化氢氧化应激损伤的肝星状细胞,发现Cygb蛋白对氧化损伤细胞无明显治疗作用[7],推测Cygb蛋白因缺乏细胞表面受体或其他的主动运输机制,较难被细胞吸收并在胞内发挥作用。因此,本实验借助穿膜肽TAT的功能,将TAT-Cygb融合蛋白作用于氧化损伤的人永生化角质细胞Hacat,证明TAT-Cygb不仅可以保护细胞免受氧化应激的损伤,还能治疗已损伤的细胞。这进一步验证了TAT-Cygb可以穿透细胞膜进入细胞发挥抗氧化的作用。
本实验创新性地将穿膜肽TAT与Cygb融合表达,克服了胞内蛋白Cygb无法穿透细胞膜发挥生物学功能的难题,使Cygb蛋白在细胞内发挥抗氧化、消除自由基、增加胶原表达、促进新生血管生成和抗炎症等功能成为可能。本文为研究Cygb在抗氧化、抗炎症、抗肝纤维化和抗癌领域的作用和具体机制奠定了基础,为加速药物新靶点开发提供了理论依据。
REFERENCES
[1] de Sanctis D, Dewilde S, Pesce A, et al. Crystal structure of cytoglobin: the fourth globin type discovered in man displays heme hexacoordination. J Mol Biol, 2004, 336(4): 917–927.
[2] Kawada N, Kristensen D, Asahina K, et al. Characterization of a stellate cell activationassociated protein (STAP) with peroxidase activity found in rat hepatic stellate cells. J Biol Chem, 2001, 276: 25318–25323.
[3] Fordel E, Thijs L, Martinet W, et al. Neuroglobin and cytoglobin overexpression protects human SH-SY5Y neuroblastoma cells against oxidative stress-induced cell death. Neurosci Lett, 2006, 410: 146–151.
[4] Fordel E, Thijs L, Moens L, et al. Neuroglobin and cytoglobin expression in mice. Evidence for a correlation with reactive oxygen species scavenging. FEBS J, 2007, 274(5): 1312–1317.
[5] Li D, Chen XQ, Li WJ, et al. Cytoglobin up-regulated by hydrogen peroxide plays a protective role in oxidative stress. Neurochem Res, 2007, 32: 1375–1380.
[6] Fang J, Ma I, Allalunis-Turner J. Knockdown of cytoglobin expression sensitizes human glioma cells to radiation and oxidative stress. Radiat Res, 2011, 176: 198–207.
[7] Lü YH, Wang QZ, Li ZF, et al. Role of cytoglobin in protecting hepatic stellate cells against oxidation induced damage. Chin J Biotech, 2011, 27(8): 1174–1182 (in Chinese).
吕颖慧, 王启钊, 李招发, 等. 细胞珠蛋白对肝星状细胞氧化损伤的保护作用. 生物工程学报, 2011, 27(8): 1174–1182.
[8] Ezzat K, Zaghloul EM, El Andaloussi S, et al. Solid formulation of cell-penetrating peptide nanocomplexes with siRNA and their stability in simulated gastric conditions. J Control Release, 2012, 162(1): 1–8.
[9] Vivès E. Present and future of cell-penetrating peptide mediated delivery systems: “is the Trojan horse to wild to go only to Troy?”. J Control Release, 2005, 109(1/3): 77–85.
[10] Nasrollahi SA, Taghibiglou C, Azizi E, et al. Cell-penetrating peptides as a novel transdermaldrug delivery system. Chem Biol Drug Des, 2012, 80(5): 639–646.
[11] Robinson C, Matos CF, Beck D, et al. Transport and proofreading of proteins by the twin-arginine translocation (Tat) system in bacteria. Biochim Biophys Acta, 2011, 1808(3): 876–884.
[12] Kaplan IM, Wadia JS, Dowdy SF. Cationic TAT peptide transduction domain enters cells by macropinocytosis. J Control Release, 2005, 102(1): 247–253.
[13] Ma X, Zheng W, Wei D, et al. Construction, expression, and purification of HIV-TAT-survivin (T34A) mutant: a pro-apoptosis protein in Escherichia coli. Protein Expr Purif, 2006, 47(1): 36–44.
[14] Li ZF, Zhao XF, Zhang TT. A preliminary study of anti-aging and wound healing of recombination cytoglobin. Acta Pharm Sin, 2012, 47(1): 51–57 (in Chinese).
李招发, 赵晓芳, 张亭亭. 重组细胞珠蛋白抗衰老及创伤愈合的初步研究. 药学学报, 2012, 47(1): 51–57.
[15] Li ZF, Deng XY, Xu JJ, et al. Protective effects of PEG modified recombinant cytoglobin on acute liver injury in mice. Chin J Biotech, 2012, 28(10): 1227–1235 (in Chinese).
李招发, 邓小英, 许佳佳, 等. 聚乙二醇修饰重组细胞珠蛋白对小鼠急性肝损伤的保护作用. 生物工程学报, 2012, 28(10): 1227–1235.
[16] Wei W, Wu WT. Study on the bioactivity of recombinant human stellate cell activationassociated protein in vitro. Pharm Biotech, 2007, 14(6): 401–405 (in Chinese).
魏威, 吴梧桐. 重组人源肝星状细胞激活相关蛋白体外生物活性的研究. 药物生物技术, 2007, 14(6): 401–405.
[17] Tian SY, Li LZ, Li HL, et al. Expression, purification and spectral characterization of recombinant human cytoglobin. Chem J Chinese U, 2009, 30: 483–488 (in Chinese).
田素燕, 李连之, 李海丽, 等. 重组人细胞红蛋白的表达纯化及谱学表征. 高等学校化学学报, 2009, 30: 483–488.
[18] Zhang TT, Li ZF, Xu RA. Preparation, purification and activity of recombinant rat cytoglobin. J Huaqiao Univ: Nat Sci, 2009, 30(6): 671–675 (in Chinese).
张亭亭, 李招发, 许瑞安. 重组大鼠细胞球蛋白的制备、纯化与活性. 华侨大学学报: 自然科学版, 2009, 30(6): 671–675.
[19] Xu RA, Shi WJ. Recombinant human cytoglobin with TAT and its application in the treatment of liver cancer: CN, 101863985 B. 2012-12-26 (in Chinese).
许瑞安, 施伟杰. 重组融合Tat人源细胞球蛋白及其在治疗肝癌中的应用: 中国, 101863985 B. 2012-12-26.
[20] Jie ZW, Jia XJ, Qian J, et al. Study on purification and antioxidant activity of recombinant human cytoglobin. Pharm Biotechnol, 2010, 17(1): 45–49 (in Chinese).
接振旺, 贾晓健, 钱杰, 等. 胞红蛋白表达纯化及抗氧化活性研究, 药物生物技术, 2010, 17(1): 45–49.
[21] Trent JT III, Hargrove MS. A ubiquitously expressed human hexacoordinate hemoglobin. J Biol Chem, 2002, 277(22): 19538–19545.
[22] Burmester T, Ebner B, Weich B, et al. Cytoglobin: a novel globin type ubiquitously expressed in vertebrate tissues. Mol Biol Evol, 2002, 19(4): 416–421.
[23] Schmidt M, Gerlach F, Avivi A, et al. Cytoglobin is a respiratory protein in connective tissue and neurons, which is up-regulated by hypoxia. J Biol Chem, 2004, 279(9): 8063–8069.
[24] Shigematsu A, Adachi Y, Matsubara J, et al. Analyses of expression of cytoglobin by immunohistochemical studies in human tissues. Hemoglobin, 2008, 32(3): 287–296.
(本文责编 陈宏宇)
Expression, purification, and characterization of fusion protein TAT-Cytoglobin
Rujing Zhang1, Zhaofa Li1,2, Weijie Shi1, and Rui'an Xu1,2
1 School of Biomedical Sciences, Huaqiao University, Quanzhou 362021, Fujian, China
2 Engineering Research Center of Molecular Medicine, Ministry of Education, Quanzhou 362021, Fujian, China
The aim of this study was to obtain a cell-penetrating cytoglobin (Cygb), which combines the transmembrane function of cell-penetrating peptides TAT with the anti-aging and anti-fibrotic role of cytoglobin. The Cygb gene was complexed with TAT gene by overlapping PCR, inserted into the vector pET22b to construct the recombinant expression plasmid (pET22b-TAT-Cygb) and then transformed into Escherichia coli BL21 (DE3). The fusion protein TAT-Cygb, whose expression was induced by lactose, was purified by CM Sepharose Fast Flow Protocol and verified by Western blotting. The final TAT-Cygb had a molecular weight of 23 kDa with 95% purity, as shown by SDS-PAGE. As demonstrated by bioactivity experiments, TAT-Cygb exhibited a high specific peroxidase activity up to (422.30±0.36) U/mg. Both TAT-Cygb and Cygb pretreatment group could protect Hacat cells against oxidation of H2O2, but only TAT-Cygb treatment group could remedy cells injuried by H2O2(RGR=98%), which was significantly different from Cygb treatment group (RGR=79%). We successfully obtained the bioactive and cell-penetrating fusion protein TAT-Cygb that has the potential application in anti-aging, anti-fibrotic and anti-cancer.
cell-penetrating peptides, cytoglobin, fusion protein, purification, oxidative stress
November 11, 2013; Accepted: December 13, 2013
Zhaofa Li. Tel/Fax: +86-595-22690838; E-mail: lizhaofa@hqu.edu.cn
张如婧, 李招发, 施伟杰, 等. TAT-Cytoglobin融合蛋白的原核表达、纯化及生物活性分析. 生物工程学报, 2014, 30(8):1247−1255.
Zhang RJ, Li ZF, Shi WJ, et al. Expression, purification, and characterization of fusion protein TAT-Cytoglobin. Chin JBiotech, 2014, 30(8): 1247−1255.
Supported by: National Natural Science Foundation of China (Nos. 81072578, 81271692).
国家自然科学基金 (Nos. 81072578, 81271692) 资助。
时间:2014-02-25 网络出版地址:http://www.cnki.net/kcms/doi/10.13345/j.cjb.130573.html
