基于重组溶葡球菌酶和ATP生物发光技术特异定量检测金黄色葡萄球菌
2014-06-24李玉元米志强安小平周育森童贻刚
李玉元,米志强,安小平,周育森,童贻刚
1 广西医科大学,广西 南宁 530021
2 军事医学科学院微生物流行病研究所 病原微生物生物安全国家重点实验室,北京 100071
基于重组溶葡球菌酶和ATP生物发光技术特异定量检测金黄色葡萄球菌
李玉元1,2,米志强2,安小平2,周育森1,2,童贻刚2
1 广西医科大学,广西 南宁 530021
2 军事医学科学院微生物流行病研究所 病原微生物生物安全国家重点实验室,北京 100071
基于重组溶葡球菌酶和ATP生物发光法建立特异定量检测金黄色葡萄球菌的方法。优化设计合成溶葡球菌酶序列,构建重组表达载体pQE30-Lys,转化至大肠杆菌M15并诱导表达,镍柱纯化得到目的蛋白。利用重组溶葡球菌酶和ATP生物发光法特异定量检测金黄色葡萄球菌并与平板计数对比。成功表达了重组溶葡球菌酶,并建立了特异定量检测金黄色葡萄球菌的方法,与平板计数具有显著线性关系。本研究建立的将重组溶葡球菌酶和ATP生物发光法相结合的检测方法操作快捷简单,具有良好的应用前景。
金黄色葡萄球菌,重组溶葡球菌酶,ATP生物发光,特异和定量检测
金黄色葡萄球菌 (简称金葡菌) 是人类皮肤表面常见菌群,但它同时也是一种非常重要的致病菌,能够引起小到皮肤病大到肺炎及菌血症这类威胁人类生命的疾病[1-5]。不仅仅是人类,家畜也容易感染金黄色葡萄球菌,金葡菌能够导致奶牛乳腺炎及鸡传染性关节炎,这严重威胁了食品健康,导致食品污染,带来重大经济损失[6-7]。值得注意的是,耐药金葡菌的感染不断增加,例如,耐甲氧西林金葡菌 (MRSA)和耐万古霉素金葡菌 (VRSA) 已引起更多关注,因为金葡菌是医院感染最常见的原因[8-12]。因此,建立快速检测金黄色葡萄球菌的方法,对于防治金黄色葡菌球菌感染,进行早期治疗减少损失是非常必要的。
本研究基于重组溶葡球菌酶和ATP生物发光法建立金黄色葡萄球菌快速检测方法。溶葡球菌酶 (Lysostaphin) 是从模仿葡萄球菌Staphylococcus simulans中分离出来的一种含锌的金属蛋白酶,具有水解葡萄球菌细胞壁肽聚糖五肽桥联的催化活性,对金葡菌有强大的溶菌作用[13-15];ATP生物发光测定法是快速检测微生物的方法之一[16-17],在Mg2+存在下,荧光素酶 (Luciferase) 以D-荧光素、ATP、O2为底物,将化学能转化为光能,发出荧光,根据ATP与荧光素反应产生荧光的原理, 可对微生物细胞内的ATP进行测定,从而定量检测细菌数[18-20]。所以,本实验室首先利用重组溶葡球菌酶裂解金葡菌释放ATP,然后结合ATP生物发光法,实现对金葡菌的快速检测。
1 材料与方法
1.1 材料
1.1.1质粒和菌株
pQE30质粒由本实验室保存。克隆菌株E. coli Trans1-T1购自北京全式金生物技术有限公司;表达菌株E. coli M15购自北京博迈德生物技术有限公司;金黄色葡萄球菌ATCC 25923购自美国模式培养物集存库 (ATCC),其他菌株来源于军事医学科学院附属医院临床检验科,本实验室保存。
1.1.2主要试剂和设备
LB培养基:蛋白胨1%,酵母提取物0.5%,NaCl 1%,pH 7.0,制作平板时加入1.5%琼脂粉,制作半固体时加入0.75%琼脂粉,121 ℃高压灭菌20 min。
限制性内切酶BamHⅠ-HF、Hind Ⅲ-HF和T4 DNA连接酶购自NEB公司。DNA Marker、Protein Marker和质粒提取试剂盒均购自北京博迈德生物技术有限公司;镍柱预装柱购自上海生工生物工程有限公司;Profile-1 3560 (10X) ATP微生物快速检测系统购自北京浩正智信科技有限公司;752紫外-可见分光光度计购自上海菁华科技仪器有限公司。
化学试剂均为国产分析纯,由本实验室保存制备。
1.2 方法
1.2.1目的基因的合成及重组表达载体的构建
在NCBI上得到Lysostaphin (Staphylococcus simulans by stashylolyticus) 的基因序列 (GenBank Accession No. 8864975),对其进行优化设计,使其更易于在大肠杆菌原核表达系统中进行可溶性表达,分别设计上下游酶切位点BamHⅠ (GGATCC)和Hind Ⅲ (AAGCTT),片段大小753 bp,由金唯智生物科技 (北京) 有限公司合成。
BamHⅠ和Hind Ⅲ双酶切目的基因和表达载体pQE30,连接转化至大肠杆菌Trans1-T1。挑取阳性克隆经酶切初步鉴定正确的进行测序,将测序正确的重组质粒命名为pQE30-Lys。
1.2.2重组溶葡球菌酶的诱导表达、纯化
将构建正确的重组质粒pQE30-Lys转化至表达菌株E. coli M15中,涂于含有氨苄抗生素(终浓度100 μg/mL) 的固体LB培养基平板中,倒置平板,37 ℃过夜培养。挑取单克隆37 ℃振荡培养过夜,次日按1∶100比例转接至500 mL新鲜氨苄抗性培养基,37 ℃振荡培养至OD600值约0.6−0.8,加入诱导剂IPTG至终浓度为1.0 mmol/L,37 ℃继续振荡培养6–8 h后收集菌液。诱导后的菌液10 000×g离心10 min,弃掉上清,PBS重悬菌体,超声波破碎处理后10 000×g离心10 min,收集上清经0.45 μm滤膜过滤后采用镍柱纯化的方式回收目的蛋白,表达及纯化结果以SDS-PAGE方法检测。
1.2.3重组溶葡球菌酶活性检测
将金葡菌 (金葡菌标准菌株ATCC 25923和173株临床分离的金葡菌) 和其他7株受试菌(108大肠杆菌、095沙门氏菌、012嗜麦芽窄食单胞菌、002粪肠球菌、071鲍曼不动杆菌、084大肠埃希菌、003肺炎克雷伯菌) 培养至对数期,取500 μL铺双层LB平板,室温静置10 min,吸取1 μL酶液滴于平板上,同时以缓冲液PBS作阴性对照,37 ℃倒置培养3–4 h后观察结果。
1.2.4平板计数金葡菌ATCC 25923和其他7株受试菌
将培养好的菌液离心 (10 000 r /min, 1 min)倒去上清液,沉淀用等体积PBS洗涤1次,用等体积PBS悬浮,此即菌液原液。稀释:(假定菌液浓度约为1 ×106CFU/mL) 用PBS将菌液做10倍递增稀释。分别吸取各稀释度的菌液50 μL涂布于固体LB平板,37 ℃倒置培养过夜,每个梯度做3个重复,同时作空白对照。次日选取菌落数在30–300范围内的稀释度作平板计数并取其平均值[21]。
1.2.5 ATP发光法特异定量检测金黄色葡菌球菌
按照Profile-1 3560 (10X) ATP微生物快速检测系统标准操作进行:分别取50 μL待测菌液加入到专用的过滤比色杯中,比色杯下铺一层滤纸;滴加4滴SRA试剂 (非细菌细胞释放液),
用压力器对准比色杯顶端,按下压力器把液体压出至滤纸,重复该步骤一次;将比色杯放入
3560 (10X) 微光度计的抽屉中,加入100 μL (约
4.5 μg) 稀释的重组溶葡球菌酶液,等待2 min,
使细菌充分被裂解;吸取50 μL已制备好的荧光酶溶液加入到比色杯中,吹打混匀3次,推回抽屉,记录仪器读数。每个浓度梯度的样品做3
组重复,计算平均值为最终结果[22-23]。
2 结果
2.1 基因合成和重组质粒pQE30-Lys转化结果鉴定
密码子优化设计合成序列如下,加粗部分为酶切位点:
GGATCCGCCGCCACCCACGAGCACAGCGCA CAGTGGCTGAACAACTACAAGAAAGGTTAT GGCTACGGCCCTTACCCGCTGGGCATCAATG GTGGCATGCACTACGGCGTGGACTTCTTCAT GAACATCGGCACCCCTGTGAAGGCCATCAG CAGCGGCAAAATCGTGGAGGCCGGCTGGAG CAATTACGGCGGTGGCAACCAGATCGGCCT GATCGAGAACGACGGCGTGCACCGCCAGTG GTACATGCACCTGAGCAAGTACAACGTGAA GGTGGGTGACTACGTGAAGGCCGGCCAGAT TATCGGCTGGAGTGGTAGCACCGGCTATAG CACCGCCCCTCACCTGCACTTCCAGCGCATG GTTAACAGCTTCAGCAACAGCACCGCCCAA GATCCGATGCCGTTCCTGAAGAGCGCCGGTT ATGGCAAGGCAGGCGGTACCGTTACCCCGA CCCCGAACACAGGCTGGAAGACCAACAAGT ACGGCACCCTGTATAAGAGCGAGAGTGCCA GCTTCACCCCGAACACCGACATCATTACCCG CACAACCGGTCCGTTCCGTAGCATGCCTCAG AGCGGCGTGCTGAAGGCAGGCCAGACCATC CACTACGACGAGGTGATGAAGCAGGACGGC CATGTGTGGGTTGGCTATACCGGCAATAGCG GCCAACGCATCTACCTGCCGGTGCGCACCTG GAATAAGAGCACCAACACCCTGGGCGTGCT GTGGGGCACAATCAAATAAAAGCTT
重组质粒pQE30-Lys经双酶切后,可见大小约753 bp的目的片段,经测序证实结果正确,表明原核表达载体构建成功 (图1)。
2.2 重组溶葡球菌酶的诱导表达与纯化
重组蛋白经SDS-PAGE电泳鉴定,可见一相对分子质量约为27 kDa的蛋白条带,大小与理论预测的蛋白大小相一致 (图2)。经镍柱纯化后蛋白条带比较单一,得到较纯的蛋白 (图3),测定纯化后的蛋白浓度约为1 mg/mL。
2.3 重组溶葡球菌酶活性检测

图1 酶切鉴定重组质粒pQE30-LysFig. 1 Recombinant plasmid pQE30-Lys digested with restriction endonuclease BamH I and Hind III. 1: recombinant plasmid pQE30-Lys; 2: recombinant plasmid pQE30-Lys digested with restriction endonuclease BamH I and Hind III; M: 1 kb ladder DNA marker.

图2 SDS-PAGE分析重组溶葡球菌酶的表达Fig. 2 SDS-PAGE analysis of expression of recombinant lysostaphin. M: broad molecular weight protein marker; 1, 2: negative control pQE30/M15; 3: pQE30-Lys/M15.
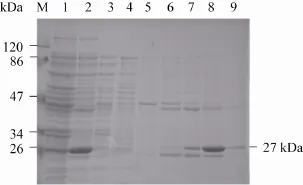
图3 SDS-PAGE分析重组溶葡球菌酶的纯化Fig. 3 SDS-PAGE analysis of purification results of the recombinant lysostaphin. M: low molecular weight protein marker; 1: the ultrasonic supernatant of pQE30-Lys/M15 with IPTG induction; 2–9: purified recombinant lysostaphin.
点滴法验证重组溶葡球菌酶活性,可在金黄色葡萄球菌 (金葡菌ATCC 25923和173株临床分离金葡菌) 平板上滴有重组溶葡球菌酶的区域观察到透亮裂解斑如图4箭头所示,其他7株受试菌没有裂解斑 (此处仅显示出金葡菌ATCC 25923和大肠杆菌E. coli点滴法验证结果,其他不一一列出) (图4)。

图4 重组溶葡球菌酶活性验证Fig. 4 Spot test on a LB plate with purified recombinant lysostaphin. (A) Recombinant lysostaphin. (B) Negative control PBS.
2.4 ATP测定法与平板计数法
2.4.1 ATP测定法与平板计数法试验结果
选取稀释倍数为10–4细菌溶液的平板计数结果为依据,3组数据分别为:204、189和165,求得平均值是186,并由此计算其他稀释度细菌溶液的细菌数,见表1;利用ATP生物发光法测定出相应稀释度的细菌溶液的发光值,每个样品重复3次测定,记录数据,计算其平均值,结果见表1。
2.4.2 ATP测定法与平板计数法相关性
根据表1,采用10–4及以上稀释度各组的数据,以平板计数平均值的对数值为X轴,以光值平均值的对数值为Y轴,做X、Y散点图描绘关系曲线,如图5,线性回归方程为: y=0.961 3x–0.588 1,R2=0.995 7。由表1和图5可知,当细菌数在186 CFU以上时,生物发光值与平板计数呈显著相关。
2.5 基于ATP生物发光法和重组溶葡球菌酶特异性检测金黄色葡萄球菌
将金黄色葡萄球菌与其他7株受试菌培养到对数期,按一定比例稀释,使菌液浓度一致,然后利用重组溶葡球菌酶结合ATP生物发光法进行细菌检测,结果如图6所示,从图6可以看出同等浓度下的细菌,金黄色葡萄球菌的相对发光值与其他菌株存在明显差异,重组溶葡球菌酶对于金黄色葡萄球菌显示了强大的杀菌能力;同时点滴法的结果 (结果2.3) 表明,重组溶葡球菌酶对除金黄色葡萄球菌之外的其他7株受试菌株均无杀菌活性,均不能观察到透亮的裂解斑,进一步说明了结合重组溶葡球菌酶的ATP发光法检测金黄色葡萄球菌具有特异性。

表1 ATP测定法与平板计数法数据Table 1 Data by ATP test method and plate count method

图5 平板计数与光值对应关系标准曲线Fig. 5 Standard curve of plate count and luminescence value.

图6 重组溶葡球菌酶裂解细菌后的相对发光值Fig. 6 Relative luminescence value after recombinant lysostaphin lysis. 1: Staphylococcus aureus ATCC 25923; 2: 108 E. coli; 3: 095 Salmonella; 4: 012 Stenotrophomonas maltophilia; 5: 002 E. faecalis; 6: 071 A. baumanii; 7: 084 E. coli; 8: 003 Klebsiella pneumoniae.
3 讨论
近年来,随着生物技术的快速发展,利用ATP生物发光法对细菌进行定量检测的方法已应用于食品工业、临床检测等众多领域[18,24-25]。目前以ATP生物发光法定量检测细菌的研究往往采用细菌裂解液来裂解细菌从而释放ATP,大多不具有特异性和专一性。重组溶葡球菌酶能够高效特异地裂解葡萄球菌尤其是金黄色葡萄球菌。因此,本实验室通过重新设计溶葡球菌酶的蛋白结构,保留其杀菌活性区,使溶葡萄球菌酶的生产不用从其生物学活性极低的蛋白前体开始,而是直接表达杀菌活性强的成熟溶葡萄球菌酶[26],同时对编码的基因序列进行密码子优化,在大肠杆菌原核表达系统中实现了高效可溶性表达,通过镍柱纯化获得较纯的酶液。重组溶葡球菌酶对于金葡菌标准株和临床分离株杀菌活性的研究,证明了重组溶葡球菌酶保持了强大的杀菌活性。因此本研究利用重组溶葡球菌酶替代原始检测系统中的细菌裂解液,结合ATP生物发光技术,建立了快速检测金黄色葡萄球菌的方法。该检测方法的检测下限为186 CFU,可以满足一般检测的需求;当样品所含的细菌数量低于186 CFU时,可以采用简便的浓缩富集技术或者多次加样的方法,使浓缩后的样品菌落总数达到有效检测范围以内,检测后再通过换算得到原样品的细菌数量。
同时,该方法具备传统ATP发光法检测技术灵敏快速的优点,从待测样品的制备到细菌ATP的提取,直到ATP发光强度的检测,整个过程可在1 h内完成,具有快速、简便的特点,可以满足一般快速检测的要求,在裂解细菌方面又具有特异性,在现场或临床定性定量检测金黄色葡萄球菌方面具有良好的前景和实用价值。REFERENCES
[1] Mann NH. The potential of phages to prevent MRSA infections. Res Microbiol, 2008, 159(5): 400–405.
[2] Watkins RR, David MZ, Salata RA. Current concepts on the virulence mechanisms of meticillin-resistant Staphylococcus aureus. J Med Microbiol, 2012, 61(9): 1179–1193.
[3] Klem J, Domotor D, Schneider G, et al. Bacteriophage therapy against staphylococci. Acta Microbiol Immunol Hungar, 2013, 60(4): 411–422.
[4] Rajan S. Skin and soft-tissue infections: classifying and treating a spectrum. Cleveland Clin J Med, 2012, 79(1): 57–66.
[5] Pletz MW, Burkhardt O, Welte T. Nosocomial methicillin-resistant Staphylococcus aureus (MRSA) pneumonia: linezolid or vancomycin?-comparison of pharmacology and clinical efficacy. Eur J Med Res, 2010, 15(12): 507.
[6] Vanderhaeghen W, Hermans K, Haesebrouck F, et al. Methicillin-resistant Staphylococcus aureus (MRSA) in food production animals. Epid Infect, 2010, 138(5): 606–625.
[7] Yoon H, Yun J, Lim JA, et al. Characterization and genomic analysis of two Staphylococcus aureus bacteriophages isolated from poultry/livestock farms. J Gener Virol, 2013, 94(11): 2569–2576.
[8] DeLeo FR, Chambers HF. Reemergence of antibiotic-resistant Staphylococcus aureus in the genomics era. J Clin Investig, 2009, 119(9): 2464.
[9] Dulon M, Haamann F, Peters C, et al. MRSA prevalence in European healthcare settings: a review. BMC Infect Dis, 2011, 11(1): 138.
[10] McDougal LK, Steward CD, Killgore GE, et al. Pulsed-field gel electrophoresis typing of oxacillin-resistant Staphylococcus aureus isolates from the United States: establishing a national database. J Clin Microbiol, 2003, 41(11): 5113–5120.
[11] Tenover FC, Biddle JW, Lancaster MV. Increasing resistance to vancomycin and other glycopeptides in Staphylococcus aureus. Emerg Infect Dis, 2001, 7(2): 327.
[12] Barber M. Methicillin-resistant staphylococci. J Clin Pathol, 1961, 14(4): 385.
[13] Recsei PA, Gruss AD, Novick RP. Cloning, sequence, and expression of the lysostaphin gene from Staphylococcus simulans. Proc Natl Acad Sci USA, 1987, 84(5): 1127–1131.
[14] Walsh S, Shah A, Mond J. Improved pharmacokinetics and reduced antibody reactivity of lysostaphin conjugated to polyethylene glycol. Antimicrob Agents Chemother, 2003, 47(2): 554–558.
[15] Baba T, Schneewind O. Target cell specificity of a bacteriocin molecule: a C-terminal signal directs lysostaphin to the cell wall of Staphylococcus aureus. EMBO J, 1996, 15(18): 4789.
[16] Hawronskyj JM, Holah J. ATP: a universal hygiene monitor. Trends Food Sci Technol, 1997, 8(3): 79–84.
[17] Champiat D, Matas N, Monfort B, et al. Applications of biochemiluminescence to HACCP. Luminescence, 2001, 16(2): 193–198.
[18] Tang QQ, Ye ZZ, Wang JP, et al. Application of ATP bioluminescence in microbial detection. Food Sci, 2008, 29(6): 460–465 (in Chinese).
唐倩倩, 叶尊忠, 王剑平, 等. ATP生物发光法在微生物检验中的应用. 食品科学, 2008, 29(6): 460–465.
[19] Mcelroy WD. Crystalline firefly luciferase: LH2+ ATPLH2-AMP +PPLH2-AMP + O2: L-AMP + light + H2O. Methods Enzymol, 1963, 6: 445–448.
[20] Hao QL, Lü B, Zhou YK, et al. Rapid detection of ATP concentration in cells using bioluminescence method. Acta Med Univer Sci Technol Huazhong, 2005, 34(1): 61–64 (in Chinese).
郝巧玲, 吕斌, 周宜开, 等. 生物发光法快速检测细胞内三磷酸腺苷. 华中科技大学学报: 医学版, 2005, 34(1): 61–64.
[21] Ma N, Zhao H, Zhang X, et al. Rapid determination of colony in food by ATP bioluminescence method. Chin J Public Health Eng, 2008, 7(5): 296–297 (in Chinese).
马妮, 赵虹, 张旭, 等. ATP发光技术快速检测食品中菌落总数. 中国卫生工程学, 2008, 7(5): 296–297.
[22] Stopa PJ, Tieman D, Coon PA, et al. Detection of biological aerosols by luminescence techniques. Field Anal Chem Technol, 1999, 3(4/5): 283–290. [23] Lim DV, Simpson JM, Kearns EA, et al. Current and developing technologies for monitoring agents of bioterrorism and biowarfare. Clin Microbiol Rev, 2005, 18(4): 583–607.
[24] Li LX, Wu JE, Chang C, et al. The establish of ATP bioluminescent detection technique and the feasibility analysis of its application. Food Sci Technol, 2012, 37(1): 275–279 (in Chinese).
李利霞, 伍金娥, 常超, 等. ATP生物发光检测技术的建立及应用可行性分析. 食品科技, 2012, 37(1): 275–279.
[25] de Boer E, Beumer RR. Methodology for detection and typing of foodborne microorganisms. Int J Food Microbiol, 1999, 50(1): 119–130.
[26] Thumm G, Götz F. Studies on prolysostaphin processing and characterization of the lysostaphin immunity factor (Lif) of Staphylococcus simulans biovar staphylolyticus. Mol Microbiol, 1997, 23(6): 1251–1265.
(本文责编 郝丽芳)
Quantitative specific detection of Staphylococcus aureus based on recombinant lysostaphin and ATP bioluminescence
Yuyuan Li1,2, Zhiqiang Mi2, Xiaoping An2, Yusen Zhou1,2, and Yigang Tong2
1 Guangxi Medical University, Nanning 530021, Guangxi, China
2 State Key Laboratory of Pathogen and Biosecurity, Institute of Microbiology and Epidemiology, Academy of Military Medical Sciences, Beijing 100071, China
Quantitative specific detection of Staphylococcus aureus is based on recombinant lysostaphin and ATP bioluminescence. To produce recombinant lysostaphin, the lysostaphin gene was chemically synthesized and inserted it into prokaryotic expression vector pQE30, and the resulting expression plasmid pQE30-Lys was transformed into E. coli M15 for expressing lysostaphin with IPTG induction. The recombinant protein was purified by Ni2+-NTA affinity chromatography. Staphylococcus aureus was detected by the recombinant lysostaphin with ATP bioluminescence, and plate count method. The results of the two methods were compared. The recombinant lysostaphin was successfully expressed, and a method of quantitative specific detection of S. aureus has been established, which showed a significant linear correlation with the colony counting. The detection method developed has good perspective to quantify S. aureus.
Staphylococcus aureus, recombinant lysostaphin, ATP bioluminescence, specific and quantitative detection
November 12, 2013; Accepted: December 17, 2013
Yusen Zhou. E-mail: yszhou@nic.bmi.ac.cn
李玉元, 米志强, 安小平, 等. 基于重组溶葡球菌酶和ATP生物发光技术特异定量检测金黄色葡萄球菌. 生物工程学报, 2014, 30(8): 1283–1290.
Li YY, Mi ZQ, An XP, et al. Quantitative specific detection of Staphylococcus aureus based on recombinant lysostaphin andATP bioluminescence. Chin J Biotech, 2014, 30(8): 1283–1290.
Supported by: National Natural Science Foundation of China (No. 81072350), China Mega-Project on Major Drug Development (No. 2011ZX09401-023), China Mega-Project on Infectious Disease Prevention (No. 2011ZX10004-001), State Key Laboratory of Pathogen and Biosecurity Program (No. SKLPBS1113).
Yigang Tong. Tel: +86-10-63869835; E-mail: tong.yigang@gmail.com
国家自然科学基金 (No. 81072350),“重大新药创制”科技重大专项“十二五”实施计划 (No. 2011ZX09401-023),“艾滋病和病毒性肝炎等重大传染病防治”科技重大专项“十二五”实施计划 (No. 2011ZX10004-001),病原微生物生物安全国家重点实验室开放课题 (No. SKLPBS1113) 资助。
时间:2014-03-10 网络出版地址:http://www.cnki.net/kcms/doi/10.13345/j.cjb.130578.html
