代谢工程改造酿酒酵母生产β-胡萝卜素
2014-06-24王贝贝施明雨王冬许骄阳刘怡杨洪江戴住波张学礼
王贝贝,施明雨,王冬,许骄阳,刘怡,杨洪江,戴住波,张学礼
1 天津科技大学生物工程学院,天津 300457
2 中国科学院天津工业生物技术研究所,天津 300308
3 中国科学院系统微生物工程重点实验室,天津 300308
代谢工程改造酿酒酵母生产β-胡萝卜素
王贝贝1,2,3,施明雨1,2,3,王冬1,2,3,许骄阳2,3,刘怡2,3,杨洪江1,戴住波2,3,张学礼2,3
1 天津科技大学生物工程学院,天津 300457
2 中国科学院天津工业生物技术研究所,天津 300308
3 中国科学院系统微生物工程重点实验室,天津 300308
β-胡萝卜素在食品、药品和化妆品领域有广泛用途。为获得生产β-胡萝卜素的微生物细胞工厂,本研究首先在酿酒酵母BY4742中过表达甲羟戊酸 (MVA) 途径的限速酶3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR) 基因及二萜化合物合成的关键酶牻牛儿基牻牛儿基焦磷酸合酶 (GGPS) 基因,牻牻来提高牛儿基牛儿基焦磷酸 (GGPP) 的供给。在酿酒酵母底盘菌BY4742-T2的基础上整合来源于成团泛菌和红法夫酵母的β-胡萝卜素合成基因,比较酿酒酵母工程菌生产β-胡萝卜素的差别。结果表明提高酿酒酵母中HMGR和GGPS酶基因的表达能将工程菌中β-胡萝卜素的产量提高26.0倍。另外,来源于真核生物红法夫酵母的合成基因相比成团泛菌,更有利于酿酒酵母生产β-胡萝卜素。最终获得的酿酒酵母工程菌BW02能生产1.56 mg/g细胞干重的β-胡萝卜素,为进一步获得高产β-胡萝卜素细胞工厂提供基础。
β-胡萝卜素,成团泛菌,红法夫酵母,酿酒酵母
类胡萝卜素 (Carotenoids) 是一类重要的天然色素,主要包括β-胡萝卜素 (β-carotene)、番茄红素(Lycopene)、玉米黄素(Zeaxanthin)、角黄素(Canthaxanthin)和虾青素 (Astaxanthin) 等[1]。其中β-胡萝卜素是一种抗氧化剂,在人体内能转化为维生素A,活性显著,在药品、保健品、化妆品和食品上已有广泛的应用[2];在红法夫酵母Xanthophyllomyces dendrorhous或雨生红球藻Haematococcus pluvialis等生物体中被作为中间体进一步生物催化为抗氧化活性更强的虾青素[1,3-4]。天然来源的β-胡萝卜素优于化学合成,更能被市场接受,目前市场上销售的β-胡萝卜素90%是通过化学合成法获得,但随着国内外对天然β-胡萝卜素市场需求的增加,采用微生物发酵法生产具有广阔的应用前景[5]。自然界很多微生物能合成β-胡萝卜素,例如红法夫酵母X. dendrorhous、三孢布拉氏霉菌Blakeslea trispora、噬夏孢欧文氏菌Erwinia uredovora和成团泛菌Pantoea agglomerans等,但由于自然产量低,很难工业化。
基于这类化合物的重要性,目前类胡萝卜素生物合成途径已经基本解析清楚:如来源于真菌红法夫酵母XdCrtBY、XdCrtI、XdCrtR 和XdCrtS基因组成的合成途径能将其体内二萜的基本前体牻牛儿基牻牛儿基焦磷酸 (GGPP)依次催化获得番茄红素、β-胡萝卜素和虾青素等类胡萝卜素[1,3];细菌来源的成团泛菌中由PagCrtB、PagCrtI和PagCrtY基因组成的合成途径能生产番茄红素和β-胡萝卜素等类胡萝卜素[6](图1)。

图1 酿酒酵母中MVA途径及引入的β-胡萝卜素合成途径Fig. 1 MVA pathway for isoprenoid biosynthesis in yeast and heterologous β-carotene synthetic pathway. Abbreviation: HMG-CoA, 3-hydroxy-3-methylglutaryl coenzyme A; IPP, Isopentenyl diphosphate; DMAPP, Dimethylallyl diphosphate; GGPP, geranylgeranyl diphosphate.
酿酒酵母为安全的模式微生物,已成功被遗传改造为能生产青蒿酸[7]、丹参酮类[8-9]、白藜芦醇[10]和人参皂苷[11]等多种天然产物的工程菌株。酿酒酵母中存在能生物合成萜类的甲羟戊酸 (MVA) 途径,其能利用乙醇、半乳糖和葡萄糖等简单碳源合成萜类基本单元异戊烯焦磷酸(IPP)和二甲基烯丙基焦磷酸 (DMAPP),这两个萜类单元能被法呢烯焦磷酸合酶 (FPS,ERG20基因编码) 和牻牛儿基牻牛儿基焦磷酸合酶 (GGPS,BTS1基因编码) 依次催化得到二萜类的通用前体牻牛儿基牻牛儿基焦磷酸(GGPP);GGPP能继续被CrtB、CrtI和CrtY等胡萝卜素基因编码的酶催化形成β-胡萝卜素(图1)。Yamano等利用噬夏孢欧文氏菌的β-胡萝卜素合成途径基因,在酿酒酵母中构建出能生产0.1 mg/g细胞干重的工程菌[12];Verwaal等利用红法夫酵母的β-胡萝卜素合成途径基因,在酿酒酵母中构建出生产5.9 mg/g干重细胞的工程菌[13];Li等在酿酒酵母中通过对红法夫酵母β-胡萝卜素合成途径的XdCrtBY和XdCrtI基因中的相关密码子进行优化,结合过量表达MVA途径中的3-羟基-3-甲基戊二酰辅酶A还原酶 (HMGR) 基因的策略,获得产量为0.39 mg/g干重细胞的工程菌[2]。
我们前期在大肠杆菌中引入成团泛菌的β-胡萝卜素合成途径,再通过对大肠杆菌的MEP、β-胡萝卜素合成、三羧酸循环、磷酸戊糖途径和ATP合成5个功能模块的组合调控,将β-胡萝卜素的生产能力提高了74倍。最终β-胡萝卜素产量达2.1 g/L,含量达60 mg/g干重细胞[6]。在本研究中,我们首先构建了一个高产GGPP的底盘酿酒酵母细胞,在此基础上,比较了来源于原核生物成团泛菌和来源于真核生物红法夫酵母的两条β-胡萝卜素合成途径,发现红法夫酵母的基因更适合酿酒酵母生产β-胡萝卜素,为构建高产β-胡萝卜素的酿酒酵母工程菌提供了基础。
1 材料与方法
1.1 材料
1.1.1 工具酶与试剂
PrimeSTAR HS DNA聚合酶和RNA反转录试剂盒 (PrimeScript 1st Strand cDNA SynthesisKit) 购自大连宝生物工程公司;限制性内切酶SexAⅠ、PacⅠ和AscⅠ购自 Fermentas公司;快连酶购自NEB公司;质粒小量快速提取试剂盒购自美国 Axygen公司;酵母DNA提取试剂盒购自北京康为世纪生物科技有限公司;DNA回收试剂盒购自美国Biomiga公司;氨苄青霉素购自上海生工生物工程有限公司;酵母选择培养基 (四缺,Ura-Trp-Leu-His) 购自北京泛基诺(功能基因组)科技有限公司;番茄红素标品、β-胡萝卜素标品和5-FOA均购自美国Sigma-Aldrich 公司;其他试剂均为分析纯。
1.1.2 仪器与设备
PCR扩增仪,Eppendorf Mastercycler gradient;全自动凝胶成像系统,Bio-Rad Molecular Imager Gel DOC XR;台式高速离心机,Eppendorf 5415D;紫外可见分光光度计,Shimadzu UV-2550;高速冷冻离心机,Thermo Sorvall Evolution RC;高效液相色谱,Agilent Technologies Series 1260。
1.1.3 菌株、引物和质粒
本次研究所用菌株、引物和质粒已经分别在表1–3中列出。
1.1.4 培养基
LB 培养基:1% 蛋白胨,0.5% 酵母膏,1%氯化钠,100 mg/L氨苄青霉素;SM-URA筛选培养基:0.8%酵母选择培养基 (四缺,Ura-Trp-Leu-His),2%葡萄糖,0.01% His,0.01% Trp,0.01% Leu;SM-HIS筛选培养基:0.8% 酵母选择培养基 (四缺,Ura-Trp-Leu-His),2% 葡萄糖,0.01% Trp,0.01% Leu,0.01% Ura;YPD培养基:2% 蛋白胨,1% 酵母膏,2% 葡萄糖;SM-5FOA筛选培养基:YPD培养基,0.1% 5-FOA。上述液体培养基加1.5%的琼脂配成固体培养基。

表1 本研究所用的菌株Table 1 Strains used in this work

表2 本研究所用到的引物Table 2 Primers used in this work

表3 本研究所用的质粒Table 3 Plasmids used in this study
1.2 方法
1.2.1 功能基因克隆与分析
于YPD液体培养基中,20 ℃振荡培养红法夫酵母X. dendrorhous,10 000×g离心收集菌体,液氮研磨后,用Trizol法提取总RNA和用RNA反转录试剂盒 (PrimeScript 1st Strand cDNA Synthesis Kit) 获得红法夫酵母cDNA模板[15],分别用引物组合XdCrtI-ASC/SexA-XdCrtI,SexA-XdCrtYB/XdCrtYB-ASC-2扩增获得XdCrtI和XdCrtBY基因。
于LB液体培养基中,37 ℃振荡培养成团泛菌P. agglomerans,10 000×g离心收集菌体,用DNA提取试剂盒提取扩增模板基因组,分别用引物组合SexA-CrtBI/Asc1-CrtB、SexA-CrtI/ Asc1-CrtB/I和Pac1-PagCrtY/PagCrtY-ASC1扩增获得pagCrtB、pagCrtI和pagCrtY基因。
将获得的红法夫酵母和成团泛菌β-胡萝卜素合成途径基因序列导入CAIcal在线服务器中(http://genomes.urv.es/CAIcal) 计算密码子适应指数(Codon Adaptation Index, CAI)[16]。
1.2.2 表达功能模块构建
以质粒pLHis-ERG20/BTS1-SaGGPS为模板,SexA-SaGGPS/Asc1-SaGGPS为引物扩增到SaGGPS基因片段。用SexAⅠ和AscⅠ分别双酶切pδ-tHMG1质粒,SaGGPS基因片段,及方法“1.2.1”中获得的pagCrtB和XdCrtBY基因片段,割胶回收目的片段,分别酶连得到重组载体pδ-SaGGPS、pδ-pagCrtB和pδ-XdCrtBY (表3)。用SexAⅠ和AscⅠ分别双酶切pM3-SynPgPPDS质粒和方法“1.2.1”中获得的pagCrtI和XdCrtI基因片段,割胶回收目的片段,分别酶连得到重组载体pM3-pagCrtI和pM3-XdCrtI。用PacⅠ和AscⅠ分别双酶切pM11-ERG1质粒和方法“1.2.1”中获得的pagCrtY基因片段,割胶回收目的片段,酶连得到重组载体pM11-pagCrtY。以上质粒均由华大基因测序验证。
1.2.3 二萜底盘菌构建
BY4742 感受态细胞制备和转化用醋酸锂方法[11]。pδ-tHMG1和pδ-SaGGPS分别用XhoⅠ酶切和胶回收。酶切后的δ-tHMG1基因片段,转入BY4742 感受态细胞中,用SM-URA固体筛选培养基培养48 h,阳性克隆再经过SM-5FOA固体筛选培养基筛选和PCR验证 (引物Sac11-pGK1/Asc1-HMG1) 获得工程菌BY4742-T;进一步,酶切后的δ-SaGGPS基因片段转入BY4742-T感受态细胞中,用SM-URA固体筛选培养基培养48 h,阳性克隆再经过SM-5FOA固体筛选培养基筛选和PCR验证 (引物Sac11-pGK1/Asc1-SaGGPS) 获得工程菌BY4742-T2。
1.2.4 产β-胡萝卜素工程菌构建
β-胡萝卜素工程菌的构建使用多片段同源重组方法[11]。首先,按照表4中DNA模板和引物搭配方案,用PrimeSTAR HS DNA高保真酶PCR分别扩增获得用于同源重组的基因模块。BY4742或BY4742-T2感受态细胞用醋酸锂方法制备,按照表4中的 Group A和图2A所示进行搭配转化后,在SM-HIS筛选培养基筛选分别获得工程菌BW01和BW03;按照表4中的Group B和图2B所示进行搭配转化后,在SM-HIS筛选培养基筛选分别获得工程菌BW02、BW04和BW-CK,阳性克隆根据菌斑的颜色来直接鉴定 (产胡萝卜素的菌显黄色)。

表4 多片段酵母同源重组信息表Table 4 Information of the DNA assembler

图2 多片段同源重组法在酿酒酵母Trp1基因位点整合β-胡萝卜素生物合成途径基因的示意图 (A: 整合PagCrtB、PagCrtY和PagCrtI (或XdCrtI) 基因;B: 整合XdCrtBY和XdCrtI (或PagCrtI) 基因)Fig. 2 Strains construction using the DNA assembler method. (A) The PagCrtB, PagCrtY and PagCrtI (or XdCrtI) genes were integrated into Trp1 site of BY4742-T2. (B) The XdCrtBY, XdCrtI (or PagCrtI) genes were integrated into Trp1 site of BY4742-T2.
1.2.5 摇瓶发酵方法
挑取平板活化的单克隆菌株于相应的液体筛选培养基中制备发酵种子液 (30 ℃,250 r/min,16 h);离心收集菌体,转移至含10 mL YPD液体培养基100 mL三角瓶中,调OD至0.1,30 ℃、250 r/min振荡培养4 d,检测OD600及产物含量。
1.2.6 β-胡萝卜素产量的检测方法
取2 mL培养的发酵液于12 000×g离心3 min,无菌水清洗后,加适量玻璃珠 (0.5 mm)和1 mL提取液 (甲醇∶乙腈∶二氯甲烷= 21∶21∶8),振荡破碎5 min,冰水中超声30 min,10 000×g离心5 min,取上清液 (提取二次,合并上清液);上清液过0.22 μm有机膜后用高效液相色谱分析番茄红素和β-胡萝卜素的产量。检测条件:DAD 检测器,Waters Symmetry®C18色谱柱(250 mm×4.6 mm, 5 μm),流动相为甲醇∶乙腈∶二氯甲烷(21∶21∶8),流速1.0 mL/min,柱温30 ℃,检测波长450 nm;每个待测样品进行3个生物学重复试验;番茄红素和β-胡萝卜标准品用于定量分析。
2 结果与分析
2.1 生产二萜化合物的底盘酿酒酵母细胞的构建
菌株BY4742来源于酿酒酵母S288C标准菌株,其萜类生物合成途径中存在合成二萜的通用前体GGPP。野生型酿酒酵母细胞合成GGPP的能力很差[8]。已有实验表明,过表达酿酒酵母的tHMG1基因 (截去了酵母HMG1基因中编码N-端含反馈抑制区的相关序列) 和嗜酸热硫化叶菌SaGGPS基因能有效提高酿酒酵母合成GGPP和二萜化合物的能力[8]。为获得高产GGPP的底盘酿酒酵母细胞,通过同源重组法[11],携带强启动子PGK1的tHMG1基因和SaGGPS基因被整合到酿酒酵母BY4742的δDNA位点。阳性克隆经过特异引物验证后(图3),获得生产二萜化合物的底盘酿酒酵母细胞BY4742-T2。

图3 工程菌BY4742-T和BY4742-T2的PCR验证Fig. 3 PCR verification of strains BY4742-T and BY4742-T2. M: DNA marker; Lane 1 and 2 are PCR products amplified from control strain BY4742; Lane 3 and 4 are PCR products amplified from BY4742-T; Lane 5 and 6 are PCR products amplified from BY4742-T2. Primer set Sac11-pGK1/Asc1 -HMG1 was used to amplify tHMG1 gene (Lane 1, 3 and 5). Primer set Sac11-pGK1/Asc1-SaGGPS was used to amplify SaGGPS gene (Lane 2, 4 and 6).
2.2 底盘酿酒酵母细胞BY4742-T2中引入成团泛菌β-胡萝卜素合成途径
成团泛菌能合成β-胡萝卜素,实验室前期研究表明成团泛菌β-胡萝卜素合成途径的基因在大肠杆菌中能被很好地表达。利用成团泛菌的基因,在系统优化的大肠杆菌中β-胡萝卜素产量能达到2.1g/L[6]。在本研究中,通过多片段同源重组法[11,17],来源于成团泛菌的pagCrtB、pagCrtI和pagCrtY基因,和对应的PGK1、TEF1和TDH3强启动子,被整合到底盘酿酒酵母细胞BY4742-T2的Trp1位点,获得工程菌BW01。该菌发酵96 h,能生产0.04 mg/g的β-胡萝卜素和0.06 mg/g的番茄红素 (图4)。
2.3 底盘酿酒酵母细胞BY4742-T2中引入红法夫酵母的β-胡萝卜素合成途径
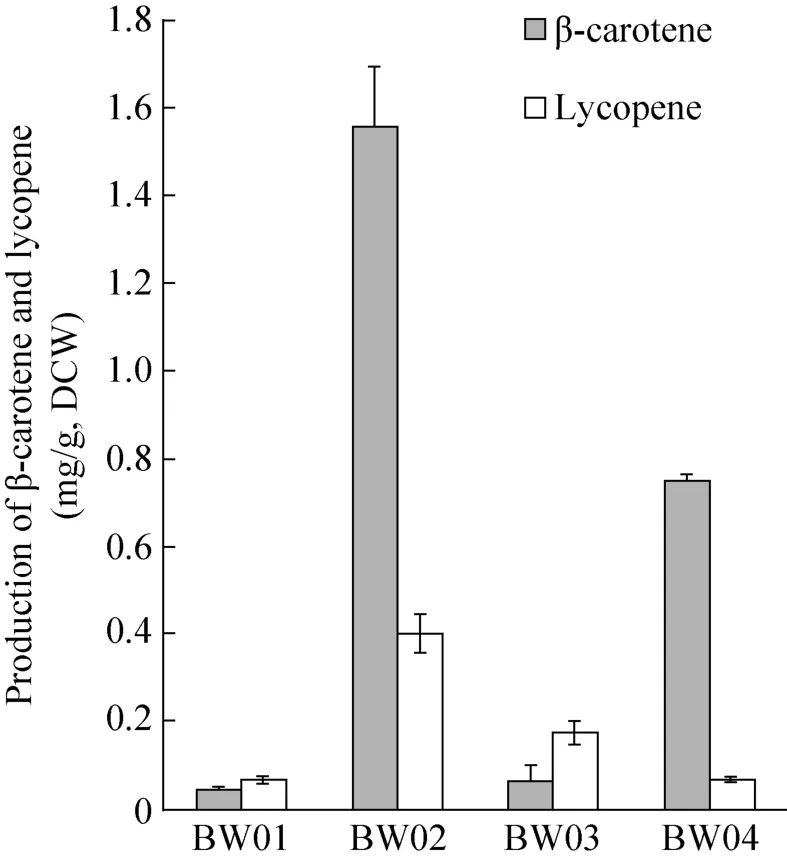
图4 酿酒酵母工程菌发酵生产β-胡萝卜素和番茄红素Fig. 4 Production of β-carotene and lycopene by metabolically engineered S. cerevisiae strains.
红法夫酵母能合成强抗氧化活性物质虾青素,同时中间产物β-胡萝卜素由XdCrtI 和双功能基因XdCrtBY催化获得。在本研究中,通过多片段同源重组法,来源于红法夫酵母的XdCrtBY和XdCrtI 基因,和对应的PGK1和TEF1强启动子,被整合到底盘酿酒酵母细胞BY4742-T2的Trp1位点,获得工程菌BW02。该菌发酵96 h,能生产1.56 mg/g的β-胡萝卜素和0.4 mg/g的番茄红素,其含量分别是BW01菌的39.0倍和6.7倍 (图4)。
2.4 过表达tHMG1基因和SaGGPS基因的作用
为了进一步验证过表达tHMG1基因和SaGGPS基因对生产类胡萝卜素化合物的影响,通过多片段同源重组法,来源于红法夫酵母的XdCrtBY和XdCrtI 基因和对应的PGK1和TEF1强启动子,被整合到酵母细胞BY4742的Trp1位点,获得工程菌BW-CK。该菌发酵96 h,能生产0.06 mg/g的β-胡萝卜素和0.01 mg/g的番茄红素。过表达tHMG1基因和SaGGPS基因后,β-胡萝卜素和番茄红素的含量分别提高了26.0和40.0倍,总类胡萝卜素化合物含量提高了28.0倍,进一步证明这两个基因的过表达能提高酿酒酵母细胞中GGPP的供给。
为了进一步研究红法夫酵母的XdCrtBY和XdCrtI基因是否比对应的成团泛菌的基因更有利于β-胡萝卜素合成,我们对红法夫酵母和成团泛菌β-胡萝卜素合成途径的基因进行了组合。红法夫酵母XdCrtI基因和成团泛菌pagCrtB与pagCrtY基因组合后,获得工程菌BW03。其β-胡萝卜素和番茄红素的含量分别为0.06 mg/g和0.17 mg/g。
红法夫酵母的双功能基因XdCrtBY和成团泛菌pagCrtI基因组合后,获得工程菌BW04。其β-胡萝卜素和番茄红素的含量分别为0.75 mg/g和0.07 mg/g。
相比全部使用成团泛菌基因的工程菌BW01、BW03和BW04中β-胡萝卜素和番茄红素的含量有不同程度提高,但均低于全部使用红法夫酵母基因的工程菌BW02的产量 (图4)。这表明红法夫酵母的XdCrtBY和XdCrtI基因都比对应的成团泛菌的基因更有利于酿酒酵母中β-胡萝卜素的合成。
2.6 红法夫酵母和成团泛菌β-胡萝卜素合成途径基因的密码子适应指数(CAI)分析
密码子适应指数(Codon adaption index. CAI)能评估某基因的密码子与宿主细胞中高表达基因集所用密码子的接近程度 (0–1.0,值越接近1.0程度越高),它一般用来预测基因的表达水平[16,18-19]。根据CAIcal服务器中提供的模式物种酿酒酵母和大肠杆菌的密码子使用参考数据库[16,20],分别计算红法夫酵母XdCrtBY和XdCrtI基因,及成团泛菌pagCrtB、pagCrtI和pagCrtY基因的密码子适应指数。结果表明在真核宿主酿酒酵母中红法夫酵母来源基因的CAI值 (分别为0.68和0.69) 均高于成团泛菌来源基因的CAI值 (分别为0.62、0.63和0.61);然而,在原核生物大肠杆菌中成团泛菌来源基因的CAI值 (分别为0.82、0.82和0.81) 均高于红法夫酵母来源基因的CAI值 (分别为0.68和0.70) (表5)。

表5 密码子适应指数分析Table 5 Analysis of Codon Adaptation Index
3 讨论
萜类化合物在自然界广泛存在,目前发现的萜类就超过5万多种[21],其中大部分是药用植物中的活性成分。由4个IPP单元组成的GGPP能在各种二萜环合酶的作用下,生产多样的二萜类化合物。功能基因组分析结合工程菌构建生产目标产品已经被广泛用于天然产物的生物合成途径解析和产物合成,如次丹参酮二烯[8-9]、齐墩果酸[22-23]和原人参二醇[11,24]等。HMGR是酵母MVA途径中的第一个关键酶,提高其编码基因HMG1的表达水平能显著提高整个萜类的生物合成通量[8-9,11,15,25]。编码GGPS酶的BTS1基因是酵母合成二萜类产物的另一关键酶,在工程菌中一般过表达BTS1基因能提高二萜合成分支的代谢通量[9,13]。本研究通过对tHMG1基因和SaGGPS基因的过表达调控,构建了底盘酿酒酵母细胞BY4742-T2。其能显著提高胞内GGPP的供给,不仅可以作为构建高产二萜化合物和类胡萝卜素化合物的出发菌,而且能作为底盘细胞,用于解析新二萜化合物的生物合成途径。
式中:Ci表示每组气体的第i次测量浓度值,C表示每组气体测量浓度值的算数平均值,n表示每组气体的测量次数。
在高产GGPP的底盘酿酒酵母细胞中引入红法夫酵母β-胡萝卜素合成途径后,β-胡萝卜素和番茄红素的含量比引入成团泛菌β-胡萝卜素合成途径的要高39.0倍和6.7倍,表明红法夫酵母β-胡萝卜素合成途径在酿酒酵母中的活性更高。然而,在大肠杆菌中引入成团泛菌β-胡萝卜素合成途径能获得很高的β-胡萝卜素的产量 (60 mg/g)[6],这种差异可能是由于来源于原核生物的基因在真核生物中存在密码子使用的偏好性问题,使其不能很好地表达[18-19]。对各基因的密码子适应指数 (CAI值) 进一步分析发现,成团泛菌β-胡萝卜素合成途径基因在真核生物酿酒酵母中的CAI值 (平均值0.62)均低于红法夫酵母来源基因(平均值0.69),但其在原核生物大肠杆菌中有较高的CAI值,平均值为0.82,结果提示红法夫酵母来源基因可能更容易在酿酒酵母中表达,而成团泛菌来源基因更适于在大肠杆菌中表达[16]。另一方面,红法夫酵母的XdCrtBY是一个双功能酶,其能使上一步反应的底物更快地结合到第二个酶的催化位点,加快第二个反应的进行,从而在空间上更有利于两个催化反应的进行[9,26]。
与前人的研究结果比较,本研究获得的工程菌生产β-胡萝卜素能力低于Verwaal等在酿酒酵母CEN.PK中构建的工程菌[13]。可能原因是Verwaal等应用了不同遗传改造策略:如过表达红法夫酵母来源的CrtE基因和进一步增加了CrtI基因的拷贝数等[13];另外,不同的酿酒酵母细胞株系合成萜类的能力也存在区别,CEN.PK株系可能有较强的合成萜类化合物前体的能力[2,27]。
本研究构建的酿酒酵母工程菌为发酵生产β-胡萝卜素提供了良好的菌株基础。下一步拟采用密码子优化来提高成团泛菌β-胡萝卜素合成途径的基因在酿酒酵母中的表达强度。同时,还将在酿酒酵母中测试更多不同真核与原核生物的β-胡萝卜素合成途径,挖掘出更合适酿酒酵母的β-胡萝卜素合成基因。
REFERENCES
[1] Ukibe K, Hashida K, Yoshida N, et al. Metabolic engineering of Saccharomyces cerevisiae for astaxanthin production and oxidative stress tolerance. Appl Environ Microbiol, 2009, 75(22): 7205–7211.
[2] Li Q, Sun Z, Li J, et al. Enhancing beta-carotene production in Saccharomyces cerevisiae by metabolic engineering. FEMS Microbiol Lett, 2013, 345(2): 94–101.
[3] Lodato P, Alcaino J, Barahona S, et al. Alternative splicing of transcripts from crtI and crtYB genes of Xanthophyllomyces dendrorhous. Appl Environ Microbiol, 2003, 69(8): 4676–4682.
[4] Yoo JJ, Choi SP, Kim BW, et al. Optimal design of scalable photo-bioreactor for phototropic culturing of Haematococcus pluvialis. Bioprocess Biosyst Eng, 2012, 35(1/2): 309–315.
[5] Zhao J, Liu Y, Li QY, et al. Modulation of isoprenoid gene expression with multiple regulatory parts for improved beta-carotene production. Chin J Biotech, 2013, 29(1): 41–55 (in Chinese).
赵婧, 刘怡, 李清艳, 等. 多个调控元件调控萜类合成途径基因表达提高β-胡萝卜素的生产. 生物工程学报, 2013, 29(1): 41–55.
[6] Zhao J, Li Q, Sun T, et al. Engineering central metabolic modules of Escherichia coli for improving beta-carotene production. Metab Eng, 2013, 17: 42–50.
[7] Paddon CJ, Westfall PJ, Pitera DJ, et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature, 2013, 496(7446): 528–532.
[8] Dai Z, Liu Y, Huang L, et al. Production of miltiradiene by metabolically engineered Saccharomyces cerevisiae. Biotechnol Bioeng, 2012, 109(11): 2845–2853.
[9] Zhou YJ, Gao W, Rong Q, et al. Modular pathway engineering of diterpenoid synthases and the mevalonic acid pathway for miltiradiene production. J Am Chem Soc, 2012, 134(6): 3234–3241.
[10] Sydor T, Schaffer S, Boles E. Considerable increase in resveratrol production by recombinant industrial yeast strains with use of rich medium. Appl Environ Microbiol, 2010, 76(10): 3361–3363.
[11] Dai Z, Liu Y, Zhang X, et al. Metabolic engineering of Saccharomyces cerevisiae for production of ginsenosides. Metab Eng, 2013, 20: 146–156.
[12] Yamano S, Ishii T, Nakagawa M, et al. Metabolic engineering for production of beta-carotene and lycopene in Saccharomyces cerevisiae. Biosci Biotechnol Biochem, 1994, 58(6): 1112–1114.
[13] Verwaal R, Wang J, Meijnen JP, et al. High-level production of beta-carotene in Saccharomyces cerevisiae by successive transformation with carotenogenic genes from Xanthophyllomyces dendrorhous. Appl Environ Microbiol, 2007, 73(13): 4342–4350.
[14] Brachmann CB, Davies A, Cost GJ, et al. Designer deletion strains derived from Saccharomyces cerevisiae S288C: a useful set of strains and plasmids for PCR-mediated gene disruption and other applications. Yeast, 1998, 14(2): 115–132.
[15] Dai Z, Cui G, Zhou SF, et al. Cloning and characterization of a novel 3-hydroxy-3 -methylglutaryl coenzyme A reductase gene from Salvia miltiorrhiza involved in diterpenoid tanshinone accumulation. J Plant Physiol, 2011, 168(2): 148–157.
[16] Puigbo P, Bravo IG, Garcia-Vallve S. CAIcal: a combined set of tools to assess codon usage adaptation. Biol Direct, 2008, 3: 38.
[17] Shao Z, Zhao H. DNA assembler, an in vivo genetic method for rapid construction of biochemical pathways. Nucleic Acids Res, 2009, 37(2): e16.
[18] Quan J, Saaem I, Tang N, et al. Parallel on-chip gene synthesis and application to optimization of protein expression. Nat Biotechnol, 2011, 29(5): 449–452.
[19] Sharp PM, Li WH. The codon Adaptation Index-a measure of directional synonymous codon usage bias, and its potential applications. Nucleic Acids Res, 1987, 15(3): 1281–1295.
[20] Nakamura Y, Gojobori T, Ikemura T. Codon usage tabulated from international DNA sequence databases: status for the year 2000. Nucleic Acids Res, 2000, 28(1): 292.
[21] Chang MC, Keasling JD. Production of isoprenoid pharmaceuticals by engineered microbes. Nat Chem Biol, 2006, 2(12): 674–681.
[22] Dai Z, Wang B, Liu Y, et al. Producing aglycons of ginsenosides in bakers’ yeast. Sci Rep, 2014, 4: 3698.
[23] Carelli M, Biazzi E, Panara F, et al. Medicago truncatula CYP716A12 is a multifunctional oxidase involved in the biosynthesis of hemolytic saponins. Plant Cell, 2011, 23(8): 3070–3081.
[24] Han JY, Kim HJ, Kwon YS, et al. The Cyt P450 enzyme CYP716A47 catalyzes the formation of protopanaxadiol from dammarenediol-II during ginsenoside biosynthesis in Panax ginseng. Plant Cell Physiol, 2011, 52(12): 2062–2073.
[25] Sun MX, Liu JD, Du GH, et al. Regulation of isoprenoid pathway for enhanced production of linalool in Saccharomyces cerevisiae. Chin J Biotech, 2013, 29(6): 751–759 (in Chinese).
孙明雪, 刘继栋, 堵国成, 等. 调控酿酒酵母类异戊二烯合成途径强化芳樟醇合成. 生工程学报, 2013, 29(6): 751–759.
[26] Tokuhiro K, Muramatsu M, Ohto C, et al. Overproduction of geranylgeraniol by metabolically engineered Saccharomyces cerevisiae. Appl Environ Microbiol, 2009, 75(17): 5536–5543.
[27] Daum G, Tuller G, Nemec T, et al. Systematic analysis of yeast strains with possible defects in lipid metabolism. Yeast, 1999, 15(7): 601–614.
(本文责编 郝丽芳)
Production of β-carotene by metabolically engineered Saccharomyces cerevisiae
Beibei Wang1,2,3, Mingyu Shi1,2,3, Dong Wang1,2,3, Jiaoyang Xu2,3, Yi Liu2,3, Hongjiang Yang1,Zhubo Dai2,3, and Xueli Zhang2,3
1 College of Biotechnology, Tianjin University of Science & Technology, Tianjin 300457, China
2 Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
3 Key Laboratory of Systems Microbial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
β-carotene has a wide range of application in food, pharmaceutical and cosmetic industries. For microbial production of β-carotene in Saccharomyces cerevisiae, the supply of geranylgeranyl diphosphate (GGPP) was firstly increased in S. cerevisiae BY4742 to obtain strain BY4742-T2 through over-expressing truncated 3-hydroxy-3-methylglutaryl-CoA reductase (tHMGR), which is the major rate-limiting enzyme in the mevalonate (MVA) pathway, and GGPP synthase (GGPS), which is a key enzyme in the diterpenoid synthetic pathway. The β-carotene synthetic genes of Pantoea agglomerans and Xanthophyllomyces dendrorhous were further integrated into strain BY4742-T2 for comparing β-carotene production. Over-expression of tHMGR and GGPS genes led to 26.0-fold increase of β-carotene production. In addition, genes from X. dendrorhous was more efficient than those from P. agglomerans for β-carotene production in S. cerevisiae. Strain BW02 was obtained which produced 1.56 mg/g (dry cell weight) β-carotene, which could be used further for constructing cell factories for β-carotene production.
β-carotene, Pantoea agglomerans, Xanthophyllomyces dendrorhous, Saccharomyces cerevisiae
November 18, 2013; Accepted: January 22, 2014
Xueli Zhang. Tel/Fax: +86-22-84861983; E-mail: zhang_xl@tib.cas.cn
王贝贝, 施明雨, 王冬, 等. 代谢工程改造酿酒酵母生产β-胡萝卜素. 生物工程学报, 2014, 30(8): 1204−1216.
Wang BB, Shi MY, Wang D, et al. Production of β-carotene by metabolically engineered Saccharomyces cerevisiae. Chin JBiotech, 2014, 30(8): 1204−1216.
Supported by: National High Technology Research and Development Program (863 Program) (No. 2012AA02A704), National Natural Science Foundation of China (No. 81202864), National Basic Research Program of China (973 Program) (No. 2011CBA00800), Hundred Talent Program of the Chinese Academy of Sciences.
Zhubo Dai. Tel/Fax: +86-22-84861946; E-mail: dai_zb@tib.cas.cn
国家高技术研究发展计划 (863计划) (No. 2012AA02A704),国家自然科学基金 (No. 81202864) ,国家重点基础研究发展计划 (973计划) (No. 2011CBA00800),中国科学院百人计划资助。
时间:2014-03-10 网络出版地址:http://www.cnki.net/kcms/doi/10.13345/j.cjb.130582.html
