RBS文库调控重组大肠杆菌β-胡萝卜素合成途径关键基因提高β-胡萝卜素合成能力
2014-06-24戴冠苹孙涛苗良田李清艳肖冬光张学礼
戴冠苹,孙涛,苗良田,李清艳,肖冬光,张学礼
1 天津科技大学生物工程学院,天津 300457
2 中国科学院天津工业生物技术研究所,天津 300308
3 中国科学院系统微生物工程重点实验室,天津 300308
工业生物技术
RBS文库调控重组大肠杆菌β-胡萝卜素合成途径关键基因提高β-胡萝卜素合成能力
戴冠苹1,2,3*,孙涛1,2,3*,苗良田1,2,3,李清艳2,3,肖冬光1,张学礼2,3
1 天津科技大学生物工程学院,天津 300457
2 中国科学院天津工业生物技术研究所,天津 300308
3 中国科学院系统微生物工程重点实验室,天津 300308
β-胡萝卜素属于类胡萝卜素家族的一员,在药品、保健品、化妆品和食品行业有广泛的应用。本研究通过用RBS文库对重组大肠杆菌CAR005中β-胡萝卜素合成途径的关键基因dxs、idi和crt操纵子进行调控来提高β-胡萝卜素合成能力。研究发现3个基因分别用RBS文库调控后,与起始菌株相比β-胡萝卜素产量最高分别有7%、11%和17%的提高,表明使用RBS文库调控比使用多个固定强度启动子调控能筛选到更有利于目标产品合成的基因表达强度。三基因组合调控后,β-胡萝卜素产量相对于CAR005菌株提高了35%。同时发现,单基因文库筛选到的最优强度对于组合调控来说,未必是最优强度。本研究为利用基因表达调控优化目标产物合成途径提供了一种新的方案。
β-胡萝卜素,RBS文库,基因表达调控,大肠杆菌
β-胡萝卜素 (β-carotene) 是类胡萝卜素家族中的典型代表,是一种优良的天然黄色色素,在人体和动物体内可以转化为维生素A,同时其本身具有良好的预防“3C”即癌症、心血管疾病和白内障的作用,也能提高机体的免疫功能,兼具有较高的营养价值和药用价值[1-4]。世界上已有50多个国家地区批准使用,目前广泛应用于食品、药品、化妆品和保健品行业[5-6]。随着合成生物学的发展,通过构建微生物细胞工厂生产生物基化学品因其具有绿色清洁的生产工艺和更高的生产特异性而得到越来越多的关注[4,7]。
自然界中的多种生物均能合成β-胡萝卜素[8-10]。大肠杆菌遗传背景清楚、操作简单,以大肠杆菌作为出发菌株,运用代谢工程手段构建生产类胡萝卜素的基因工程菌,已成为包括β-胡萝卜素在内的多种类胡萝卜素产品生产的新模式[11-15]。对产β-胡萝卜素大肠杆菌的遗传改造主要集中在过表达大肠杆菌自身的2-甲基-D-赤藻糖醇-4-磷酸途径 (MEP途径) 中的关键基因和过表达外源的甲羟戊酸途径 (MVA途径)。Yuan等[11]为了鉴定MEP途经的限速步骤,利用同源重组的方法,用T5启动子在染色体上分别替换了MEP途径的各基因的启动子,发现调控dxs、idi、ispB、ispDF基因后,β-胡萝卜素产量分别提高了100%、40%、20%和40%。用T5启动子对这4个基因进行组合调控后,β-胡萝卜素产量提高了6.3倍,达到6 mg/g干重细胞。Suh[16]用强启动子T5调控MEP途经的关键基因dxs、idi和ispDF后,β-胡萝卜素产量比对照提高了4.5倍。Yoon等将MVA途经的下游3个基因和β-胡萝卜素合成相关基因以质粒形式在大肠杆菌中过表达,在外源添加甲羟戊酸的情况下,产量达503 mg/L,含量达49.3 mg/g细胞干重[12-13]。Nam等以质粒形式过表达MEP途径中的dxs基因和外源MVA途径基因,将β-胡萝卜素产量提高到2.47 g/L[17]。
以前的绝大部分研究都是使用强启动子(如T7、T5和Trc) 来调控MEP或MVA途径中的关键基因,从而提高β-胡萝卜素的合成能力。然而,研究表明强启动子对于获得目的产物的最大代谢流量来说并不一定是最优的[18-20]。
我们首次用多个固定强度的调控元件去调控MEP途径各基因的表达,发现MEP途径中的关键基因为dxs和idi基因;并且证明使用多个不同强度的调控元件对基因表达进行调控比仅使用强启动子调控更为有效[21]。我们用同样方法对β-胡萝卜素合成途径的5个模块进行系统研究,得到CAR005菌株,β-胡萝卜素产量达2.16 g/L,含量达60 mg/g 干重细胞[22]。选取多个固定强度的调控元件虽然比仅使用强启动子更能获得较好的表达强度,但是由于调控元件的数量和强度范围有限,往往也并不能获得最优的表达强度。
原核生物mRNA上的核糖体结合位点(RBS) 是位于起始密码子AUG上游3–9个富含嘌呤核苷酸的序列,与核糖体小亚基16sRNA富含嘧啶的序列互补,是核糖体RNA识别和结合的位点。RBS的序列和蛋白翻译速率密切相关,能显著影响目的蛋白的表达量。我们前期利用RBS文库 (序列为CAGGAGRNNNNNN)调控了E. coli ATCC 8739染色体上的β-半乳糖苷酶基因 (lacZ),随机选29个菌测定β-半乳糖苷酶活性,活性范围是lacZ基因原始启动子经IPTG诱导后的0.17–8.6倍,说明RBS文库可以有效调控基因,并且调控范围较大[23]。本研究拟用RBS区文库对CAR005中β-胡萝卜素代谢途径的关键基因进行精确调控,研究其是否比使用多个固定强度调控元件更有利于β-胡萝卜素的生产,同时也为代谢工程中基因表达的精确调控提供一种新思路。
1 材料与方法
1.1 材料
1.1.1主要试剂
氨苄青霉素和氯霉素购自上海生工生物工程有限公司;质粒小量快速提取试剂盒购自美国Axygen公司;DNA回收试剂盒购自美国Biomiga公司;PrimeSTAR HS DNA聚合酶,DNA Marker trans2K,购自大连宝生物工程公司;限制性内切酶PacⅠ、BamHⅠ、DpnⅠ、T4 DNA连接酶、快连酶、T4多聚核苷酸激酶购自NEB公司;胡萝卜素标品购自美国Sigma公司 (Cat. No. C4582);其他试剂均为分析纯。
1.1.2仪器与设备
紫外可见分光光度计,Shimadzu UV-2550 spectrophotometer (Shimadzu,Kyoto,Japan);PCR扩增仪,Eppendorf Mastercycler gradient;全自动凝胶成像系统,AlphaImager HP;电转仪MicroPulser;台式高速离心机,Eppendorf 5415D;高速冷冻离心机,Thermo Sorvall Evolution RC;高效液相色谱,Agilent Technologies Series 1200。
1.1.3菌株
本研究所用的菌株见表1。

表1 本研究所用的菌株Table 1 Strains used in this study
1.2 方法
1.2.1培养基
LB培养基:每升培养基包含10 g胰蛋白胨、5 g酵母提取物和5 g氯化钠;氨苄青霉素、氯霉素终浓度分别为100、34 μg/mL。LB固体培养基含1.5%的琼脂。
无盐蔗糖培养基:每升培养基包含10 g胰蛋白胨、5 g酵母提取物和10%的蔗糖。无盐蔗糖固体培养基含1.5%的琼脂。好氧培养:将保存于−80 ℃的菌种在LB平板上划线活化,挑取单菌落接种到15 mm×100 mm试管 (含4 mL LB培养基)中,37 ℃、250 r/min培养24 h,1%的接种量转接到100 mL三角瓶 (含10 mL LB培养基) 中,30 ℃、250 r/min 培养24 h。收集菌液用于测定β-胡萝卜素含量。
1.2.2 RBS文库调控β-胡萝卜素合成途径关键基因
本研究通过两步同源重组的方法构建基因的RBS文库,获得的重组菌株中无抗生素基因和FRT序列残留[24]。第一步同源重组,在将要调控的基因ATG的前面插入一个cat-sacB基因片段。第二步同源重组中,cat-sacB基因簇被带有RBS文库的DNA片段取代。含RBS文库的DNA片段是由一对长引物,以M1-93基因组DNA为模板,PCR扩增而来;上游引物包括待调控基因原始启动子外的50 bp碱基和与M1-93的人工启动子同源的20 bp碱基。下游引物包括待调控基因的起始密码子后的50 bp碱基 (基因的+1到+50区)、RBS区兼并引物片段(CAGGAGRNNNNNN) 和与M1-93的人工启动子同源的21 bp碱基。两步同源重组的步骤见图1。克隆的筛选是通过在含有蔗糖的无盐LB培养基中培养完成的。在蔗糖存在的情况下,表达sacB基因的菌株因为在培养过程中积累果聚糖对细胞产生毒性而被杀死。cat-sacB基因簇被替换掉的细胞通过富集而被筛选出来[21-23]。

图1 RBS文库构建流程图 (A:第一步同源重组;B:第二步同源重组)Fig. 1 Modulation of gene expression with RBS library by the two-step recombination method. (A) The first recombination step. (B) The second recombination step.
对于dxs基因,使用dxs-cat-F/dxs-cat-R引物 (表2),以pXZ-CS[26]为模板,PCR扩增出DNA片段,将该片段纯化后电转入含有pKD46[25]的待调控菌株CAR005的感受态细胞中,在含有氨苄青霉素、氯霉素的LB平板中培养过夜。挑选单克隆,用引物cat-up/dxs-381-down进行 PCR验证 (表2),验证正确的克隆命名为Dxs-cat-sacB。另外,使用dxs-up-p/dxs-RBSL-down引物 (表2),以 M1-93菌株的基因组DNA模板,PCR扩增出RBS库片段,将该片段纯化后电转入Dxs-cat-sacB的感受态细胞中,在250 mL三角瓶 (含50 mL无盐蔗糖培养基) 中培养12 h。然后将菌液稀释、涂布到2个无盐蔗糖平板上,37 ℃过夜培养。每个平板得到300个左右重组子,共600个左右重组子。随机挑取100个克隆分别在氯霉素平板和LB平板上进行初筛,90%以上都为重组成功菌株 (不能在氯霉素平板上生长)。随机选5个菌株测序,RBS区域的序列各不相同,表明库的多样性比较丰富。
随机挑选30个单克隆,用引物p-yanzheng/dxs-381-down (表2) 进行 PCR 验证,挑选15个验证正确、颜色比较黄的克隆命名为 dxs1、dxs2、…、dxs15,用于测定β-胡萝卜素产量。采用同样的方法调控idi基因和crt操纵子,所用的引物序列见表2。
1.2.3 RBS文库组合调控β-胡萝卜素合成途径关键基因
采用上述两步同源重组法,对β-胡萝卜素合成途径中的3个关键基因 (包括dxs、idi和crt操纵子) 进行组合调控。组合调控方法为:选取单基因调控后产量提高最高的菌株crtE3为出发菌株,对dxs基因进行RBS文库调控,挑选30个验证正确、颜色较黄的克隆命名为crtE3-dxs1、crtE3-dxs2、…、crtE3-dxs30,用于测定β-胡萝卜素产量。同时,使用引物dxs-up-p/dxs-381-down (表2),以dxs单基因RBS文库调控后产量最高的菌株dxs15为模板,PCR扩增出DNA片段,利用该调控元件调控crtE3菌株的dxs基因,筛选验证正确的菌株,命名为crtE3-dxs15A,用于测定β-胡萝卜素产量。采用同样的方法,选取crt操纵子和dxs基因组合调
控后产量最高的菌株为出发菌株,对idi基因进行RBS文库调控。

表2 本研究所用的引物Table 2 Primers used in this work
1.2.4 β-胡萝卜素产量的检测方法
通过测定丙酮萃取的β-胡萝卜素在453 nm下的吸光度来确定β-胡萝卜素产量。取500 μL菌液于14 000 r/min离心3–5 min,无菌水清洗后,用1 mL丙酮悬浮沉淀,在55 ℃黑暗条件下萃取15 min,然后将样品在14 000 r/min下离心10 min,将含有β-胡萝卜素的上清转入新的离心管中。紫外分光光度计453 nm下测定β-胡萝卜素吸光度值,并计算其对细胞浊度(OD600) 的相对值,表示单位菌体β-胡萝卜素的相对产量。
2 结果与分析
2.1 关键基因dxs、idi和crt操纵子单独调控
我们构建产β-胡萝卜素重组大肠杆菌CAR005时,发现dxs、idi和crt操纵子是β-胡萝卜素合成途径中的关键基因。本研究从CAR005出发,使用两步同源重组方法 (图1),分别构建了dxs、idi和crt操纵子的RBS文库,分别随机挑选15个菌株,测定β-胡萝卜素产量,以验证RBS文库调控是否优于固定强度调控,并进一步提高重组菌株中β-胡萝卜素产量,结果见图2。
由图2可知,3个基因构建RBS文库后,都筛选到β-胡萝卜素产量提高的菌株,dxs基因调控后,β-胡萝卜素产量最高菌株为dxs15,相对于CAR005产量提高了7%。idi基因调控后,β-胡萝卜素产量最高菌株为idi10,相对于CAR005产量提高了11%。crt操纵子调控后,β-胡萝卜素产量最高菌株为crtE3,相对于CAR005产量提高了17%。不过crt操纵子基因调控后菌体生长有所下降。因为出发菌株CAR005中dxs、idi和crt操纵子的调控元件为固定强度中选出的最优强度,RBS文库调控后均得到β-胡萝卜素产量提高的菌株,表明RBS文库调控相对于多个固定强度调控,能筛选到更有利于β-胡萝卜素合成的表达强度。单基因调控β-胡萝卜素产量最高菌株的RBS序列见表3。
2.2 crt操纵子和dxs基因组合调控结果
三基因分别调控后,调控crt操纵子的文库中挑到产量最高的菌株crtE3,产量相对于CAR005提高了17%,而另外两个基因文库调控后产量最高的分别提高了7%和11%,因此从crtE3出发,文库调控dxs基因。同时,用dxs的RBS文库中产量最高的菌株dxs15的调控元件去调控crtE3中的dxs基因。由图3可知,组合调控crt操纵子和dxs基因后,只有crtE3-dxs3和crtE3-dxs4产量比crtE3略高,β-胡萝卜素产量分别是CAR005的1.19倍和1.18倍,表明在crtE3菌株中,dxs基因的表达强度已经不是β-胡萝卜素合成的限制因素。另外,dxs15的调控元件调控crtE3的dxs基因后,β-胡萝卜素产量相对于CAR005只提高了8%,而相对于crtE3产量反而有所下降。表明单基因文库筛选到的最优强度对于组合调控来说,未必是最优的强度。β-胡萝卜素产量最高菌株crtE3-dxs3的dxs基因的RBS序列见表3。
2.3 crt操纵子、dxs和idi基因组合调控结果
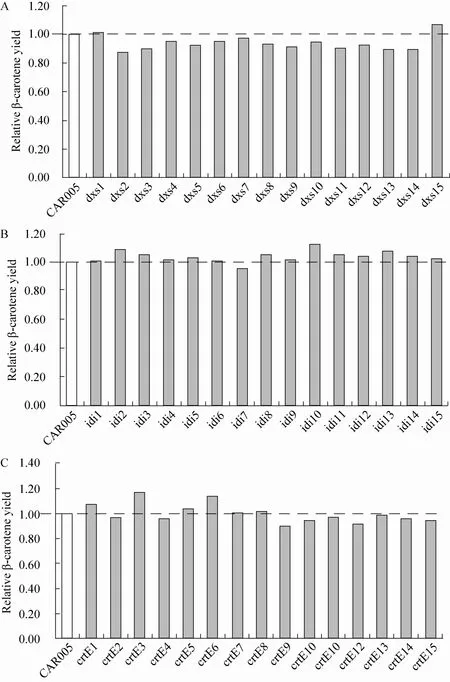
图2 RBS文库调控dxs, idi和crt操纵子后β-胡萝卜素相对产量 (A:RBS文库调控dxs基因;B:RBS文库调控idi基因;C:RBS文库调控crtE操纵子)Fig. 2 Relative β-carotene production by E. coli strains after modulating dxs, idi and crt operon of strain CAR005 with RBS libraries. β-carotene yield was compared to parent strain CAR005. (A) Modulating dxs gene. (B) Modulating idi gene. (C) Modulating crt operon.

表3 代表性菌株的dxs、idi和crt基因的RBS序列Table 3 RBS sequence of dxs, idi and crt genes of representative strains

图3 crt操纵子和dxs基因组合调控后β-胡萝卜素相对产量Fig. 3 Relative β-carotene yield after combined modulation of crt operon and dxs genes expression.

图4 crt操纵子、dxs和idi基因组合调控后β-胡萝卜素相对产量Fig. 4 Relative β-carotene yield after combined modulation of crt operon, dxs and idi genes expression.
选取两基因组合调控β-胡萝卜素产量最高的菌株crtE3-dxs3为出发菌株,进一步使用RBS文库及idi的RBS文库中产量最高的菌株idi10的调控元件去调控idi基因。由结果可知 (图4),组合调控crt操纵子、dxs和idi基因后,β-胡萝卜素产量有明显提高,所选的30个菌株中,28个菌株的β-胡萝卜素产量均高于出发菌株crtE3-dxs3。产量最高菌株crtE3-dxs3-idi20的β-胡萝卜素产量是CAR005的1.32倍。另外,idi单基因RBS文库得到的最优强度调控crtE3-dxs3的idi基因后,β-胡萝卜素产量仅为CAR005的1.23倍,远低于文库调控所得的最高产量菌株,进一步说明单基因文库筛选到的最优强度对于组合调控来说,未必是最优强度。
将所有RBS文库调控中产量最高的菌株,一起做3个重复,结果见图5。由结果可知,建库时只挑一个克隆去培养测定的结果与3次重复结果基本是一致,说明建库时挑多个克隆、不设重复去筛选高产菌株的方法可行。经RBS文库组合调控β-胡萝卜素合成途径中的3个关键基因后,β-胡萝卜素产量相对于出发菌株提高了35%。β-胡萝卜素产量最高菌株crtE3-dxs3-idi20的idi基因的RBS序列见表3。

图5 调控β-胡萝卜素合成途径关键基因后β-胡萝卜素的相对产量Fig. 5 Relative β-carotene yield of engineered E. coli strains after modulating key β-carotene synthesis genes expression. Three repeats were performed for each strain, and the error bars represented standard deviation.
3 结论
本文利用RBS文库调控的方法对β-胡萝卜素合成途径中的3个关键基因dxs、idi和crt操纵子进行了单基因调控和组合调控,使β-胡萝卜素产量提高了35%。研究发现,使用RBS文库调控比使用多个固定强度调控的效果更好,能筛选到更有利于目标产品合成的基因表达强度。同时发现,单基因文库筛选到的最优强度对于组合调控来说,未必是最优强度。本研究为利用基因表达调控优化目标产物合成途径提供了一种新的方案。
REFERENCES
[1] Giovannucci E, Ascherio A, Rimm EB, et al. Intake of carotenoids and retino in relation to risk of prostate cancer. J Natl Cancer Inst, 1995, 87(23): 1767–1776.
[2] Malvy DJM, Burtschy B, Arnaud J, et al. Serum beta-carotene and antioxidant micronutrients in children with cancer. Int J Epidemiol, 1993, 22(5): 761–771.
[3] Street DA, Comstock GW, Salkeld RM, et al. Serum antioxidants and myocardial infarction are low levels of carotenoids and alpha-tocopherol risk factors for myocardial infarction. Circulation, 1994, 90(3): 1154–1161.
[4] Ajikumar PK, Tyo K, Carlsen S, et al. Terpenoids: opportunities for biosynthesis of natural product drugs using engineered microorganisms. Mol Pharm, 2008, 5(2): 167–190.
[5] Cane DE. Biosynthesis meets bioinformatics. Science, 2000, 287(5454): 818–819.
[6] Lange BM, Rujan T, Martin W, et al. Isoprenoid biosynthesis: the evolution of two ancient and distinct pathways across genomes. Proc Natl Acad Sci USA, 2000, 97(24): 13172–13177.
[7] Zhang XL. Twenty years development of metabolic engineering--a review. Chin J Biotech, 2009, 25(9): 1285–1295 (in Chinese).张学礼. 代谢工程发展20年. 生物工程学报, 2009, 25(9): 1285–1295.
[8] Mehta BJ, Obraztsova IN, Cerdá-Olmedo E. Mutants and intersexual heterokaryons of Blakeslea trispora for production of β-carotene and lycopene. Appl Environ Microbiol, 2003, 69(7): 4043–4048.
[9] Hu X, Ma X, Tang P, et al. Improved β-carotene production by oxidative stress in Blakeslea trispora induced by liquid paraffin. Biotechnol Lett, 2013, 35(4): 559–563.
[10] Moline M, Libkind D, van Broock M. Production of torularhodin, torulene, and beta-carotene by Rhodotorula yeasts. Methods Mol Biol, 2012, 898: 275–283.
[11] Yuan LZ, Rouvière PE, LaRossa RA, et al. Chromosomal promoter replacement of the isoprenoid pathway for enhancing carotenoid production in E. coli. Metab Eng, 2006, 8(1): 79–90.
[12] Yoon SH, Park HM, Kim JE, et al. Increased β-carotene production in recombinant Escherichia coli harboring an engineered isoprenoid precursor pathway with mevalonate addition. Biotechnol Prog, 2007, 23(3): 599–605.
[13] Yoon SH, Lee SH, Das A, et al. Combinatorial expression of bacterial whole mevalonate pathway for the production of β-carotene in E. coli. J Biotechnol, 2009, 140(3): 218–226.
[14] Albermann C, Trachtmann N, Sprenger GA. A simple and reliable method to conduct and monitor expression cassette integration into the Escherichia coli chromosome. Biotechnol J, 2010, 5(1): 32–38.
[15] Lemuth K, Steuer K, Albermann C. Engineering of a plasmid-free Escherichia coli strain for improved in vivo biosynthesis of astaxanthin. Microb Cell Fact, 2011, 10(1): 29.
[16] Suh W. High isoprenoid flux Escherichia coli as a host for carotenoids production. Methods Mol Biol, 2012, 834: 49–62.
[17] Nam HK, Choi JG, Lee JH, et al. Increase in the production of β-carotene in recombinant Escherichia coli cultured in a chemically defined medium supplemented with amino acids. Biotechnol Lett, 2013, 35(2): 265–271.
[18] Pfleger BF, Pitera DJ, Smolke CD, et al. Combinatorial engineering of intergenic regions in operons tunes expression of multiple genes. Nat Biotechnol, 2006, 24(8): 1027–1032.
[19] Kim SW, Kim JB, Ryu JM, et al. High-level production of lycopene in metabolically engineered E. coli. Process Biochem, 2009, 44(8): 899–905.
[20] Alper H, Fischer C, Nevoigt E, et al. Tuning genetic control through promoter engineering. Proc Natl Acad Sci USA, 2005, 102(36): 12678–12683.
[21] Zhao J, Liu Y, Li QY, et al. Modulation of isoprenoid gene expression with multiple regulatory parts for improved beta-carotene production. Chin J Biotech, 2013, 29(1): 41–55 (in Chinese).
赵婧, 刘怡, 李清艳, 等. 多个调控元件调控萜类合成途径基因表达提高β-胡萝卜素的生产. 生物工程学报, 2013, 29(1): 41–55.
[22] Zhao J, Li Q, Sun T, et al. Engineering central metabolic modules of Escherichia coli for improving β-carotene production. Metab Eng, 2013, 17: 42–50.
[23] Chen J, Zhu X, Tan Z, et al. Activating C4-dicarboxylate transporters DcuB and DcuC for improving succinate production. Appl Microbiol Biotechnol, 2014, 98(5): 2197–2205.
[24] Lu J, Tang J, Liu Y, et al. Combinatorial modulation of galP and glk gene expression for improved alternative glucose utilization. Appl Microbiol Biotechnol, 2012, 93(6): 2455–2462.
[25] Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci USA, 2000, 97(12): 6640–6645.
[26] Tan Z, Zhu X, Chen J, et al. Activating phosphoenolpyruvate carboxylase and phosphoenolpyru vate carboxykinase in combination for improvement of succinate production. Appl Environ Microbiol, 2013, 79(16): 4838–4844.
(本文责编 郝丽芳)
Modulating expression of key genes within β-carotene synthetic pathway in recombinant Escherichia coli with RBS library to improve β-carotene production
Guanping Dai1,2,3*, Tao Sun1,2,3*, Liangtian Miao1,2,3, Qingyan Li2,3, Dongguang Xiao1, and Xueli Zhang2,3
1 College of Biotechnology, Tianjin University of Science & Technology, Tianjin 300457, China
2 Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
3 Key Laboratory of Systems Microbial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
β-carotene belongs to carotenoids family, widely applied in pharmaceuticals, neutraceuticals, cosmetics and food industries. In this study, three key genes (dxs, idi, and crt operon) within β-carotene synthetic pathway in recombinant Escherichia coli strain CAR005 were modulated with RBS Library to improve β-carotene production. There were 7%, 11% and 17% increase of β-carotene yield respectively after modulating dxs, idi and crt operon genes with RBS Library, demonstrating that modulating gene expression with regulatory parts libraries would have more opportunities to obtain optimal production of target compound. Combined modulation of crt operon, dxs and idi genes led to 35% increase of β-carotene yield compared to parent strain CAR005. The optimal gene expression strength identified in single gene modulation would not be the optimal strength when used in combined modulation. Our study provides a new strategy for improving production of target compound through modulation of gene expression.
β-carotene, RBS library, modulation of gene expression, Escherichia coli
November 9, 2013; Accepted: December 13, 2013
Xueli Zhang. Tel/Fax: 86-22-84861983; E-mail: zhang_xl@tib.cas.cn
戴冠苹, 孙涛, 苗良田, 等. RBS文库调控重组大肠杆菌β-胡萝卜素合成途径关键基因提高β-胡萝卜素合成能力. 生物工程学报, 2014, 30(8): 1193−1203.
Dai GP, Sun T, Miao LT, et al. Modulating expression of key genes within β-carotene synthetic pathway in recombinant
Escherichia coli with RBS library to improve β-carotene production. Chin J Biotech, 2014, 30(8): 1193−1203.
Supported by: National Basic Research Program of China (973 Program) (No. 2011CBA00800), Tianjin Key Technology R&D Program of Tianjin Municipal Science and Technology Commission (No. 12ZCZDSY14700), National Natural Science Foundation of China (No. 31100047), the Hundred Talent Program of the Chinese Academy of Sciences.
Qingyan Li. Tel/Fax: 86-22-84861946; E-mail: li_qy@tib.cas.cn
*These authors contributed equally to this work.
国家基础研究发展计划 (973计划) (No. 2011CBA00800),天津市科技支撑计划重点项目 (No. 12ZCZDSY14700),国家自然科学基金 (No. 31100047), 中国科学院百人计划资助。
时间:2014-02-25 网络出版地址:http://www.cnki.net/kcms/doi/10.13345/j.cjb.130570.html
