两个大豆GmSBP基因的特征、亚细胞定位及对非生物胁迫的响应
2014-06-24杨艳王爽黄丽燕马洪雨舒英杰何小玲麻浩
杨艳,王爽,黄丽燕,马洪雨,舒英杰,何小玲,麻浩
南京农业大学作物遗传与种质创新国家重点实验室,江苏南京210095
农业生物技术
两个大豆GmSBP基因的特征、亚细胞定位及对非生物胁迫的响应
杨艳,王爽,黄丽燕,马洪雨,舒英杰,何小玲,麻浩
南京农业大学作物遗传与种质创新国家重点实验室,江苏南京210095
我国南方春大豆种子发育过程中,常处于高温、高湿季节,加之种子本身富含蛋白(约40%)和脂肪(约20%),导致南方春大豆种子易劣变。本项目组前期差异蛋白质组学研究发现蔗糖结合蛋白在高温高湿胁迫168 h时在种子田间劣变抗性品种湘豆3号发育种子中呈下调表达。为进一步从分子水平了解GmSBP基因表达以及响应高温高湿胁迫的特性,本研究利用RT-PCR技术从大豆扩增出两个GmSBP基因(GmSBP2和GmSBPL)。两个基因编码的蛋白均为亲水性,不完整的膜蛋白。荧光定量PCR分析表明:在高温高湿条件下,种子田间劣变不抗品种宁镇1号和抗性品种湘豆3号发育种子中GmSBP2和GmSBPL基因表达量均受高温高湿胁迫影响,也会导致种子中蔗糖和可溶性糖含量变化。在籽粒发育过程中,GmSBP2和GmSBPL基因表达量在花后30 d左右达到最高,对应时期的蔗糖和可溶性糖含量也达到最大值。组织特异性显示GmSBP和GmSBPL基因在不同组织间存在差异表达。亚细胞定位结果表明GmSBP2和Gm SBPL蛋白均定位在细胞膜和细胞质中。以上结果表明GmSBP2和GmSBPL基因可能参与了植物非生物胁迫的应答过程,这将从一个侧面丰富我们对大豆种子田间劣变性和劣变抗性的认识。
大豆,SBP,基因分离,表达分析,亚细胞定位
种子生理成熟后,出现不可逆转的质量下降变化,称为劣变(Seed deterioration)或者老化(Aging)。种子劣变具有不可逆、不可避免的特性[1]。不同品种种子老化速率不同[2]。种子劣变包括收获前劣变和收获后劣变。收获前劣变主要是因为高温高湿条件下加速生理生化变化导致种子的老化[3],表现为细胞器的解体,酶活性下降,呼吸速率降低,DNA、RNA、蛋白质等一些大分子物质合成速率减慢,核糖体水解,膜完整性丧失,膜脂过氧化及代谢物质渗漏等[4]。种子劣变会降低种子质量、活力、贮藏力及田间出苗率从而造成难以估算的经济损失。中国南方春大豆种子收获时正处于高温、高湿季节,加之大豆(Glycine max(L.)Merr.)本身富含蛋白和脂肪,春大豆收获前后及贮藏期间极易受环境影响而发生劣变,种子活力迅速下降。种子劣变已成为中国南方地区发展春大豆生产的重大障碍。
国内外有关大豆种子劣变的研究主要集中在收获及贮藏期间引起劣变的内外诱因,野生与栽培大豆间劣变的差异程度,劣变过程中细胞学、遗传学和生理生化等变化以及劣变对农艺性状的影响等方面。对种子劣变的分子机制研究比较少。目前防止种子劣变的方法主要是通过改变贮藏条件,降低种子含水量等物理方法。大豆籽粒中碳水化合物含量约为30%左右,主要成分是蔗糖、乳糖和少量粗纤维。蔗糖是植物生长发育过程中的重要化合物之一,光合作用的主要产物,植物的能量载体,细胞代谢的调节因子,可能通过影响基因表达发挥作用,同时蔗糖具有信号功能[5-6]可以诱导或阻遏某些基因的表达[7]。蔗糖被认为在信号传导过程中参与了植物激素、磷酸盐、光及逆境胁迫相关的过程[8]。国外学者通过对D-葡萄糖在光合作用和防御反应的关系中所反应出的相关代谢调节的影响研究时指出:碳水化合物作为一种信号分子,能够在胁迫条件下激活细胞内不同的信号途径,最终,它们统一协调库和源的代谢关系以激活防御系统[9]。因此研究植物蔗糖的代谢及生理生化规律是很有必要的。大豆种子中蔗糖积累受一系列因子的共同作用,如蔗糖的合成、运输、分配及在种子中的代谢等,其中蔗糖在种子中的分解强度是增强库强、提高糖卸载能力、保证新合成的蔗糖由源到库不断运输的重要环节[10]。在植物体中,蔗糖分子从源叶装载进入韧皮部及从韧皮部卸载进入库组织主要通过2种不同的途径来进行,即共质体途径和质外体途径[11]。质外体途径的装载主要由蔗糖主动越膜装载入韧皮部进行运输,然后在库端越膜卸载进入库器官细胞。早期研究发现蔗糖的跨膜运输及其在植物中的分配需要依赖于膜上的蔗糖转运蛋白(Sucrose/H+cotransporters或sucrose transporters,SUCs或SUTs),蔗糖转运蛋白在蔗糖转运过程中起着极为重要的作用[12-14]。随后发现一种新的参与蔗糖转运的蛋白-蔗糖结合蛋白。蔗糖结合蛋白最初被发现是在子叶中与蔗糖类似物6-脱氧-6’-(4-叠氮-2羟基)-苯甲酰氨基-蔗糖有强亲和力,而蔗糖类似物6-脱氧-6’-(4-叠氮-2羟基)-苯甲酰氨基-蔗糖能竞争性的抑制放射性标记的蔗糖从大豆子叶进入细胞原生质体[15-16]。SBP基因在分子结构上与SUT家族无关,结构上与豌豆球蛋白类似[17],属于贮藏蛋白家族。有大量实验证明其与植物蔗糖转运有关[18]。例如在烟草细胞中抑制表达GmSBP,植物体表现出了与蔗糖转运受损时相同的表型[19-20]。通过将GmSBP在SBP转化酶缺失的酵母突变株系内进行异源表达,发现酵母细胞可以在以蔗糖为唯一碳源的培养基上生长[21]。
本项目组前期春大豆差异蛋白质组学研究发现蔗糖结合蛋白在高温高湿胁迫168 h时在种子田间劣变抗性品种湘豆3号发育种子中呈下调表达[22]。本研究分离出与蔗糖转运有关的两个GmSBP基因,并进行亚细胞定位,同时以种子田间劣变不抗品种宁镇1号和抗性品种湘豆3号为材料,模拟田间高温高湿条件,对其在逆境胁迫中的表达情况及其转运产物含量变化进行分析,以期从分子水平了解GmSBP基因表达及响应高温高湿胁迫的特性,为进一步从一个侧面揭示春大豆种子田间劣变的分子机制奠定基础。
1 材料与方法
1.1 植物材料的培养及胁迫处理
选用实验室当年保存的种子田间劣变不抗品种宁镇1号和抗性品种湘豆3号种子,次氯酸钠表面消毒,浸种1–2 h,25℃培养箱中催芽2–3 d,播种于装有营养土的花盆中,置于室外生长。当幼苗长出第一片三出复叶时,取根、茎、叶组织。随后取盛花期的花。当植株长到种子生理期(R7期)时,取一部分植株于培养箱内进行高温高湿处理:温度40℃/30℃(白天/黑夜),RH 100%/70%,光周期10 h/14 h,处理7 d。其他于室外正常生长作为对照组。分别取处理和对照组0、24、48、96、168 h的豆荚。室外生长的大豆于盛花期开始挂牌,当天计为0 d,分别取盛花后15、20、25、30、35、40、45、50、55、60 d的豆荚。所有样品立即置液氮中速冻,于–80℃保存备用。用2周苗龄的幼叶提取总RNA和基因组DNA。亚细胞定位材料为新鲜洋葱表皮。
1.2 总DNA和RNA提取纯化和cDNA的制备
采用CTAB法提取基因组总DNA。参照新型植物总RNA提取试剂盒说明书提取大豆材料的RNA。采用TaKaRa公司反转录试剂合成第一链cDNA,–20℃保存备用。
1.3 克隆引物的设计
从NCBI中搜索已经公布的GmSBP基因序列,发现两个蔗糖转运蛋白基因:GmSBP2 (GenBank Accession No.AY234869.1)和GmSBPL (GenBank Accession No.XM_003536582.1)。在基因上下游设计特异性引物(表1),以DNA和cDNA为模板进行PCR扩增,反应总体积为25 μL,DNA/cDNA 2 μL,10×PCR缓冲液(Mg2+Free)2.5 μL,25 mmol/L MgCl22.5 μL,2.5 mmol/L dNTPs 4 μL,10 ng/μL基因特异引物2 μL,Taq DNA聚合酶0.25 μL,灭菌蒸馏水11.75 μL。PCR扩增程序为:95℃4 m in;4℃45 s,54/56/58/60℃45 s,72℃2 m in,30个循环;最后72℃10 m in。
将PCR产物采用1.5%琼脂糖凝胶电泳后,将目的片段进行回收、连接、转化、PCR菌液检测后送测序。
1.4 GmSBP2和GmSBPL基因生物信息学分析
在NCBI(http://www.ncbi.nlm.nih.gov/)上进行基因Blastx同源比对分析,通过ProtParam (http://www.expasy.ch/tools/protparam.htm L)对GmSBPL和GmSBP2基因编码的氨基酸序列的理化性质进行分析,利用TMHMM server v.2.0软件对该基因的跨膜螺旋区域进行分析。用DNA-MAN软件对GmSBP2和GmSBPL基因进行多序列比对和进化树分析,用SoftBerry亚细胞定位软件Prot-Comp 9.0在线分析GmSBPL和GmSBP2蛋白在细胞中的分布。
1.5 实时荧光定量PCR
以发育时期和高温高湿胁迫处理的cDNA为模板,根据获得的目的基因序列设计引物,以大豆actin基因作为对照,采用TaKaRa公司的SYBR Prem ix Ex TaqⅡ(Prefect real-time)试剂盒,Bio-RADiCycler实时荧光定量PCR仪进行扩增。采用2–ΔΔCT算法分析实验结果。
1.6 可溶性总糖、蔗糖含量测定
蒽酮硫酸法测定可溶性总糖,间苯二酚法测定蔗糖含量[23]。测定可溶性总糖时取发育时期及高温高湿胁迫处理的样品提取液0.1 m L加入5 m L蒽酮硫酸,90℃水浴15 m in,冷却后620 nm比色。测定蔗糖时取样品提取液0.1 m L加入0.1 m L NaOH,100℃水浴5 m in,冷却后加入3.5 m L 30%HCl和1 m L 0.1%间苯二酚摇匀,80℃水浴10 m in,冷却后480 nm比色。
1.7 Gm SBP2和Gm SBPL蛋白的亚细胞定位
为设计引物构建融合表达载体,在GmSBP2和GmSBPL基因特异引物上游和下游分别引入Eco RⅠ与Bam HⅠ的酶切位点(表1),从反转的cDNA中扩增出带有以上酶切位点的ORF片段,将片段从琼脂糖胶回收后连接pMD-19 (TaKaRa)载体上,然后以Eco RⅠ和Bam HⅠ对连接载体进行双酶切,凝胶电泳后回收片段与同样双酶切后线性化的pJIT166载体连接,获得绿色荧光蛋白与目的基因的融合蛋白表达载体。

表1 本研究所用的引物Tab le 1 PCR Prim ers used in this study
取一块长、宽大约4 cm的洋葱幼嫩表皮,在固体MS培养基上22℃培养3–4 h。采用PDS-1000/He基因枪(Bio-Rad)轰击洋葱表皮细胞,可裂膜压力为1 100 psi,轰击距离约为5 cm。轰击的洋葱表皮细胞于22℃培养箱中培养14–16 h,于激光共聚焦显微镜下(Leica,TCS SP2)观察GFP的表达定位。
2 结果与分析
2.1 目的基因Gm SBP2和GmSBPL的cDNA和DNA的分离及生物信息学分析
以种子田间劣变不抗品种宁镇1号和抗性品种湘豆3号cDNA为模板,利用特异引物GmSBP2-F/R和GmSBPL-F/R分离出大豆蔗糖结合蛋白基因GmSBP2和GmSBPL,两个基因cDNA序列在宁镇1号和湘豆3号两个品种间没有差异。测序结果同NCBI公布的GmSBP2 (AY234869.1)和GmSBPL(XM_003536582.1)基因进行比对发现在GmSBP2基因中有两个碱基不同(G→C,C→T),导致编码的蛋白中有两个氨基酸不同,GmSBPL基因中有4个碱基不同(A→T,C→A,A→T,A→G),编码的蛋白中两个氨基酸不同。
以湘豆3号叶片DNA为模板,进行PCR扩增,分别得到3 110 bp的GmSBPL基因DNA序列和3 637 bp的GmSBP2基因DNA序列。测序结果与所得GmSBP2和GmSBPL基因的cDNA序列一致。
通过对GmSBP2和GmSBPL基因的cDNA序列进行比对,发现GmSBP2包含由1 467 bp核苷酸组成的完整ORF,编码由489个氨基酸残基组成的蛋白质。GmSBPL包含由1 512 bp核苷酸组成的完整ORF,编码504个氨基酸残基组成的蛋白质。采用Softberry网站的ProtComp 9.0预测GmSBP2和GmSBPL基因氨基酸序列,结果表明两个基因编码的蛋白定位于细胞膜上。将比对获得的GmSBP相关基因提交到GenBank数据库,利用Mega 5.0软件进行多重序列比对和系统发育树构建。结果表明,Law rence等鉴定出的类豌豆球蛋白中高度保守的26个氨基酸残基[24]中GmSBP2和GmSBPL均出现23(88%)个。这些氨基酸残基已经被证明在维持蛋白三维结构中有重要作用。将GmSBP2蛋白和GmSBPL蛋白序列与不同植物的同源蛋白序列构建系统进化树,表明两个基因编码的蛋白与同属豆科的苜蓿和蚕豆的SBP蛋白亲缘关系最近。
2.2 GmSBP2和GmSBPL基因的表达模式分析
高温高湿胁迫下,种子田间劣变不抗品种宁镇1号和抗性品种湘豆3号发育种子中GmSBP2基因在不同胁迫时间点的表达量存在差异。胁迫处理0–48 h期间,相对于对照组,处理组宁镇1号和湘豆3号种子中GmSBP2基因表达量下降,但品种间基因表达量下降幅度不同。胁迫处理96–168 h,处理组宁镇1号和湘豆3号种子中GmSBP2基因表达量均上升(图1)。
在种子发育过程中,从花后15 d开始宁镇1号和湘豆3号种子中GmSBP2基因表达量整体呈现单峰变化(图2A)。为了明确GmSBP2基因在不同器官中的表达特征,检测了它在宁镇1号和湘豆3号各个主要器官中的转录水平。结果发现,GmSBP2基因在两个品种中的根、茎、叶、盛花期花、幼荚中均能检测到表达,其中在叶、盛花期花中两个品种表达量最高,在茎中表达量最少(图2B)。
高温高湿胁迫下,种子田间劣变抗性品种湘豆3号发育种子中GmSBPL基因表达量在0−96 h低于对照组表达量;在168 h时,GmSBPL基因表达量与对照表达量相近。不抗品种宁镇1号种子中在处理24 h时GmSBPL基因表达量低于对照组表达量,在处理48 h时GmSBPL基因表达量与对照组表达量一致,48 h后高于对照组的表达量(图3)。

图2 Gm SBP2基因的表达模式Fig.2 Expression verification of GmSBP2 gene.(A) The expression patterns of the GmSBP2 gene in developing seed of Ningzhen No.1 and Xiangdou No.3. (B)Real-time quantitative PCR analysis of GmSBP2 in different organs of Ningzhen No.1 and Xiangdou No.3. Vertical bars indicate±SE and values sharing a common letter are not significantly different at 0.05 level.

图3 高温高湿胁迫下Gm SBPL基因的表达Fig.3 Expression patterns of GmSBPL gene under high temperature and hum idity stress.Vertical bars indicate±SE and values sharing a common letter are not significantly different at 0.05 level.
在种子发育过程中,从花后15 d开始宁镇1号和湘豆3号种子中GmSBPL基因同GmSBP2基因表达量一样整体呈现单峰变化即先上升后下降(图4A)。GmSBPL基因在宁镇1号和湘豆3号两个品种中的根、茎、叶、盛花期花、幼荚中均能检测到表达,其中在叶、盛花期花中两个品种表达量最高,在根和茎中表达量最少(图4B)。 2.3蔗糖和可溶性糖含量变化
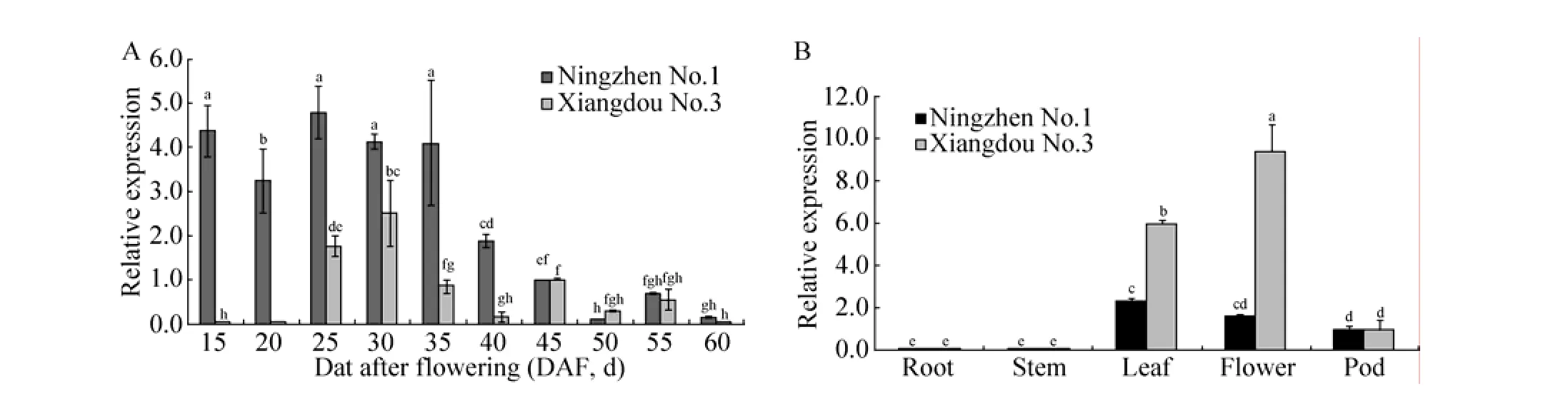
图4 Gm SBPL基因的表达模式Fig.4 Expression verification of GmSBPL gene.(A)The expression patterns of GmSBPL gene during seed development of Ningzhen No.1 and Xiangdou No.3.(B)Real-time quantitative PCR analysis of GmSBPL in different organs of Ningzhen No.1 and Xiangdou No.3.Vertical bars indicate±SE and values sharing a common letter are not significantly different at 0.05 level.
高温高湿处理期间,种子田间劣变不抗品种宁镇1号和抗性品种湘豆3号种子中蔗糖含量与对照相近,但在处理168 h时,宁镇1号种子中蔗糖含量高于对照,而湘豆3号种子中蔗糖含量低于对照(图5A)。在籽粒发育期间,宁镇1号和湘豆3号种子中蔗糖含量变化趋势相同。在花后30 d左右,种子中蔗糖含量达到最大,花后30–40 d期间,蔗糖含量有下降趋势,40 d后蔗糖含量基本趋于稳定(图5C)。可溶性糖含量与蔗糖含量变化趋势基本一致(图5B、D)。
2.4 Gm SBP2和Gm SBPL蛋白的亚细胞定位
采用基因枪将GmSBP2和GmSBPL基因亚细胞定位融合载体转入洋葱表皮细胞,用pJIT166表达载体作为对照。经过培养后,在激光共聚焦显微镜下观察,结果如图6,融合蛋白GmSBP2和GmSBPL主要定位在细胞膜和细胞核上,而不含目的基因的对照GFP蛋白分布在整个细胞中(图6)。

图5 蔗糖及可溶性糖含量变化Fig.5 Changes of sucrose and soluble sugar.(A)The level of sucrose in the developing seeds of Ningzhen No.1 and Xiangdou No.3 under high temperature and hum idity stress.(B)The level of soluble sugar in the developing seeds of Ningzhen No.1 and Xiangdou No.3 under high temperature and hum idity stress.(C)The level of sucrose during seed development of Ningzhen No.1 and Xiangdou No.3.(D)The level of soluble sugar during seed development of Ningzhen No.1 and Xiangdou No.3.Vertical bars indicate±SE and values sharing a common letter are not significantly different at 0.05 level.

图6 Gm SBP2:GFP和Gm SBPL:GFP在洋葱表皮细胞的亚定位Fig.6 Subcellular localization of the Gm SBP2:GFP and Gm SBPL:GFP proteins in onion epidermal cells.
3 讨论
蔗糖是光合作用的主要产物,蔗糖及其衍生物是大多数高等植物光合作用同化的碳的主要运输形式。源叶片中的蔗糖合成后装载入韧皮部中的筛管伴胞复合体(Sieve element companion cell complex,SECCC),再经过长距离运输到库器官[15,25]。在植物体中,蔗糖分子从源叶装载进入韧皮部及从韧皮部卸载进入库组织主要通过2种不同的途径来进行,即共质体途径和质外体途径[11]。质外体途径的装载需要依赖专一性的载体蛋白。蔗糖转运蛋白在蔗糖转运过程中起着极为重要的作用[12-14],同时也有研究证明蔗糖结合蛋白GmSBP也参与蔗糖的转运,例如在烟草细胞中抑制表达GmSBP,植物体表现出了与蔗糖转运受损时相同的表型[19-20]。通过将GmSBP在SBP转化酶缺失的酵母细胞内进行异源表达,结果发现酵母细胞可以在以蔗糖为唯一碳源的培养基上生长[21]。但蔗糖转运蛋白的其他功能没有被研究。植物在生长发育过程中会遇到各种非生物胁迫,如高温、干旱、冷害、盐害盐渍等,这些胁迫信号会诱导胞内蛋白质磷酸化的变化。蔗糖的质外体途径装载是蔗糖主动通过质膜装载在韧皮部的过程,依赖于H+-ATPase来提供能量[26],也就是说蛋白的磷酸化影响蔗糖结合蛋白的转运效率,间接调节了蔗糖的转运。
蔗糖是植物体内主要的糖成分,是植物体内普遍存在的小分子物质,能够以类似植物激素的方式作为一种信号分子存在,调控多种基因的表达[27]。本研究分离得到两个蔗糖结合蛋白基因GmSBP2和GmSBPL,生物信息学分析表明GmSBP2包含由1 467 bp核苷酸组成的完整ORF,编码由489个氨基酸残基组成的蛋白质。GmSBPL包含由1 512 bp核苷酸组成的完整ORF,编码504个氨基酸残基组成的蛋白质。采用Softberry网站的ProtComp 9.0预测GmSBP2和GmSBPL基因氨基酸序列,结果表明两个基因编码的蛋白定位于细胞膜上。将比对获得的GmSBP相关基因提交到GenBank数据库,利用Mega 5.0软件进行多重序列比对和系统发育树构建。结果表明,Law rence等鉴定出的类豌豆球蛋白中高度保守的26个氨基酸残基[24]中GmSBP2和GmSBPL均出现23(88%)个,属于贮藏蛋白家族。
本项目组前期通过对中国南方92份春大豆种子进行甲醇胁迫处理及温箱蚀化处理,鉴定出种子田间劣变抗性品种湘豆3号和不抗品种宁镇1号[28]。在此基础上本实验通过对目的基因GmSBP2和GmSBPL受高温高湿胁迫表达模式进行了分析,旨在探究其在大豆响应胁迫反应中的表现。相对于对照,高温高湿胁迫下GmSBP2和GmSBPL基因表达量在宁镇1号和湘豆3号大豆种子中呈差异表达,说明GmSBP2和GmSBPL基因可能参与了植物非生物胁迫的应答过程,并且在调节过程中存在着差异。
本研究中,与对照相比,高温高湿处理0–48 h期间种子田间劣变抗性品种湘豆3号种子中GmSBP2和GmSBPL基因表达量表现为下降;但随着胁迫处理时间的延长(96–168 h),GmSBP2基因表达量反而呈上升趋势,而GmSBPL基因表达量继续下降,直至在胁迫处理168 h时,与对照表达量相近。而高温高湿处理前期和中期,抗性品种湘豆3号种子中蔗糖含量与相应对照相近,但在处理168 h时,蔗糖含量显著低于对照。对于种子田间劣变不抗品种宁镇1号而言,其种子中GmSBP2和GmSBPL基因在胁迫处理0–48 h期间表达量相对于对照呈下降趋势,但在胁迫处理96–168 h期间表达量上升。而高温高湿处理前期和中期,不抗品种宁镇1号种子中蔗糖含量与相应对照相近,但在处理168 h时,宁镇1号种子中蔗糖含量显著高于对照。推测导致GmSBP2和GmSBPL基因表达与蔗糖含量之间这种状况可能是因为:1)GmSBP2和GmSBPL基因在品种间功能大小差异;2)蔗糖转化为蛋白、脂肪的能力存在品种间差异;3)蔗糖消耗存在品种间差异,这种消耗主要作为维持种子生长发育能量供应以抵御高温高湿胁迫。前期研究发现高温高湿胁迫处理会降低种子的发芽率及发芽势,使种子发生劣变,而抗性品种湘豆3号种子发芽势和发芽率下降幅度小于不抗品种宁镇1号种子的下降幅度[30]。但GmSBP2和GmSBPL基因表达以及蔗糖含量变化与湘豆3号和宁镇1号种子田间劣变程度之间关系还有待进一步研究。
在籽粒发育过程中,GmSBP2和GmSBPL基因在宁镇1号和湘豆3号种子中的表达量变化趋势大致相同,在30 d左右达到最大值,宁镇1号和湘豆3号种子中蔗糖和可溶性糖含量在30 d左右也达到最大。组织特异性分析表明GmSBP2和GmSBPL基因在宁镇1号和湘豆3号两个品种中的根、茎、叶、盛花期花、幼荚中均能检测到表达,其中在叶、盛花期花中两个品种表达量最高,在茎中表达量最少。幼叶、幼荚均能进行光合作用合成蔗糖,对应蔗糖结合蛋白GmSBP2和GmSBPL基因表达量也高[31]。亚细胞定位结果显示GmSBP2和GmSBPL基因编码的蛋白主要定位在细胞膜和细胞质中,这表明GmSBP2和GmSBPL基因编码的产物可能在细胞膜和细胞质中行使其功能。
总之,大豆劣变性和抗劣变性是由多基因调控的复杂途径,本文通过对GmSBP2和GmSBPL基因的特征、亚细胞定位及对非生物胁迫的响应分析,以从一个侧面丰富对其的认识。
REFERENCES
[1]Delouche JC.Precepts of seed storage.Proceedings of the M ississippi State Seed Processors Shortcourse,1973:93–122.
[2]Dhakal MR,Pandey AK.Storage potential of niger (Guizotia abyssinica Cass.)seeds under ambient conditions.Seed Sci Technol,2001,29:205–213.
[3]Tang SD,Hang MZ,Cheng JL.A study on seed deterioration in spring soybeans.Soybean Sci,1994, 13(3):230–236(in Chinese).唐善德,黄敏珍,成金莲.春大豆种子劣变的研究.大豆科学,1994,13(3):230–236.
[4]M cDonald MB.Seed deterioration:physiology, repair and assessment.Seed Sci Technol,1999, 177–237.
[5]Smeekens S.Sugar-induced signal transduction in plants.Ann Rev Plant Biol,2000,51(1):49–81.
[6]Etxeberria E,Baroja-Fernandez E,Muñoz FG,et al. Sucrose-inducible endocytosis as a mechanism for nutrient uptake in heterotrophic plant cells.Plant Cell Physiol,2005,46(3):474–481.
[7]Lemoine R,Bfirkle L,Sakr S,et al.Identification of a pollen-specific sucros transporter-like protein NtSUT3 from tobacco.FEBS Lett,1999,454(3): 325–330.
[8]Roitsch,T.Source-sink regulation by sugar and stress.Curr Opin Plant Biol,1999,2:198–206.
[9]Ehness R,Ecker M,Godt DE,et al.Glucose and stress independently regulate source and sink metabolism and defense mechanisms via signal transduction pathways involving protein phosphorylation.Plant Cell,1997,9:1825–1841.
[10]Qi HY,Jiang YY,Hua LJ.Responses to short-term low night temperature of sucrose-metabolizing in domesticated tomato and w ild relative.Acta Horticul Sin,2012,39(2):281–288(in Chinese).齐红岩,姜岩岩,华利静.短期夜间低温对栽培番茄和野生番茄果实蔗糖代谢的影响.园艺学报, 2012,39(2):281–288.
[11]Truernit E.Plant physiology:the importance of sucrose transporters.Curr Biol,2001,11(5): R169–R171.
[12]W illiams LE,Lemoine R,Sauer N.Sugar transporters in higher plants-a diversity of roles and complex regulation.Trends Plant Sci,2000,5(7): 283–290.
[13]Li M,Yang S,Ruan YY,et al.Identification of atsuc3 w ith T-DNA Insertion by PCR.Plant Physiol Commun,2006,42(1):91–94(in Chinese).李敏,杨双,燕晔,等.拟南芥T-DNA插入突变体atsuc3的PCR鉴定.植物生理学通讯,2006, 42(1):91–94.
[14]Yang CJ,Hao DH,Yang SX,et al.Sucrosetransporters in higher plants.Plant Physiol Commun, 2006,42(4):767–776(in Chinese).杨彩菊,郝大海,杨素祥,等.高等植物中的蔗糖载体.植物生理学通讯,2006,42(4):767–776.
[15]Card PJ,Hitz WD,Ripp KG.Chemoenzymatic synthesis of fructose-modified sucroses via multienzyme systems.Some topographical aspects of the binding of sucrose to sucrose carrier protein.J Amer Chem Soc,1986,108:158–161.
[16]Ripp KG,Vlltanen PV,Hitz WD,et al.Identification of a membrane protein associated w ith sucrose transport into cells of developing soybean cotyledons.Plant Physiol,1988,88:1435–1445.
[17]Rocha CS,Luz DF,Oliveiraa ML,et al.Expression of the sucrose binding protein from soybean: renaturation and stability of the recombinant protein. Phytochem istry,2007,68(6):802–810.
[18]Ripp KG,Viitanen PV,Hitz WD,et al.Identification of membrane protein associated w ith sucrose transport into cells of developing soybean cotyledons.Plant Physiol,1988,88(4):1435–1445.
[19]Riesmeier JW,W illmitzer L,Frommer WB. Evidence for an essential role of the sucrose transporter in phloem loading and assimilate partitioning.EMBO J,1994,13(1):1–7.
[20]Kühn C,Quick WP,Schulz A,et al.Companion cell-specific inhibition of the potato sucrose transporter SUT1.Plant Cell Environ,1996,19(10): 1115–1123.
[21]Grimes HD,Overvoorde PJ.Functional characterization of sucrose binding proteinmediated sucrose uptake in yeast.J Experi Bot, 1996,47:1217–1222.
[22]Wang LQ,Ma H,Song LR,et al.Comparative proteomics analysis reveals the mechanism of pre-harvest seed deterioration of soybean under high temperature and humidity stress.J Proteom,2012, 75:2109–2127.
[23]Gao JF.Experimental Guidance for Plant Physiology.Beijing:Higher Education Press,2006: 214–215(in Chinese).高俊凤.植物生理学实验指导.北京:高等教育出版社,2006:214–215.
[24]Law rence MC,Izard T,Beuchat M,et al.Structure of phaseolin at 2.2 Å resolution:implications for a common vicilin/legumin structure and the genetic engineering of seed storage proteins.J M ol Biol, 1994,238(5):748–776.
[25]Grimes HD,Overvoorde PJ,Ripp K,et al.A 62-kD sucrose binding protein is expressed and localized in tissues actively engaged in sucrose transport.Plant Cell,1992,4(12):1561–1574.
[26]Lemoine R.Sucrose transporters in plants:update on function and structure.Biophys Acta (BBA)-Biomemb,2000,1465(1):246–262.
[27]Guan Y,Ren H,Xie H,et al.Identi f i cation and characterization of bZIP-type transcription factors involved in carrot(Daucus carota L.)somatic embryogenesis.Plant J,2009,60:207–217.
[28]Wang F,Wang LQ,Tian X,et al.Pre-harvest and post-harvest seed deterioration resistance of spring soybean germplasm in South China.Sci Agri Sin, 2007,40(11):2637–2647(in Chinese).王芳,王丽群,田鑫,等.中国南方春大豆收获前后种子劣变的抗性研究.中国农业科学,2007, 40(11):2637–2647.
[29]Ma CM,Guo HL,Gong ZP,et al.Dynamic changes of sucrose synthase in leaves among different soybean genotypes.Crops,2010,4:65–69(in Chinese).马春梅,郭海龙,龚振平,等.不同基因型大豆糖分积累规律的研究.作物杂志,2010,4:65–69.
[30]Shu YJ,Zhou CL,Tao Y,et al.Effect of simulated pre-harvest deterioration stress on plant grow th and seed vigor of spring soybean at physiological maturity stage.Soybean Sci,2003,5:636–639(in Chinese).舒英杰,周春丽,陶源,等.模拟田间劣变对生理成熟期春大豆植株生长及种子活力的影响.大豆科学,2013,5:636–639.
[31]Freitas RL,Carvalho CM,Fietto LG,et al.Distinct repressing modules on the distal region of the SBP2 promoter contribute to its vascular tissue-specific expression in different vegetative organs.Plant Mol Biol,2007,65:603–614.
(本文责编 郝丽芳)
Characterization and subcellular localization of two SBP genes and their response to abiotic stress in soybean (Glycine max(L.)M err.)
Yan Yang,Shuang Wang,Liyan Huang,Hongyu M a,Yingjie Shu,Xiaoling He,and Hao M a
State Key Laboratory of Crop Genetics and Germplasm Enhancement,Nanjing Agricultural University,Nanjing 210095,Jiangsu,China
High temperature and hum idity stress during seed grow th and development of spring soybean can result in seed deterioration in South China.We isolated two genes(GmSBP and GmSBPL)encoding putative SBP proteins from soybean (Glycine max(L.)Merr.)to study their biological functions and response to abiotic stress,.The two SBP proteins are hydrophilic and incomplete membrane ones.Real-time quantitative(RT-PCR)analysis reveals that the expression of the two genes in the developing seeds of the seed deterioration resistant cultivar Xiangdou No.3 and sensitive cultivar Ningzhen No.1 was significantly affected by high temperature and hum idity treatment.Meanwhile,the levels of sucrose and soluble sugar in the developing seeds of both cultivars were also affected under high temperature and hum idity stress. During seed grow th and development,the expression of the two genes as well as the levels of sucrose and soluble sugar reached the highest at 30 days after flower.GmSBP2 and GmSBPL were found to be differentially expressed in different soybean tissues.Sub-cellular localization indicated that two genes were located in cytoplasm and cell membrane.Our results indicate that GmSBP2 and GmSBPL m ight be involved in the response to abiotic stress,which w ill enrich our understanding of pre-harvest seed deterioration and resistance in soybean from one side.
soybean,SBP protein,gene isolation,expression analysis,subcellular localization
March 5,2014;Accep ted:May 12,2014
Hao Ma.Tel/Fax:+86-25-84395324;E-mail:Lq-ncsi@njau.edu.cn
杨艳,王爽,黄丽燕,等.两个大豆GmSBP基因的特征、亚细胞定位及对非生物胁迫的响应.生物工程学报,2014, 30(11):1709−1719.
Yang Y,Wang S,Huang LY,et al.Characterization and subcellular localization of two SBP genes and their response to abiotic stress in soybean(Glycine max(L.)Merr.).Chin J Biotech,2014,30(11):1709−1719.
Suppo rted by:National Natural Science Foundation of China(Nos.30971840,31171572,31371711),The Research Fund for the Dectoral Program of Higher Education(Nos.20100097110030,20120097110025),the Shanghai Comm ittee of Agriculture,China(No.Hu 2013,No.1-2).
国家自然科学基金(Nos.30971840,31171572,31371711),教育部高等学校博士学科点专项科研基金(Nos.20100097110030, 20120097110025),上海市科技兴农推广项目(No.Hu 2013,No.1-2)资助。
时间:2014-05-20网络出版地址:http://www.cnki.net/kcms/doi/10.13345/j.cjb.140136.htm l
