大孔树脂吸附与反相色谱纯化恩拉霉素
2014-06-24吴家鑫黄永东齐鹏何继红李萍张国栋赵梅仙
吴家鑫,黄永东,齐鹏,何继红,李萍,张国栋,赵梅仙
1中牧实业股份有限公司,北京100095 2农业部兽用生物制品与化学药品重点实验室,北京100095 3北京市兽用多肽疫苗设计与制备工程技术研究中心,北京100095 4中国牧工商(集团)总公司,北京100095 5中国科学院过程工程研究所生化工程国家重点实验室,北京100190
大孔树脂吸附与反相色谱纯化恩拉霉素
吴家鑫1,2,3,4,黄永东5,齐鹏1,2,3,4,何继红1,2,3,4,李萍5,张国栋1,2,3,4,赵梅仙1,2,3,4
1中牧实业股份有限公司,北京100095 2农业部兽用生物制品与化学药品重点实验室,北京100095 3北京市兽用多肽疫苗设计与制备工程技术研究中心,北京100095 4中国牧工商(集团)总公司,北京100095 5中国科学院过程工程研究所生化工程国家重点实验室,北京100190
恩拉霉素作为多肽类抗生素,是一种新型、安全的饲料添加剂。本文建立了一条基于大孔树脂初纯和反相色谱精制的分离纯化工艺。该工艺路线首先使用AB-8大孔树脂在0.012 mol/L盐酸溶液-甲醇(50:50,V/V)缓冲液条件下洗脱实现恩拉霉素初步纯化,再使用制备型C18反相色谱柱在0.05 mol/L磷酸二氢钠-乙腈(70:30,V/V)(pH 4.5)缓冲液洗脱下实现恩拉霉素a和b的有效分离,a、b两个组分纯度分别达到98.5%和98.0%,a和b两种有效成分的总收率为29.2%。本研究为恩拉霉素a和b两种纯品的制备以及高纯度恩拉霉素产品的生产提供了参考。
恩拉霉素,大孔吸附树脂,反相色谱,纯化
恩拉霉素(Enramycin),又名恩来霉素、安来霉素、持久霉素,是由放线菌Streptomyces fungicidious No.B5477发酵产生的一种多肽类抗生素,主要成分为恩拉霉素a和b[1-4]。恩拉霉素于1966年由日本武田药品工业株式会社开发,1993年在我国注册。恩拉霉素对革兰氏阳性菌具有很强的抑制作用,不易产生抗药性,能够改变肠道内的细菌菌落分布,有利于饲料营养成分的消化吸收,具有很好的促生长效果,是一种专用的抗生素类饲料添加剂[5-9]。
恩拉霉素的发酵过程是一个复杂的微生物代谢过程,副产物众多[10-12],因此恩拉霉素的分离纯化工艺较为复杂。现有的恩拉霉素分离纯化方法主要包括有Amberlite XAD-2大孔树脂[13]、高速逆流色谱[14]、AB-8大孔树脂吸附和分子筛相结合的方法[15]等,上述方法得到的产品纯度还有待于进一步提高,而且上述方法得到的产品多是恩拉霉素a和b的混合物。大孔树脂与反相制备色谱作为常见的分离纯化方法在生化分离领域应用较为广泛[16-20]。
本论文建立了一条大孔树脂初纯化和反相色谱精制的分离纯化工艺,从甲醇-盐酸溶液提取的恩拉霉素提取液中纯化得到高纯度的恩拉霉素a和b两种有效成分,为恩拉霉素的检测和高纯度恩拉霉素产品的制备奠定了基础。
1 材料与方法
1.1 材料与仪器
菌丝体由内蒙古中牧生物药业有限公司提供,其他试剂均为购置的国产分析纯试剂。
ÄKTA Explorer 10层析系统购自GE Healthcare(美国);LC-2012A高效液相色谱仪购自岛津公司;MALDI-TOF质谱仪VOYAGERDE-STR购自美国应用生物系统公司(ABI);大孔树脂AB-8购自天津南开允公合成技术有限公司;大孔树脂HZ-830购自上海华震科技有限公司;C18反相制备柱(20 cm×3.6 cm I.D)购自北京创新通恒科技有限公司。
1.2 方法
1.2.1 恩拉霉素提取
取菌丝体500 g,加入甲醇2.5 L,使用1 mol/L的盐酸溶液调节pH值至3,超声振荡2 h,3 000 r/m in离心30 m in,取上层清液。
1.2.2 大孔树脂初分离
条件探索实验1:HZ-830大孔树脂用缓冲液A(甲醇-水溶液(50:50,V/V),pH 8.0)浸泡1 d后,转移到玻璃层析柱(20.0 cm×1.0 cm I.D.)上,装成10 cm床层高度的大孔树脂层析柱(10.0 cm×1.0 cm I.D.)。用平衡缓冲液A平衡5个柱体积后进料8 m L(原料预处理后所得的上清液,上样量约为10 mg/m L树脂),继续用缓冲液A淋洗至基线,再利用缓冲液A与缓冲液B(甲醇-水溶液(70:30,V/V),pH 2.5)的混合溶剂进行洗脱,分别采用30%、60%和100%缓冲液B梯度洗脱,收集穿透峰和各个洗脱峰。流速为0.5 m L/m in,检测波长为267 nm。
条件探索实验2:AB-8大孔树脂用缓冲液C(1.0%NaCl水溶液-甲醇(50:50,V/V))浸泡1 d后,转移到玻璃层析柱(20.0 cm×1.0 cm I.D.)上,装成10 cm床层高度的大孔树脂层析柱(10.0 cm×1.0 cm I.D.)。用平衡缓冲液C平衡5个柱体积后进料8 m L(原料预处理后所得的上清液,上样量约为10 mg/m L树脂),继续用缓冲液C淋洗至基线,再利用缓冲液C与缓冲液D(0.012 mol/L HCl溶液-甲醇(50∶50,V/V))的混合溶剂进行洗脱,分别采用20%、30%、40%和100%缓冲液D梯度洗脱,收集穿透峰和各个洗脱峰。流速为0.5 m L/m in,检测波长为267 nm。
AB-8树脂分离纯化实验:AB-8大孔树脂用缓冲液C浸泡1 d后,转移到玻璃层析柱(40.0 cm× 3.6 cm I.D.)上,装成30 cm床层高度的大孔树脂层析柱(30.0 cm×3.6 cm I.D.)。用平衡缓冲液C平衡5个柱体积后进料500 m L(原料预处理后所得的上清液,上样量约为10 mg/m L树脂),继续用缓冲液C淋洗至基线,然后采用缓冲液D洗脱,收集穿透峰和洗脱峰。流速为10 m L/m in,检测波长为267 nm。
1.2.3 反相色谱精制
大孔树脂初分离得到的目标组分进一步用制备型C18反相色谱柱(20.0 cm×3.6 cm I.D.,5 μm粒径)进行精制提纯。反相色谱柱用缓冲液E (0.05 mol/L磷酸二氢钠-乙腈,70:30,V/V,pH 4.5)平衡后上样50 m L,继续洗脱至出峰完全(总共约洗脱1 200 m L)。流速为10.0 m L/m in,检测波长为267 nm。
1.2.4 恩拉霉素检测分析
利用高效液相方法检测恩拉霉素[21]。
1.2.5 基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-M S)检测分析
脉冲氮激光(337 nm)作为离子解吸电离源。分析模型使用延迟引出和线性模型,激光强度恒定为3 558,加速电压控制在20 000 V,延迟时间为700 ns。每个样品点的激光脉冲次数为50次。
2 结果与讨论
2.1 恩拉霉素的提取
按照“1.2.1”所描述的方法提取恩拉霉素。甲醇提取的恩拉霉素提取液用C18反相色谱柱分析,分析结果如图1所示。提取液中恩拉霉素a的出峰时间约为9 min;恩拉霉素b的出峰时间约为14 min。利用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)对提取液进行检测,谱图如图2所示,主要成分的分子量分别为2 357.08 Da与2 370.51 Da,与文献中恩拉霉素a、b的分子量2 358 Da、2 370 Da基本一致[14],这表明提取液含有大量的恩拉霉素a和b两种目标物。
2.2 大孔树脂初分离条件摸索
2.2.1 不同大孔树脂对恩拉霉素分离效果的影响
按照“1.2.2”所示的条件探索实验1操作条件,采用HZ-830大孔树脂对恩拉霉素提取液进行初分离,分离纯化的谱图如图3所示。从图3可以看出,采用30%、60%和100%缓冲液B洗脱得到3个洗脱峰,分别标记为P1、P2和P3。对3个洗脱峰(P1、P2和P3)进行C18反相色谱柱分析,上述洗脱峰均没有目标产物恩拉霉素a和b,这表明HZ-830大孔树脂未能实现恩拉霉素提取液的有效吸附和对目标产物的有效纯化。
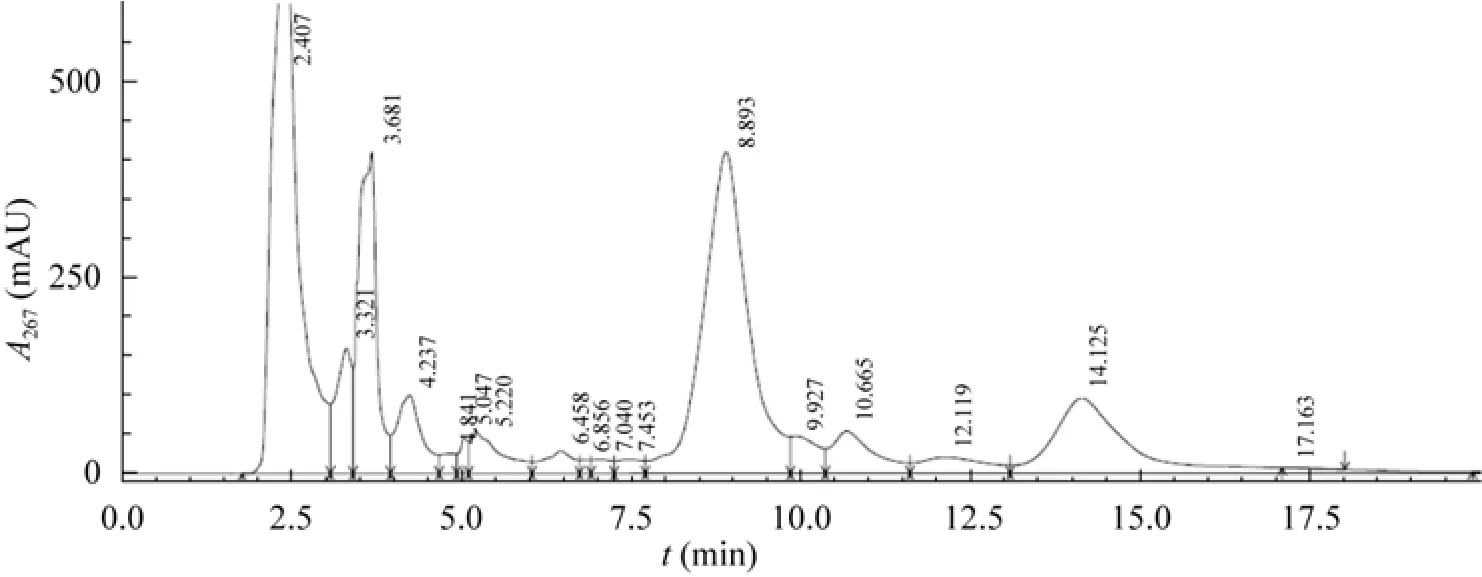
图1 恩拉霉素提取液反相色谱分析谱图Fig.1 Chromatography profile of enramycin extract.
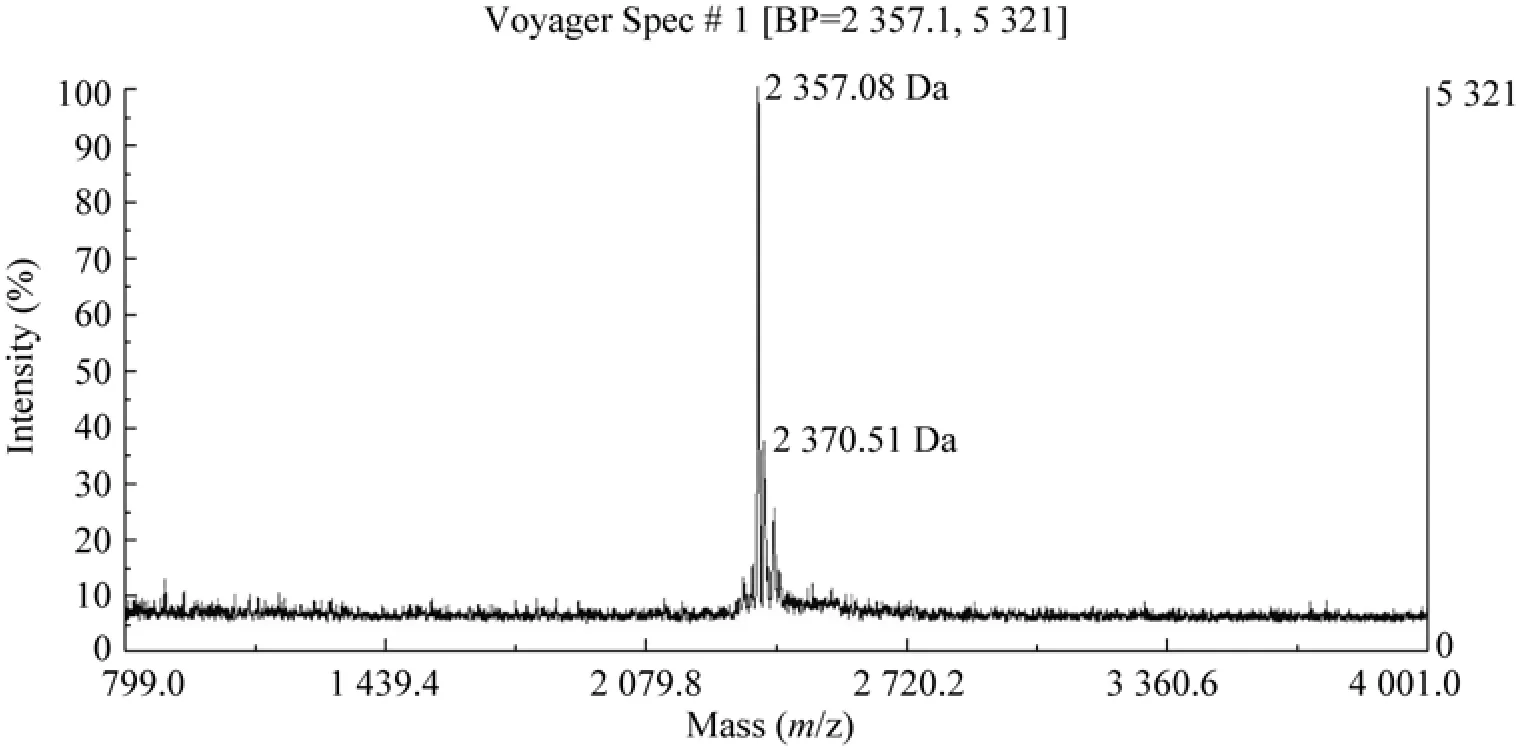
图2 恩拉霉素提取液基质辅助激光解吸电离飞行时间质谱谱图Fig.2 M atrix-assisted laser desorption/ionization time of flight(MALDI-TOF)mass spectrum of enramycin extract.

图3 恩拉霉素提取液的HZ-830大孔树脂分离条件优化谱图Fig.3 Optim ization of enramycin extract using HZ-830 macroporous adsorption resin.
按照“1.2.2”所示的条件探索实验2操作条件,采用AB-8大孔树脂对恩拉霉素提取液进行初分离,分离纯化的谱图如图4所示。从图4可以看出,除穿透峰P0外,采用20%、30%、40%和100%缓冲液D洗脱得到4个洗脱峰,标记为P1、P2、P3、P4。分别采用C18反相色谱柱对穿透峰P0和洗脱峰P1、P3、P4(P2峰太小,未进一步检测))进行分析,只有洗脱峰P4含有目标产物恩拉霉素a和b。表明AB-8大孔树脂在含0.006 mol/L HCl 50%甲醇-水溶液洗脱条件下可以实现恩拉霉素提取液的有效纯化。
2.2.2 AB-8大孔树脂吸附分离纯化
在确认了选用AB-8大孔树脂和合适的分离纯化条件后,进行了大孔树脂吸附的分离纯化,具体操作条件如“1.2.2”AB-8树脂分离纯化实验所示。分离纯化谱图如图5所示,P0属于穿透峰,P1为100%缓冲液D的洗脱峰,P1洗脱峰制备的样品纯度与条件摸索实验基本一致。利用AB-8大孔树脂去除掉恩拉霉素提取液中的大部分杂质,为制备型C18反相色谱的继续纯化进行准备。
2.3 恩拉霉素的精制
在大孔树脂初分离的基础上,只得到了恩拉霉素a和b的混合物,并且产品中还含有少量杂质。为了进一步提高产品纯度,并将恩拉霉素a和b组分分开,实现恩拉霉素a和恩拉霉素b纯品的制备,进一步采用制备型C18反相色谱柱对初分离的恩拉霉素样品进行精制。制备型反相色谱的具体操作条件如“1.2.3”所示,分离纯化谱图如图6所示。采用分段接样的方式(10 m L/管)收集缓冲液E洗脱峰P1、P2和P3,并采用反相色谱对其纯度进行分析,结果表明从658−806 m L收集的P2峰含有纯度高达98.5%的恩拉霉素a,从906−952 m L收集的P3含有纯度高达98.0%的恩拉霉素b(图7),恩拉霉素a与b两种有效成分的总收率为29.2%。前人使用大孔树脂分离纯化恩拉霉素不能将恩拉霉素a和b两种有效成分分开,且分离纯度也仅为95%左右[15];使用高速逆流色谱对恩拉霉素进行分离虽然可以将恩拉霉素a和b两种有效成分进行分离,但是纯度也仅为95%以上[14]。本文利用大孔树脂(AB-8大孔树脂)和反相色谱(C18反相填料)相结合的分离纯化工艺有效解决了前人研究中存在的缺陷。
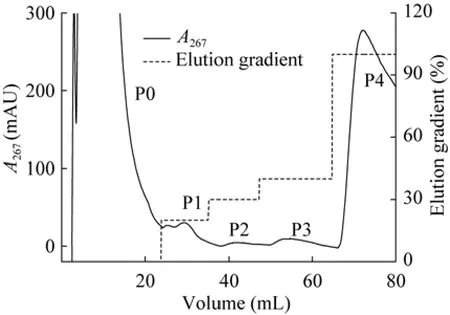
图4 恩拉霉素提取液的AB-8大孔树脂分离条件优化谱图Fig.4 Optim ization of enramycin extract using AB-8 macroporous adsorption resin.
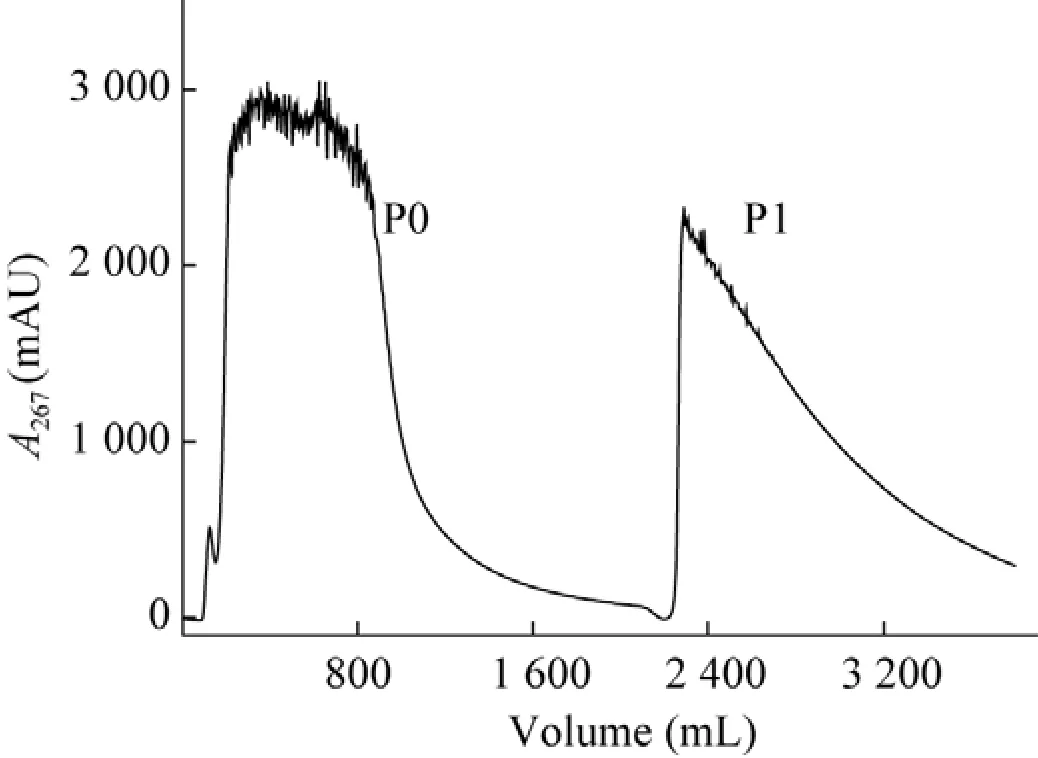
图5恩拉霉素提取液的AB-8大孔树脂分离谱图Fig.5 Chromatography profile of enramycin extract using AB-8 macroporous adsorption resin.

图7 制备型反相色谱洗脱组分的反相色谱分析谱图Fig.7 Reverse phase chromatography profiles of enramycin eluted from preparative C18 reverse phase chromatography.(A)Enramycin a.(B)Enramycin b.
3 结论
恩拉霉素是一种重要的多肽抗生素,广泛用作动物饲料添加剂,恩拉霉素的主要成分为恩拉霉素a和恩拉霉素b。针对恩拉霉素产品纯度低、恩拉霉素a和恩拉霉素b无法得到有效分离的问题,本研究开发了一条包括大孔树脂(AB-8大孔树脂)初纯和反相色谱(C18反相填料)精制的分离纯化工艺,分离纯化得到2种高纯度的恩拉霉素关键组分:恩拉霉素a和恩拉霉素b。该工艺路线首先使用AB-8大孔树脂在0.012 mol/L盐酸溶液-甲醇(50:50,V/V)缓冲液条件下洗脱实现恩拉霉素初步纯化,再使用制备型C18反相色谱柱在0.05 mol/L磷酸二氢钠-乙腈(70:30,V/V)(pH 4.5)缓冲液洗脱下实现恩拉霉素a和b的有效分离,a、b两个组分纯度分别达到98.5%和98.0%,a和b两种有效成分的总收率为29.2%,该纯度高于现有的分离纯化方法,为恩拉霉素的分析检测以及高纯度恩拉霉素产品的开发奠定了坚实的基础。
REFERENCES
[1]Higashide E,Hatano K,Shibata M.Enramycin,a new antibiotic.Ⅰ.Streptomyces fungicidicus No. B5477,an enramycin producing organism.J Antibiot,1968,21(2):126−137.
[2]Asai M,M uroi M,Sugita N,et al.Enramycin,a new antibiotic.Ⅱ.Streptomyces fungicidicus No. B5477,an enramycin producing organism.J Antibiot,1968,21(2):138−146.
[3]Goto S,Kuwabara S,Okubo N,et al.In vitro and in vivo evaluation of enduracidin,a new peptide antibiotic substance.JAntibiot,1968,21(2):119−125.
[4]Kawakam i M,Nagai Y,Fujii T,et al.Anti-m icrobial activites of enduractidin in vitro and in vivo.J Antibiot,1971,24(9):583−586.
[5]Pedroso AA,Menten JF,Lambais MR,et al. Intestinal bacterial community and grow th performance of chickens fed diets containing antibiotics.Poult Sci,2006,85(4):747−752.
[6]Li HF,Gao XJ,Bai LJ,et al.Rapid selection of high yield enramycin.Chin J Vet Drug,2012, 46(5):40−42(in Chinese).李慧芬,高先军,柏莉娟,等.恩拉霉素高产菌株的快速选育.中国兽药杂志,2012,46(5):40−42.
[7]Fang X,Tiyanont K,Zhang Y,et al.The mechanism of action of ramoplanin and enduracidin.M ol Biosyst,2006,2(1):69−76.
[8]Naqi SA,Cook J,Sahin N.Distribution of immunoglobul in-bearing cells in the gut-associated lymphoid tissues of the turkey: effect of oral treatment w ith intestinal m icroflora. Am J Vet Res,1984,45(16):2193−2195.
[9]Cook J,Naqi SA,Sahin N,et al.Distribution of immunoglobul in-bearing cells in the gut-associated lymphoid tissues of the turkey: effect of antibiotics.Am J Vet Res,1984,45(10): 2189−2192.
[10]Jin P.Screening of enramycin producing strain and optim ization of fermentation conditions[D]. Hangzhou:Zhejiang Gongshang University,2011 (in Chinese).金萍.恩拉霉素生产菌的选育及其发酵条件优化[D].杭州:浙江工商大学,2011.
[11]Kazunori H,Ikuo N,Eiji H,et al.Biosynthesis of enduracidin:origin of enduracididine and other am ino acid.Agric Biol Chem,1984,48(6): 1503−1508.
[12]Nogam i I,Shirafuji H,Matsumura S.Production of enduracidin and m icroorganisms therefor:US, 4465771.1984-08-14.
[13]Hori M.Enduracidin,a new antibiotic.Ⅵ. separation and determ ination of enduracidins A and B by column chromatography.Chem Pharm Bull,1973,21(6):1171−1174.
[14]Inoue K,Hattori Y,Hino T,et al.An approach to on-line electrospray mass spectrometric detection of polypeptide antibiotics of enramycin for high-speed counter-current chromatographic separation.J Pharm Biomed Anal,2010,51(5): 1154−1160.
[15]Wang DD,Yang WG,Hu YH,et al.Separation and purification of enramycin by macroporous resins.Food Ferment Ind,2012,36(4):194−197 (in Chinese).王丹丹,杨文革,胡永红,等.大孔树脂分离纯化持久霉素.食品与发酵工业,2010,36(4): 194−197.
[16]Zhao P,Zhang YP,Ren P.Adsorption process of proanthocyanidins in AB-8 macroporous resin.J Chem Ind Eng(China),2013,64(3):980−985(in Chinese).赵平,张月萍,任鹏.AB-8大孔树脂对葡萄籽原花青素的吸附过程.化工学报,2013,64(3): 980−985.
[17]Yang KD,Li H,Ge L,et al.Enrichment of astragalosides from Yupingfeng compound w ith AB-8 resin adsorption.J Chem Eng Chin Univ, 2008,22(1):147−151(in Chinese).杨克迪,李宏,葛利,等.AB-8树脂吸附富集玉屏风复方中黄芪皂苷类成分.高校化学工程学报,2008,22(1):147−151.
[18]Ding K,Cui Y,Lu JJ,et al.Study on purification of total triterpenoid saponins in Zizyphi spinosi semen by using SP700 macroporous resin.Ion Exc Adsorpt,2011,27(1):33−42(in Chinese).丁轲,崔莹,陆晶晶,等.SP700大孔树脂纯化酸枣仁中三萜总皂苷的研究.离子交换与吸附, 2011,27(1):33−42.
[19]Liu XB,Luan HW,Ge GB,et al.Industrial preparative chromatography purification of 10-deacetylpaclitaxel,the enzymatic product of 7-xylosyl-10-deacetylpaclitaxel.Chin J Chromatogr,2012,30(2):165−169(in Chinese).刘兴宝,栾宏伟,葛广波,等.工业色谱法分离制备7-木糖基-10-去乙酰紫杉醇酶解产物10-去乙酰紫杉醇.色谱,2012,30(2):165−169.
[20]Guo ZX,Ruan LG,Li H,et al.Isolation,purification and structure determ ination of glycopeptide antibiotics N-methylaglucovancomycin.Chin J Antibiot,2010,35(4):281−285(in Chinese).郭兆霞,阮林高,李航,等.糖肽类抗生素N-甲基无糖万古霉素的分离、纯化和结构鉴定.中国抗生素杂志,2010,35(4):281−285.
[21]Horie M,Hoshino Y,Nose N,et al.Determ ination of enramycin in chicken and sw ine muscles by high performance liquid chromatography.J Food Hyg Soc Jpn,1985,26(4):337−342.
(本文责编 陈宏宇)
Purification of enram ycin by macroporous resin adsorption and reversed phase chromatography purification
Jiaxin W u1,2,3,4,Yongdong Huang5,Peng Qi1,2,3,4,Jihong He1,2,3,4,Ping Li5, Guodong Zhang1,2,3,4,and M eixian Zhao1,2,3,4
1 China Animal Husbandry Industry Co.,Ltd,Beijing 100095,China
2 Key Laboratory of Biological Products and Chemical Drugs for Animals,M inistry of Agriculture,Beijing 100095,China 3 Beijing Engineering Research Center of Design and Development of Synthetic Peptide Vaccines for Animals,Beijing 100095,China 4 China Animal Husbandry Group,Beijing 100095,China 5 National Key Laboratory of Biochemical Engineering,Institute of Process Engineering,Chinese Academy of Sciences,Beijing 100190,China
Enramycin is a polypeptide antibiotic and new,safe animal feed additive.A new purification process was developed,based on pre-purification by macroporous resin and refining by reversed phase chromatography.AB-8 macroporous resin was used for the pre-purification process of enramycin,w ith an elution buffer of 0.012 mol/L aqueous HCl solution-methanol(50:50,V/V).Then,enramycin a and enramycin b were separated effectively by C18 reversed phase chromatography,w ith a elution buffer of 0.05 mol/L aqueous KH2PO4solution-acetonitrile(70:30,V/V,pH 4.5).The purities of enramycin a and enramycin b were up to 98.5%and 98.0%,respectively.The yield reached 29.2%.This study would provide a useful reference for the preparation of enramycin a and enramycin b w ith ahigh purity.
enramycin,macroporous adsorption resin,reverse-phase chromatography,purification
February 12,2014;Accep ted:April 25,2014
吴家鑫,黄永东,齐鹏,等.大孔树脂吸附与反相色谱纯化恩拉霉素.生物工程学报,2014,30(11):1701–1708.
Wu JX,Huang YD,Qi P,et al.Purification of enram ycin by macroporous resin adsorption and reversed phase chromatography purification.Chin J Biotech,2014,30(11):1701–1708.
Suppo rted by:National High Technology Research and Development Program of China(863 Program)(No.2011AA 10A214). Corresponding autho r:Yongdong Huang.Tel:+86-10-82544987;E-mail:ydhuang@home.ipe.ac.cn Peng Qi.Tel:+86-10-56518199;E-mail:cahic_ivd@163.net
国家高技术研究发展计划(863计划)(No.2011AA10A214)资助。
