L-亮氨酸产生菌的代谢工程改造及其发酵效率
2014-06-13黄钦耿
黄钦耿
(1. 福建省麦丹生物集团有限公司福州研究中心,福建 福州 350008;2. 福建师范大学工业微生物发酵技术国家地方联合工程研究中心,福建 福州 350107)
L-亮氨酸为哺乳动物8种必需氨基酸之一,广泛应用于食品、饲料、医药等行业,市场需求量逐年增多[1]。迄今为止,L-亮氨酸工程菌株主要有大肠杆菌和棒状杆菌。其中以谷氨酸棒杆菌和黄色短杆菌为出发菌株的研究最多[2]。谷氨酸棒杆菌是一类重要的工业氨基酸生产菌株,已成为一个工业生物技术及转化的平台菌株,每年生产数百万吨的氨基酸[3],其中包括作为风味增强剂的L-谷氨酸(350万吨/年)和作为饲料和食品添加剂的L-赖氨酸(250万吨/年)等[3]。谷氨酸棒杆菌在氨基酸的发酵方面,除了L-谷氨酸和L-赖氨酸这类大宗氨基酸之外,还包括许多的小品种氨基酸,如三类支链氨基酸(branched-chain amino acid,BCAAs):L-缬氨酸、L-异亮氨酸及L-亮氨酸[4-6],其每年需求量约在1000~3000吨,其中L-亮氨酸的需求量约在500~800吨/年,特别在饲料行业中,L-亮氨酸作为动物营养有着特殊的作用,因此受到研究者的广泛关注。随着其应用的不断拓展,市场也在持续攀升[2]。
目前,发酵法生产L-亮氨酸的,日本企业占主导地位,尤以日本味之素公司,其在亮氨酸产量和品质均具有明显优势,大罐产酸能力达30~35 g/L,糖酸转化率为22%~28%,可达70%以上的提取率,合计年产量400~500吨。迄今为止,工业化L-亮氨酸生产菌主要通过传统诱变筛选获得的,这种经典育种方法虽可获得L-亮氨酸相对高产的优良菌株,但该法也会引入有害突变,使目标菌株生长缓慢,杂酸增多。另外,这种方式工作量大,周期长,很难在短期内进一步提高目标物产量。为了克服这些问题,理性化代谢工程育种正成为氨基酸高产菌株获得的主要方式。
代谢工程是在对代谢网络系统分析的基础上,从合成生物学的视角出发,采用基因工程技术修饰代谢途径,定向改造细胞合成系统、转运系统和细胞调控系统,以提高产物得率或改进细胞性能的目的[2]。本研究以先期通过传统复合诱变手段、结合结构类似物的筛选方法获得的一株具有L-甲硫氨酸及L-赖氨酸原养型,高浓度α-噻唑丙氨酸及α-氨基亮氨酸结构类似物抗性的产L-亮氨酸菌株——谷氨酸棒杆菌MD106(CorynebacteriumglutamicumMD106)为出发菌株,利用谷氨酸棒杆菌模式菌株ATCC13032基因组序列为模板,采用自杀载体pk18mobsacB介导的基因重组手段,失活panBC基因以及alaT基因,减少L-亮氨酸合成前体物丙酮酸和α-酮基异戊酸消耗,增强L-亮氨酸代谢流,实现对L-亮氨酸合成途径的优化,为进一步代谢工程优化改造L-亮氨酸菌株获得高产L-亮氨酸的工程菌奠定基础。
1 材料和方法
1.1 材料
1.1.1 菌株和质粒 谷氨酸棒杆菌MD106(CorynebacteriumglutamicumMD106)为本室选育并保存;载体克隆受体菌EscherichiacoliJM109购自TAKARA;自杀载体pk18mobsacB质粒为中国科学院微生物研究所李寅研究员赠送。
1.1.2 主要工具酶和试剂 限制性内切酶、DNA聚合酶、T4连接酶等均购自TAKARA;基因组提取试剂盒、PCR产物回收试剂盒、胶回收试剂盒等均购自上海生工。其他药品均为国产分析纯。
1.1.3 引物 根据Genbank的谷氨酸棒杆菌模式菌株ATCC13032基因组序列,分别设计panBC基因以及alaT基因的融合重叠延伸PCR引物。其中,划线部分序列重叠延伸互补序列,方框中的序列分别为EcoRⅠ和SalⅠ酶切位点。
panBC基因的融合延伸引物设计如下:

panBC-2:5′- AACTACAGACCTAGAACCTAAGCATCAACAATGCGTCGAATC-3′
panBC-3:5′- TAGGTTCTAGGTCTGTAGTTGCTTATCGACGCCCTCCTCC-3′

alaT基因的融合延伸引物设计如下:

alaT-2:5′-AACTACAGACCTAGAACCTATTGAGGAGTGCTTGGGTGGTCATG-3′
alaT-3:5′-TAGGTTCTAGGTCTGTAGTTACTGGACCAAAGCAATACGCACGTGG-3′

1.1.4 培养基 LB培养基:配方参阅参考文献[7];LB+10%蔗糖培养基:LB培养基的基础上添加10%的蔗糖;LBG培养基:LB培养基添加0.5%的葡萄糖;菌株的种子及发酵培养基:企业内部资料(略)。
1.2 方法
1.2.1panBC基因及alaT基因上下游片段的扩增 采用细菌基因组提取试剂盒提取谷氨酸棒杆菌MD106,并以此为模板,采用panBC-1、panBC-2引物对与alaT-1、alaT-2引物对扩增panBC和alaT基因的上游片段,panBC-3、panBC-4引物对与alaT-3、alaT-4引物对扩增panBC基因的下游片段。
反应体系为50 μL:ddH2O 33 μL,10×Ex buffer 5 μL,dNTP 5 μL,引物1、2(或3、4)各2 μL,MD106基因组1 μL,ExTaq酶2 μL,混合后进行PCR扩增。
PCR反应程序:95℃预变性5 min;94℃变性40 s,55℃退火40 s,72℃延伸40 s,30个循环;72℃最后延伸10 min。反应结束后,胶回收试剂盒回收目的片段。
1.2.2 ΔpanBC基因与ΔalaT基因的融合扩增及亚克隆 采用上述获得的回收目的片段,分别以panBC和alaT的上下游片段通过融合PCR扩增获得截短的panBC基因(ΔpanBC)及截短的alaT基因(ΔalaT)。
PCR扩增的反应体系为50 μL:ddH2O 30 μL,10×Ex buffer 5 μL,dNTP 5 μL,引物1、4各2 μL,回收的上游片段及下游片段各2 μL,ExTaq酶2 μL,混合后进行PCR扩增。
PCR反应程序:95℃预变性10 min;94℃变性40 s,55℃退火40 s,72℃延伸1 min,30个循环;72℃最后延伸10 min。反应结束后,胶回收试剂盒回收目的片段。
回收获得的目的片段进行T-A连接,并转化感受态JM109细胞,菌落PCR筛选获得阳性克隆,并送交上海生工进行测序。
1.2.3 自杀敲除组件pk18ΔpanBC及pk18ΔalaT的构建 将ΔpanBC与ΔalaT的阳性克隆质粒与敲除载体pk18mobsacB同时用限制性内切酶EcoRI、SalI进行双酶切。
双酶切体系60 μL:ddH2O 33μL,ΔpanBC、ΔalaT、pk18mobsacB质粒15 μL(约1 μg),10×H buffer 6 μL,EcoRI、SalI 各3 μL,37℃水浴过夜酶切。
双酶切产物切胶回收后用于后续连接反应,连接反应体系20 μL:ddH2O 3 μL,双切回收ΔpanBC、ΔalaT片段12 μL,pk18mobsacB 2 μL,10×ligase buffer 2 μL,T4 DNA ligase 1 μL,16℃过夜连接。
连接反应结束后转化大肠杆菌JM109感受态细胞,37℃,120 r/min复苏1 h,取300 μL涂布于含卡那霉素终浓度50 μg/mL的LB平板上,置于37℃恒温培养箱中倒置培养约20 h。挑单菌落接种至含终浓度50 μg/mL卡那霉素的LB液体培养基中,37℃,250 r/min培养过夜,提质粒筛选阳性克隆并进行酶切鉴定。
1.2.4 谷氨酸棒杆菌MD106的panBC基因的失活 将获得的pk18ΔpanBC重组载体电击转入谷氨酸棒杆菌MD106感受态细胞[采用艾本德(Eppendorf)电转仪,电击条件为:1800 V,电击时间约为4~5 ms]。重组质粒电击转入宿主之后,首先进行第一次重组,即通过单交换的方式整体插入线性插入染色体中,此步可通过含25 μg/mL卡那霉素的LBG平板进行筛选,平板上生长的克隆可视为成功进行一次重组的克隆,对获得的已经进行一次重组的单克隆进行LB液体摇菌过夜,并划线含10%蔗糖的LB平板,再分别点植LBG及LBG+卡那霉素(25 μg/mL)平板,进行二次重组筛选,并对能够再LBG平板生长,不能在LBG+卡那霉素(25 μg/mL)平板生长的克隆进行PCR验证,并进行测序验证染色体panBC基因是否被ΔpanBC替换。
1.2.5 谷氨酸棒杆菌MD106(ΔpanBC)的alaT基因的失活 在获得的panBC失活菌株的基础上,进一步进行染色体alaT基因的失活,将pk18ΔalaT重组载体电转导入谷氨酸棒杆菌MD106(ΔpanBC),方法同pk18ΔpanBC的电转及筛选操作。筛选阳性克隆进行PCR验证,并进行测序验证染色体alaT基因是否被ΔalaT替换。获得谷氨酸棒杆菌MD106(ΔpanBC-ΔalaT)。
1.2.6 摇瓶发酵培养 将谷氨酸棒杆菌MD106(ΔpanBC/ΔalaT)与对照菌株谷氨酸棒杆菌MD106,进行摇瓶的二级发酵:一级种子30℃,200 r/min培养18 h,15%移种量转接发酵摇瓶,30℃,200 r/min发酵40 h,测定菌体密度及分析L-亮氨酸及杂酸类型和含量。
2 结果与分析
2.1 ΔpanBC基因及ΔalaT基因的融合扩增及验证
以谷氨酸棒杆菌MD106基因组为模板,分别进行panBC基因及alaT基因上下游序列的扩增(图1-A),获得基因片段大小与理论预测的基本一致。
以获得的上下游片段互为模板,通过重叠延伸PCR的方法获得中间缺失了427 bp基因序列的panBC基因(ΔpanBC基因)和中间缺失412 bp基因序列的alaT基因(ΔalaT基因),其大小与理论预测基本一致(图1-B)。测序结果显示:融合的ΔpanBC基因和ΔalaT基因与ATCC13032的相关序列几乎完全一致,证明融合片段构建成功。
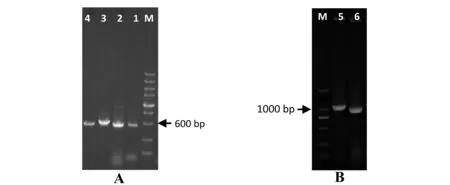
A:M为200bp leader marker,1、2为panBC基因的上下游片段,3、4为alaT基因的上下游片段B:M为DL2000 DNA leader marker,5为ΔpanBC基因融合片段,6为ΔalaT基因融合片段
图1 ΔpanBC基因及ΔalaT基因的融合扩增
2.2 自杀敲除组件pk18ΔpanBC及pk18ΔalaT的构建
EcoRⅠ与SalⅠ双切的ΔpanBC与ΔalaT片段与同样的酶切并回收的载体pk18mobsacB线性片段连接产物转化感受态JM109,并提取质粒进行酶切验证(图2)。结果显示,自杀敲除组件pk18ΔpanBC及pk18ΔalaT的构建成功。

M:λ-EcoT14 DNA leader marker;1:阴性对照(pk18mobsacB双切);2:pk18ΔpanBC载体的双切;3:pk18ΔalaT载体的双切
图2 pk18ΔpanBC及pk18ΔalaT重组载体的酶切验证
2.3 重组载体转化MD106及变株的筛选、验证
自杀敲除组件pk18ΔpanBC及pk18ΔalaT转化出发菌株谷氨酸棒杆菌MD106后,因载体含有KmR基因,在含25 μg/mL的卡那霉素培养基进行初次筛选,获得一次重组的菌株,一次重组的克隆不多,效率不高,总共不到10个克隆,这与pk18mobsacB载体本身特性有关。一次重组菌中的染色体中还含有sacB基因,利用蔗糖进行反筛选,以蔗糖为基质进行再次筛选,过滤掉一次抗性平板筛选过程中存在的游离载体,选择性进行保留二次重组的菌株。根据pk18mobsacB重组特性,在进行二次重组的过程中,可能出现回复变株,其概率在50%左右,所以需要对二次重组的克隆需要进行进一步的PCR验证,以菌落为模板,分别以panBC-1、panBC-4引物对和alaT-1、alaT-4引物对为引物,进行PCR筛选和验证,结果见图3。结果显示,阳性克隆的PCR产物较对照(以原始MD106基因组为模板)明显要小,而且对截短的PCR产物进行测序分析,确认基因panBC及alaT基因分别被ΔpanBC和ΔalaT基因替换。

M:200 bp DNA leader marker,1:ΔpanBC基因替换验证,2:阴性对照(MD106菌落PCR验证),3:MD106(ΔpanBC)菌株PCR验证,4:panBC缺失基础上的ΔalaT基因替换验证
图3panBC及alaT基因缺失菌株的菌落PCR验证
2.4 panBC、alaT基因失活对MD106发酵产L-亮氨酸的影响
以初步优化的培养基,采用摇瓶二级发酵的方式,对panBC、alaT基因失活菌株及原始MD106菌株进行发酵实验,考察双基因缺失对菌株生长、L-亮氨酸产率以及杂酸合成的影响。结果(表1)显示:(1)panBC、alaT双基因失活的重组菌株的生物量较对照菌株差别不大,说明在现有培养基的情形下,双基因的缺失基本不会对菌体生长造成较为明显的影响。(2)panBC、alaT双基因的失活有利于增强L-亮氨酸的代谢流,提高L-亮氨酸产酸率。(3)alaT基因的失活,大大减少了MD106菌株的丙氨酸合成能力,其丙氨酸的合成量减少超过80%。(4)panBC、alaT双基因失活菌株,其发酵总杂酸明显较对照菌株要低,而且幅度不仅仅只局限于丙氨酸的减少上,说明双基因的缺失对于L-亮氨酸的生物合成带来影响的同时,也对其他氨基酸的合成带来了调控,而且这种调控对于积累L-亮氨酸合成来说是有益的。

表1 panBC、alaT双基因缺失菌株与对照菌株的部分发酵指数
3 讨论
丙酮酸是合成三支链氨基酸的共同前体物,α-酮基异戊酸既是L-缬氨酸的直接前体物,又是合成L-亮氨酸的间接前体物。因此,在进行L-亮氨酸代谢工程改造时,应在增加丙酮酸合成代谢流的同时,使丙酮酸的代谢流尽可能的流向α-酮基异戊酸,另外,在分支途径中还应使α-酮基异戊酸主要流向L-亮氨酸。
丙酮酸的支路代谢主要包含:通过转氨合成丙氨酸,这一路经很容易实现,而且对丙酮酸的消耗巨大,催化合成这一过程主要包括两个转氨酶,即AvtA(avtA基因编码)和AlaT(alaT基因编码),其中AlaT对丙氨酸的合成贡献更大,有研究[8]表明,失活AlaT之后,细胞的丙氨酸的合成大大降低,而且由于AvtA的氨基供体为L-缬氨酸,所以,通过失活alaT基因,不仅大量减少丙氨酸合成,减少丙酮酸的消耗,且还相对能促进L-缬氨酸的消耗,并提供L-亮氨酸合成的间接前体物α-酮基异戊酸的量,这一点在本研究当中也得到验证,失活alaT基因之后丙氨酸的量降低超过80%,且杂酸比例也大大降低。
D-泛酸的合成以α-酮基异戊酸为直接前体,经羟基酮泛酸甲基转移酶(panB基因编码)和泛酸合成酶(panC基因编码)等催化,最终合成泛酸。通过失活泛酸合成的相关酶系,增加L-亮氨酸合成前体物,增强L-亮氨酸代谢流[9]。
本研究在传统方法选育获得一定遗传标记的产L-亮氨酸菌株MD106的基础上,采用代谢工程手段L-亮氨酸的前体物丙酮酸及α-酮基异戊酸的消耗路径进行了修饰,使得L-亮氨酸的产率明显提高,而且杂酸比例大大减少,为下一步的菌种构建提供了保障,证明代谢工程的技术路线完全适应于L-亮氨酸的菌种改造,为进一步构建高产L-亮氨酸工程菌打下了基础。
参考文献:
[1] LEE J W, NA D, PARK J M, et al. Systems metabolic engineering of microorganisms for natural and non-natural chemicals[J]. Nat. Chem. Biol, 2012(8): 536-546.
[2] HAN M W, J B PARK. Recent progress in development of synthetic biology platforms andmetabolic engineering of Corynebacterium glutamicum[J]. Journal of Biotechnology, 2014(180):43-51.
[3] BECKER J, WITTMANN C. Bio-based production of chemicals, materials and fuels-Corynebacterium glutamicum as versatile cell factory[J]. Curr. Opin. Biotechnol, 2012(23):631-640.
[6] SATOSHI H, MASAKO S, KIMIO U, et al. Engineering ofCorynebacteriumglutamicumfor High Yield L-Valine Production under Oxygen Deprivation Conditions[J]. Appl. Environ. Microbiol, 2013, 79(4):1250-1257.
[7] 萨姆布鲁克J,拉塞尔D W.分子克隆实验指南:第三版[M].北京:科学出版社,2002.
[8] JAN M, LOTHAR E. Metabolic Function of Corynebacterium glutamicum Aminotransferases AlaT and AvtA and Impact on L-Valine Production[J]. Appl. Environ. Microbiol, 2008, 74(24): 7457-7462.
[9] HERMANN S, LOTHAR E. d-Pantothenate Synthesis inCorynebacteriumglutamicumand Use ofpanBCand Genes Encoding L-Valine Synthesis for d-Pantothenate Overproduction[J]. Appl. Environ. Microbiol, 1999, 65(5):1973-1979.
