活体电转化技术在新生小鼠视网膜中的应用
2014-05-25肖丽容陈大年闫乃红
肖丽容,陈大年,闫乃红
四川大学华西医院眼科/眼科学研究室,成都 610041
活体电转化技术在新生小鼠视网膜中的应用
肖丽容,陈大年,闫乃红
四川大学华西医院眼科/眼科学研究室,成都 610041
活体电转化技术是在高电压的脉冲作用下,瞬态增加细胞膜的渗透性从而将外源基因高效导入细胞的方法。与病毒载体等其他方法相比,活体电转化技术具有安全、高效、快速、稳定及应用范围广等优点,近年来在很多组织和器官中得到广泛使用,包括在眼科研究领域。文章介绍了活体电转化技术在新生小鼠视网膜中的应用,通过新生小鼠视网膜下注射的方法,经几次高电压的脉冲,将高浓度的绿色荧光蛋白表达质粒导入新生小鼠视网膜细胞内。通过冰冻切片观察绿色荧光蛋白在视网膜中的表达。结果表明绿色荧光蛋白在视网膜外核层高表达,证实了活体电转化技术可以将外源基因高效、快捷的导入视网膜,从而为研究视网膜发育及功能提供一种有效的手段。
活体电转化;新生小鼠;视网膜;冰冻切片
近年来,随着基因测序及芯片分析等方法的发展,大量可能与哺乳动物视网膜发育及疾病相关的基因被发现,现在比以往更需要一种快速、简便的方法去分析基因的功能[1~3]。在活体动物中,基因功能的研究主要通过转基因或基因敲除来实现,而转基因和基因敲除是一项费时、费力且花费巨大的工作[4,5],利用病毒载体来携带目的基因导入机体虽然省时省力,但存在免疫原性低、潜在毒性、靶向特异性差等缺点[6,7]。为了克服这些问题,近年来一种新的导入外源基因的技术——活体电转化技术快速发展并被广泛应用。活体电转化技术是利用高脉冲瞬时改变细胞膜通透性,在膜上出现有利DNA等物质快速进入细胞的孔道,从而实现基因导入的技术[8]。目前,活体电转化技术已应用于鼠、鸡、牛蛙、猪、狗、羊、兔、恒河猴等动物[9],成功转染了肿瘤、皮肤、脑、肌肉、睾丸、脊柱、肾、肺、肝及眼等部位[10~19]。
2004年,Matsuda和 Cepko[20]将电转化方法应用于啮齿动物(Sprague-Dawley大鼠和 Swiss-Webster小鼠)视网膜功能的研究,在体外用高电压脉冲,将DNA有效地转染入视网膜内,发现绿色荧光蛋白(Green fluorescent protein, GFP)可以表达至少50 d。2011年,Melo1和 Blackshaw[21]进一步利用活体电转化技术,在新生小鼠视网膜中进行了尝试,详细地描述了新生小鼠视网膜下注射及电转化的步骤。2013年,Venkatesh等[22]针对活体电转化技术在小鼠视网膜中使用的注意事项等进行讨论,提出电转化参数、DNA浓度及视网膜下注射的位置等是影响电转化效率的关键,并且电转化小鼠视网膜的理想时间是出生后24 h内,而电转化产后3 d基本上不会转染任何细胞。2014年,研究者们利用活体电转化技术将不同的基因导入小鼠视网膜,对视网膜不同类型细胞的功能进行研究[23,24]。
综上所述,活体电转化是研究小鼠视网膜发育、疾病及功能的强有力技术,但目前还没有见到活体电转化技术在新生小鼠视网膜中应用的中文报道。本文利用活体电转化技术成功将GFP表达质粒导入新生小鼠视网膜内,并在电转化后3 d和28 d观察荧光蛋白的表达,为后续导入目的基因并研究基因的功能提供了可靠的技术支撑。
1 对象和方法
1.1 实验动物、材料、设备
成年ICR小鼠购自成都达硕生物科技有限公司,交配后繁殖得到新生小鼠(P0,出生后第0 d)。真核表达载体pEZ-M90(带有GFP绿色荧光报告基因)购于美国Genecopoeia公司;Plasmid Maxi Kit购于美国Qiagen公司;2.5 μL进样针及32G平末端针头购于美国Hamilton公司,32G胰岛素素注射针头(#32017714)购自美国BD公司。包埋剂(Opti-mum cutting temperature compound, OCT)及冰冻切片包埋模具购自日本Tissue-Tek公司。电转化仪(型号为 NEPA21,电极型号为CUY650P5)购自日本NEPA GENE公司。冰冻切片机(Leica CM 1850)及荧光显微镜(Leica DM3000)购于德国莱卡公司。常规试剂购于国产公司。
1.2 方法
1.2.1 高浓度质粒提取
将真核表达载体pEZ-M90转化DH5α大肠杆菌感受态细胞,氨苄青霉素培养基中 37℃过夜培养。挑取白色菌落,在5 mL LB/氨苄青霉素培养基中小量活化后,转入50 mL LB/氨苄青霉素培养基中大量培养,6000 g、4℃条件下离心15 min收集菌液,按照Plasmid Maxi Kit操作说明提取质粒,最后用无内毒素的TE溶解DNA为1 μg/μL。加入1% blue dye到DNA溶液中使其终浓度为0.01%,作为注射时的指示剂。
1.2.2 视网膜下腔注射
新生小鼠(P0)置于冰上数分钟使之麻醉,用70%酒精擦拭小鼠眼表,准确定位出两眼睑的结合处。用32G的尖锐针头小心划开两眼睑间的皮肤,暴露眼球(注意划开面积与深度,避免划伤周围组织或内部眼球)。用32G的尖锐针头在角巩膜缘穿刺并形成一个小口,用32G Hamilton平末端针头的微量注射器吸取1 µL DNA溶液,将针头45°角顺着小口插入玻璃体腔,并穿透视网膜,直至遇到来自巩膜的阻力停止(注意避免穿破晶状体),此时针头已插入到视网膜下,缓慢推动注射器活塞将DNA溶液注射到视网膜下腔,可以观察到蓝色染料在视网膜下均匀扩散,表明已成功地将 DNA溶液注射到视网膜下。退出注射器后合眼并用浸润PBS的棉球擦拭眼表皮肤。
1.2.3 活体电转化
电转化所用电极为10 mm直径的镊子状电极。为提高皮肤与电极间传导性将电极浸泡在 PBS中,用电极夹住小鼠头部两侧,保证两电极镊子分别完全覆盖左右眼睛,注射DNA的眼球用电极正极,另一侧为负极。两电极形成的电场应完全垂直于视网膜所注射的部位,才能保证有效电转化。如若注射位置恰好在视网膜中央,两电极与角膜保持水平,则可以得到最高的转化效率。电转化条件:5次脉冲,80 V,50 ms,每两次脉冲间隔950 ms。电转化后的小鼠在37℃下使其苏醒,最后放回笼中与其母亲共同饲养。
1.2.4 眼球的固定、包埋、切片及荧光观察
电转化3 d和28 d后处死小鼠,取出眼球,用针尖在角巩膜缘处戳个小洞,注意不要挤压眼球,然后用 4%多聚甲醛在 4℃固定过夜,取出眼球用PBS清洗3遍,于30%蔗糖脱水至眼球沉降管底。用OCT包埋眼球,然后用冰冻切片机切片,厚度为6 μm。将切片风干后用PBS洗涤3次,去除OCT,用含DAPI染料的封片剂封片,观察荧光。
2 结 果
2.1 视网膜下腔注射
新生小鼠视网膜下注射 DNA溶液示意图见图1A,要注意注射针的角度和位置,确保将 DNA溶液注射在视网膜下中央位置,然后缓慢推注射针,使DNA溶液沿着视网膜下空隙均匀扩散。注射后小鼠眼球呈现均一的蓝色(图 1B),说明视网膜下注射成功。成功的操作对眼球损伤很小,也不会影响视网膜的正常发育。
2.2 新生小鼠眼球活体电转化
视网膜下注射DNA后,将电极夹夹住小鼠双眼,要注意电极夹的位置和方向(图2A),而图2B和2C不能将 DNA导入视网膜细胞。电流的方向、DNA注射的位置及确保电流穿过DNA注射的位置,是该实验的关键。实验完毕后,几乎所有的动物都能健康存活。
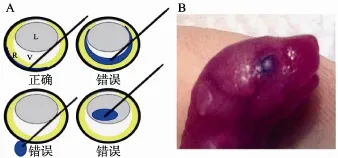
图1 小鼠视网膜下注射DNA溶液A:图解视网膜下注射的正确操作,其中R代表视网膜,V代表玻璃体,L代表晶状体。将DNA液体注射到玻璃体腔、眼球外及晶状体内都是错误的操作;B:新生小鼠(P0 d)注射DNA溶液后的眼球,可见蓝色染料均匀分布在眼球内。

图2 活体电转化电极位置对电转化的影响A:图解视网膜下注射后电转化的正确操作,DNA分布在视网膜中部,并且电极板的方位贴于双眼角膜中央;B:视网膜下液体分布在视网膜一边,电流虽然穿过眼球,但是没有穿过注射部位,将导致转化失败;C:视网膜下液体分布在视网膜一边,电流也没有穿过注射部位,将导致转化失败。
2.3 绿色荧光蛋白在视网膜中的表达
本实验使用真核表达载体pEZ-M90为CMV启动子,电转化后3 d,可在视网膜中观测到GFP荧光的表达(图3A)。出生后3 d的小鼠视网膜没有发育完全,视网膜只有2层结构,为成神经细胞层(Neuroblastic layer, NBL)和神经节细胞层(Ganglion cell layer, GCL),GFP主要分布在外成神经细胞层。电转化28 d后,GFP仍然表达较强,视网膜已经完全分化,GFP主要在视网膜外核层(Outer nuclear layer, ONL)中表达,而内核层(Inner nuclear layer, INL)被转化的细胞较少。
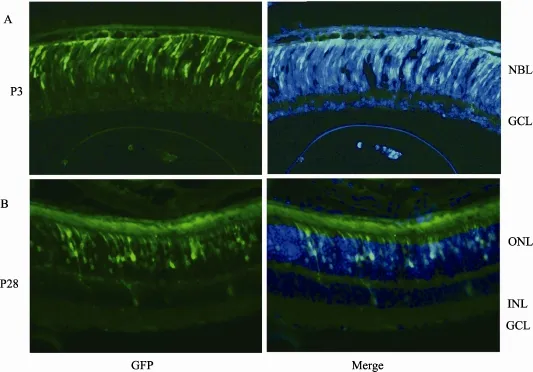
图3 电转化后3 d及28 d视网膜中GFP的表达A:新生小鼠视网膜电转化后3 d的荧光表达图,GFP绿色荧光主要在视网膜NBL中;B:新生小鼠视网膜电转化后28 d的荧光表达图,GFP绿色荧光主要在ONL中表达,而INL荧光较少。
3 讨 论
本文介绍了一种高效、快速将外源基因导入新生小鼠视网膜的方法,该活体电转化与其他基因导入方法相比,具有很多无法比拟的优点[20]。第一,理论上任何组织和器官都可以作为活体电转化的靶器官;第二,电转化技术操作简单、快速和安全,且DNA制备容易。第三,当DNA注射方式准确时,DNA转导效率非常高;第四,电转化技术对于导入的外源基因片段大小没有限制,优于病毒载体;第五,可以同时导入多个基因表达质粒或shRNA进入视网膜细胞。有研究表明,多个转录因子的结合,而不是单一的转录因子导入视网膜,对研究不同类型的视网膜细胞很重要[25,26]。另外,该技术可以用来研究多重复杂基因的相互作用。
由于电转化技术具有上述优点,此项技术已广泛应用于多个物种的不同组织[9,27,28]。在中枢神经系统,此技术也已成功应用于不同物种包括鸟类和啮齿动物。早期神经发育的研究对象通常是胚胎,目前研究表明,在出生后或成年动物的大脑仍然有很高效率[12]。由于眼睛处于浅表,易于观察和定位,是电转化技术最好的靶器官。电转化技术除了在视网膜中广泛应用之外,还广泛应用于角膜、玻璃体、晶状体、睫状肌等组织中[19,29~31]。Chen等[30]将表达GFP和鸡neurofibromatosis 2( cNf2)质粒注入鸡胚晶状体,用电转化技术将该质粒转入晶状体上皮细胞,转染4 h后可明显观察到GFP表达,表明在活体鸡胚中用电转化技术可有效转导目的基因于晶状体上皮细胞。Bloquel等[31]利用电转化技术将肿瘤坏死因子受体基因(Tumor necrosis factor receptor, TNFR)导入大鼠睫状肌,有助房水高蛋白质分泌,明显抑制葡萄膜炎。
通过活体电转化技术将质粒导入新生小鼠视网膜下,并获得较高的转化效率,要注意以下几个方面。第一,所需质粒需要去除内毒素,最好利用高浓度、高纯度的质粒,为成功转化提供前提条件。第二,需要操作者掌握熟练的技巧,准确将DNA溶液注射入视网膜下腔。第三,划开眼睑暴露眼球时,操作者应注意控制划开力度和面积,以免划伤眼球和周围血管,将Hamilton平末端针头插进眼球时应注意避开晶状体,并穿过玻璃体进入到视网膜下正中央,直到感觉来自巩膜的压力时再缓慢注射质粒,使其均匀扩散于整个视网膜。第四,电极需保证具有适当的导电性,使用完的电极镊子需保证干净,防止被氧化影响电极接触面积而影响转化效率。第五,电转化时电极镊子的位置应适当,保证注射的质粒在两电极范围内。第六,电压、脉冲次数和时间要不断优化,将细胞损伤降低并可以获得较高的转化效率。
任何技术都存在一定的缺点,电转化技术也不例外。首先,与整合型的逆转录病毒载体相比,外源基因表达持续时间较短,不合适进行遗传性视网膜疾病等基因治疗。Matsuda和 Cepko[20]研究表明GFP在视网膜中表达至少50 d,对于视网膜的发展研究时间足够,包括晚期成熟的视杆细胞(Rod cell)、双极细胞(Bipolar cell)及Muller细胞。其次,与病毒载体法相比,外源基因表达效率低于病毒载体。再次,电转化技术可能会引起局部细胞损害和炎性反应等不良反应的风险。相信随着该技术的不断发展,上述缺点会逐一解决,活体电转化技术将会更广泛地应用于基础与临床研究。
[1] Livesey FJ, Furukawa T, Steffen MA, Church GM, Cepko CL. Microarray analysis of the transcriptional network controlled by the photoreceptor homeobox gene Crx. Curr Biol, 2000, 10(6): 301–310.
[2] Farjo R, Yu JD, Othman MI, Yoshida S, Sheth S, Glaser T, Baehr W, Swaroop A. Mouse eye gene microarrays for investigating ocular development and disease. Vision Res, 2002, 42(4): 463–470.
[3] Blackshaw S, Fraioli RE, Furukawa T, Cepko CL. Comprehensive analysis of photoreceptor gene expression and the identification of candidate retinal disease genes. Cell, 2001, 107(5): 579–589.
[4] Cho A, Haruyama N, Kulkarni AB. Generation of transgenic mice. Curr Protoc Cell Biol, 2009, Chapter 19: Unit 19.
[5] Testa G, Vintersten K, Zhang Y, Benes V, Muyrers JP, Stewart AF. BAC engineering for the generation of ES celltargeting constructs and mouse transgenes. Methods Mol Biol, 2004, 256: 123–139.
[6] Miyoshi H, Takahashi M, Gage FH, Verma IM. Stable and efficient gene transfer into the retina using an HIV–based lentiviral vector. Proc Natl Acad Sci USA, 1997, 94(19): 10319–10323.
[7] Flannery JG, Zolotukhin S, Vaquero MI, LaVail MM, Muzyczka N, Hauswirth WW. Efficient photoreceptortargeted gene expression in vivo by recombinant adenoassociated virus. Proc Natl Acad Sci USA,1997, 94(13): 6916–6921.
[8] Golzio M, Teissié J, Rols MP. Direct visualization at the single-cell level of electrically mediated gene delivery. Proc Natl Acad Sci USA,2002, 99(3): 1292–1297.
[9] Prud'homme GJ, Glinka Y, Khan AS, Draghia-Akli R. Electroporation-enhanced nonviral gene transfer for the prevention or treatment of immunological, endocrine and neoplastic diseases. Curr Gene Ther, 2006, 6(2): 243–273.
[10] Li SL. Delivery of DNA into tumors. Methods Mol Biol, 2008, 423: 311–318.
[11] Ferraro B, Cruz YL, Coppola D, Heller R. Intradermal delivery of plasmid VEGF165by electroporation promotes wound healing. Mol Ther, 2009, 17(4): 651–657.
[12] De Vry J, Martínez-Martínez P, Losen M, Temel Y, Steckler T, Steinbusch HWM, De Baets MH, Prickaerts J. In vivo electroporation of the central nervous system: a non- viral approach for targeted gene delivery. Prog Neurobiol, 2010, 92(3): 227–244.
[13] Martínez-Martínez P, Phernambucq M, Steinbusch L, Schaeffer L, Berrih-Aknin S, Duimel H, Frederik P, Molenaar P, De Baets MH, Losen M. Silencing rapsyn in vivo decreases acetylcholine receptors and augments sodium channels and secondary postsynaptic membrane folding. Neurobiol Dis, 2009, 35(1): 14–23.
[14] Hibbitt O, Coward K, Kubota H, Prathalingham N, Holt W, Kohri K, Parrington J. In vivo gene transfer by electroporation allows expression of a fluorescent transgene in hamster testis and epididymal sperm and has no adverse effects upon testicular integrity or sperm quality. Biol Reprod, 2006, 74(1): 95–101.
[15] Luo J, Ju MJ, Redies C. Regionalized cadherin-7 expression by radial glia is regulated by Shh and Pax7 during chicken spinal cord development. Neuroscience, 2006, 142(4): 1133–1143.
[16] Xu D, Zhang T, Chen X, Zhou Q, Liu C, Deng Z, Zhang L, Ying C, Zhang W, Gu M. Reduction of osteopontin in vivo inhibits tubular epithelial to mesenchymal transition in rats with chronic allograft nephropathy. Transplant Proc, 2013, 45(2): 659–665.
[17] Zhou R, Norton JE, Zhang N, Dean DA. Electroporationmediated transfer of plasmids to the lung results in reduced TLR9 signaling and inflammation. Gene Ther, 2007, 14(9): 775–780.
[18] Jaichandran S, Yap STB, Khoo ABM, Ho LP, Tien SL, Kon OL. In vivo liver electroporation: optimization and demonstration of therapeutic efficacy. Hum Gene Ther, 2006, 17(3): 362–375.
[19] Kachi S, Oshima Y, Esumi N, Kachi M, Rogers B, Zack DJ, Campochiaro PA. Nonviral ocular gene transfer. Gene Ther, 2005, 12(10): 843–851.
[20] Matsuda T, Cepko CL. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc Natl Acad Sci USA, 2004, 101(1): 16–22.
[21] de Melo J, Blackshaw S. In vivo electroporation of developing mouse retina. J Vis Exp, 2011(52):doi:10.3791/ 2847.
[22] Venkatesh A, Ma S, Langellotto F, Gao G, Punzo C. Retinal gene delivery by rAAV and DNA electroporation. Curr Protoc Microbiol, 2013, Chapter 14: Unit 14D.
[23] Aslanidis A, Karlstetter M, Walczak Y, Jägle H, Langmann T. RETINA-specific expression of Kcnv2 is controlled by cone-rod homeobox (Crx) and neural retina leucine zipper (Nrl). Adv Exp Med Biol, 2014, 801: 31–41.
[24] Wang S, Sengel C, Emerson MM, Cepko CL. A gene regulatory network controls the binary fate decision of rod and bipolar cells in the vertebrate retina. Dev Cell, 2014, 30(5): 513–527.
[25] Hatakeyama J, Tomita K, Inoue T, Kageyama R. Roles of homeobox and bHLH genes in specification of a retinal cell type. Development, 2001, 128(8): 1313–1322.
[26] Inoue T, Hojo M, Bessho Y, Tano Y, Lee JE, Kageyama R. Math3 and NeuroD regulate amacrine cell fate specification in the retina. Development, 2002, 129(4): 831–842.
[27] Thummel R, Bailey TJ, Hyde DR. In vivo electroporation of morpholinos into the adult zebrafish retina. J Vis Exp, 2011, (58): e3603.
[28] Hyde DR, Godwin AR, Thummel R. In vivo electroporation of morpholinos into the regenerating adult zebrafish tail fin. J Vis Exp, 2012, (61), pii: 3632 doi: 10. 3791/3632.
[29] Hao J, Li SK, Liu CY, Kao WW. Electrically assisted delivery of macromolecules into the corneal epithelium. Exp Eye Res, 2009, 89(6): 934–941.
[30] Chen YX, Krull CE, Reneker LW. Targeted gene expression in the chicken eye by in ovo electroporation. Mol Vis, 2004, 10: 874–883.
[31] Bloquel C, Bejjani R, Bigey P, Bedioui F, Doat M, BenEzra D, Scherman D, Behar-Cohen F. Plasmid electrotransfer of eye ciliary muscle: principles and therapeutic efficacy using hTNF-alpha soluble receptor in uveitis. FASEB J, 2006, 20(2): 389–391.
(责任编委: 许执恒)
In vivo electroporation of newborn mouse retina
Lirong Xiao, Danian Chen, Naihong Yan
Ophthalmic Laboratories & Department of Ophthalmology, West China Hospital, Sichuan University, Chengdu 610041, China
In vivo electroporation is the process referred to a transient increase in the permeability of cell membranes upon high electric field pulses and delivery of engineered constructs into cells. Compared with the viral-mediated gene transfer system, the in vivo electroporation technique has several advantages, such as safe, high efficiency, rapid, stable and wide application. Thus, this technique has been widely used in the studies of many tissues or organs, including the eye. Here, we report the application of in vivo electroporation in the newborn mouse retina. DNA plasmid of GFP expression vector with high concentration was directly injected into the subretinal space of neonatal mouse pups. The DNA was then transfected into the retinal cells after several pulses of high voltage. Transfected GFP allowed clear visualization of cell morphologies in cryo-sections and the GFP was highly expressed in retinal outer nuclear layer. The results showed that this technique can effectively transfer the genes into retinal cells. In vivo electroporation will be a useful tool for the study of retinal development and function.
in vivo electroporation; newborn mouse; retina; cryo-sections
2014-10-14;
2014-10-14
国家自然科学基金项目(编号:81371024)和四川省科技厅科技支撑项目(编号:2014SZ0030)资助
肖丽容,学士,专业方向:医学技术学。E-mail: lirongxiao@126.com
闫乃红,博士,副教授,研究方向:医学遗传学。E-mail: yannaihong@126.com
10.3724/SP.J.1005.2014.1173
时间: 2014-10-16 10:07:36
URL: http://www.cnki.net/kcms/detail/11.1913.R.20141016.1007.001.html
