脊髓性肌萎缩症患者尿液细胞模型的建立
2014-05-25陈万金张奇杰何瑾林翔王柠
陈万金,张奇杰,何瑾,林翔,王柠
福建医科大学附属第一医院神经内科,福州 350005
脊髓性肌萎缩症患者尿液细胞模型的建立
陈万金,张奇杰,何瑾,林翔,王柠
福建医科大学附属第一医院神经内科,福州 350005
脊髓性肌萎缩症(Spinal muscular atrophy, SMA)大多数在儿童或婴幼儿期发病,表现为进行性、对称性的肢体无力和肌肉萎缩,迄今尚无有效的治疗方法,是婴幼儿最常见的致死性遗传病之一。患者来源的细胞系是该病研究的重要工具,但依赖于肌肉或皮肤活检等创伤性手术的成纤维细胞培养较难被患者及家属接受。文章收集SMA患者及健康对照的新鲜尿液,进行离心、尿液沉渣培养,观察尿液细胞的生长状况,用酶联免疫吸附实验(Enzyme-linked immunosorbent assay,ELISA)分析患者尿液细胞中SMN(Survival of motor neuron)蛋白的表达量,应用免疫荧光染色观察SMN蛋白在细胞内的定位。共建立了11例SMA患者和14例健康对照的尿液细胞系,尿液细胞体外增殖旺盛,细胞形态及生长速度较稳定。患者来源的尿液细胞SMN1(Survival of motor neuron 1) 基因缺失突变、SMN蛋白表达量降低,荧光染色提示SMN蛋白在胞浆和胞核中均有定位。尿液细胞培养步骤简单、无创伤性、患儿及其家属的依从性好,是获取和保存病人来源标本的有效方法,在脊髓性肌萎缩症发病机制研究和临床应用方面具有较好的应用价值。
脊髓性肌萎缩症;运动神经元生存蛋白;尿液;细胞培养
脊髓性肌萎缩症(Spinal muscular atrophy, SMA)是一类较为常见的常染色体隐性遗传病,也是婴儿期最常见的致死性遗传病之一[1]。SMA的致病基因为运动神经元生存(Survival of motor neuron, SMN)基因[2],编码全长的SMN蛋白,主要参与前体信使RNA的剪接、轴突生长等多种重要功能[3~5]。SMN基因具有SMN1、SMN2两种高度同源的拷贝,SMN1主要表达全长的具有完整功能的SMN蛋白,而SMN2主要表达缺失 7号外显子的截短蛋白(SMNΔ7),其具体的机制尚不明确。在SMN基因剪接和SMA发病机制研究中,疾病模型的建立尤其重要。本研究收集SMA患者的无菌尿液并进行细胞培养,成功建立了尿液来源的细胞系,并进行了SMN1缺失、SMN蛋白表达及定位分析。
1 对象与方法
1.1 研究对象
本实验收集的 SMA患者来自福建医科大学附属第一医院神经内科门诊和住院病人,经临床和SMN基因检测明确,符合SMA的诊断标准[6]。本研究获得福建医科大学附属第一医院伦理委员会的批准,所有患者及其家属均知情同意并签署知情同意书。
1.2 方法
1.2.1 尿液细胞的原代培养
尿液收集:无菌容器收集新鲜中段尿液,儿童50~200 mL,成人200~500 mL;嘱患者大量饮水后留取中段尿液,为减少消毒剂对尿道周围皮肤的刺激,一般无需局部消毒,但宜用温水清洁。无菌离心管(50 mL或250 mL)分装尿液,室温下离心,转速为1500~2000 r/min,离心时间5~10 min,弃上清,收集沉渣。对于儿童,若一次尿液量不够原代培养,可多次收集、合并,新鲜尿液置于室温保存,建议尽快进行原代培养。培养基的制备及细胞培养:将上皮细胞培养基(美国 ScienCell)和 DMEM(美国GIBCO)1:1混合后,添加 10%的胎牛血清(美国GIBCO)和 1%的青霉素/链霉素(中国碧云天)。将尿液离心后收集的沉渣用上述培养基重悬后,移至细胞培养瓶(美国Corning),于5%CO2、37℃恒温培养箱(日本SANYO)中培养。3~4 d后观察细胞贴壁生长状况,1周后根据细胞数,经胰蛋白酶(0.25%,美国GIBCO)消化后,以1:1、1:2或1:3传代培养。1.2.2 尿液细胞SMN基因突变分析
胰酶消化后,收集培养的尿液细胞,提取基因组DNA(QIAamp DNA blood mini kit, 德国QIAGEN)。采用聚合酶链反应-限制性酶切片段长度多态性(PCR-RFLP)技术进行SMN基因第7和第8号外显子缺失分析[7]。
1.2.3 酶联免疫吸附试验分析尿液细胞 SMN蛋白表达量
将稳定期的各株尿液细胞系经胰蛋白酶消化、计数后,接种至96孔板,平均每孔10 000个细胞,每株细胞系重复3~6个孔。第2日,细胞贴壁后,去培养基,用甲醛(2.5%)室温固定 30 min。PBS(Phosphate buffered saline, 1×)洗涤后,用0.1% Triton-X-100-PBS透膜5 min。5%脱脂奶粉-PBS室温封闭1 h。SMN1抗体(1:500稀释,美国GeneTex)37℃摇育2 h。0.05% Tween 20-PBS洗涤后,辣根酶标记山羊抗兔IgG抗体(1:5000稀释,中国武汉三鹰)室温孵育1 h。0.05% Tween 20-PBS洗涤后,加入TMB one溶液(美国Promega)室温显色10~20 min,待液体变蓝后,加入硫酸(2 mol/L)终止反应。酶标仪(美国BIO-RAD)检测492 nm波长的吸光度,记录OD值,Excel软件分析。
1.2.4 尿液细胞SMN蛋白定位分析
将稳定期的尿液细胞系经胰蛋白酶消化、计数后,接种至灭菌的盖玻片,于6孔板培养至80%左右的细胞密集度。去培养基,PBS清洗后,用4%多聚甲醛室温固定30 min,用预冷甲醇4℃透膜10 min。PBS清洗后,用含 1%BSA、4%羊血清和 0.4% Triton-X-100-PBS的封闭液4℃封闭过夜。SMN1抗体(1:200稀释,美国GeneTex)和Fibrillarin抗体(1:100稀释,美国Santa Cruz) 4℃孵育过夜。0.1% Triton-X-100-PBS洗涤后,在避光条件下,加入Alexa Fluor 594标记山羊抗兔 IgG(重链+轻链)抗体和 Alexa Fluor 488 标记山羊抗兔 IgG(重链+轻链)抗体(中国武汉三鹰),室温孵育1 h。0.1% Triton-X-100-PBS洗涤后,DAPI复染胞核5 min。PBS清洗后,抗荧光淬灭封片剂封片,激光共聚焦显微镜(德国Leica)观察胞核、胞浆染色情况。
1.2.5 统计分析
采用t检验(SPSS统计软件包)分析SMA患者和健康对照的SMN蛋白量的差异。P<0.05为差异具有统计学意义。
2 结果与分析
2.1 尿液细胞的形态及生长特点
目前,本研究已成功获得11例不同表型SMA患者和14例健康对照的尿液细胞系。新鲜尿液收集简便、无创伤性,尿液细胞的建系成功率约 50%,通过适当增加尿液收集量、明胶或多聚赖氨酸包被培养瓶,可使成功率提高至70%~80%。图1显示的是一例尿液细胞系典型的体外培养细胞形态和增殖特点。3 d左右,可在显微镜下观察到数个细胞贴壁,而1周左右可见贴壁的细胞往外生长,呈簇状,一般可见到两种类型的细胞:一种呈狭长的梭形状,细胞排列紧密(图1A);另一种则呈圆或椭圆形状,细胞排列稀疏,状如鹅软石(图 1B),这两种细胞在同一个细胞系中常同时存在。细胞生长大致经历增殖初期-快速期-稳定期。稳定期的尿液细胞增殖能力旺盛,平均2 d即可传代或冻存,且细胞形态和倍增时间较稳定,可稳定传至第4代左右(图1,C~E),稳定期的细胞是进一步试验研究的最佳时期。第 5代以后的尿液细胞往往趋向老化,细胞形态变化大、增殖能力明显下降、贴壁牢固、不易消化传代(图1F)。

图1 一例尿液细胞系典型的细胞形态和增殖特点A、B:原代尿液细胞(P0)贴壁、簇状生长,可见梭形和椭圆形两种细胞类型;C~F:原代细胞传代扩增至第5代,其中第2~4代(P2-P4)细胞形态和增长速度稳定,第5代(P5)细胞出现老化。标尺=100 μm。
2.2 SMA尿液细胞SMN1基因突变、SMN蛋白表达及定位分析
SMA患者来源的尿液细胞系同样携带有 SMN基因的缺陷,具有SMN1的第7和第8号外显子缺失(图2A)。ELISA结果显示,与健康对照相比,SMA患者的尿液细胞中SMN蛋白水平明显下降(图2B),SMA患者和健康对照的平均吸光度(OD)值分别为0.45±0.03(n=11)与0.54±0.02(n=14),t=3.597,p=0.004。SMN蛋白的细胞内定位分析显示,其在胞浆和胞核内均有分布(图3A),当SMN与Fibrillarin双标免疫荧光染色时,可见到胞核内的Gems颗粒(图3B)。

图2 患者尿液细胞系SMN基因及蛋白表达分析A:琼脂糖凝胶电泳检测显示患者的尿液细胞携带有SMN1基因第7和第8号外显子缺失;B:ELISA结果显示,与健康对照相比,SMA患者的尿液细胞中SMN蛋白量下降。OD:吸光度。
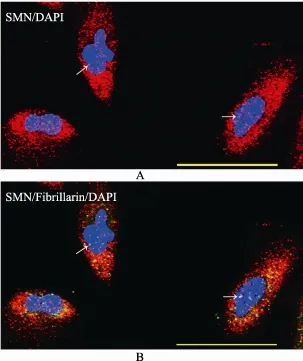
图3 疫荧光染色方法分析SMN蛋白在尿液细胞中的定位A:SMN蛋白在胞浆和胞核中均有表达;B:SMN蛋白和Fibrillarin蛋白双标免疫荧光染色时,可见胞核内的 Gems颗粒(箭头所示)。标尺=50 μm。
3 讨 论
目前,在SMA发病机制研究中主要采用NSC34、PC12等神经元样细胞、SMA患者来源的成纤维细胞以及SMA动物模型作为研究工具,它们为SMA的病理研究、分子机制探索、药物干预等提供了重要模型,但也存在一些不足[8]。NSC34、PC12细胞并非真正意义上的神经元,且在进行蛋白功能研究时存在内源性SMN基因干扰。成纤维细胞一般通过皮肤或肌肉活检获取组织标本,再经原代培养获得,虽是SMA患者来源的细胞,但由于其具有创伤性,使其来源受到限制。SMA动物模型制作较为困难,SMN1基因是一种管家基因,完全敲除后模型动物不能存活,而SMN2基因作为一种表型修饰基因,仅存在于人类中,故SMA动物模型的制作不仅需要敲除SMN1基因,还需敲入SMN2基因,因此SMA动物模型在普通实验室推广应用困难。
本文通过收集 SMA患者及健康对照的新鲜尿液,结合细胞培养技术,探索尿液沉渣中脱落的尿道上皮细胞的体外培养,并成功建立了患者及健康对照来源的尿液细胞系。SMA患者特异的尿液细胞携带有SMN基因缺陷,表达较低水平的SMN蛋白,在某种程度上,与成纤维细胞类似,能够作为SMA的一种体外细胞模型。同时,SMN蛋白在尿液细胞的胞浆和胞核中均有表达,一般胞浆的SMN蛋白散在分布,而胞核内的 SMN蛋白会自身聚集,与Fibrillarin等多种蛋白相互作用,募集多种Gemin蛋白,形成 Gems颗粒,与卡哈尔体等共同参与前体信使 RNA的剪接。研究发现 SMA患者胞核中的Gems颗粒较正常人少,且Gems颗粒数与SMA的表型存在一定的关系[9],尿液细胞中也可检测到Gems颗粒,但不同患者尿液细胞中Gems颗粒数以及药物干预后颗粒数的变化尚需进一步研究。总之,尿液细胞培养步骤简单、尿液收集无创伤,容易被患儿及其家属所接受,在临床实践中有其优越之处。对诸如SMA等的一些遗传疾病而言,是获取和保存病人来源标本的有效方法。
正常人尿液中脱落的上皮细胞并不多,而且多数为衰老的细胞,体外增殖能力差。而在某些泌尿系统疾病患者,常有异常脱落的上皮细胞,Kumagai等[10]从严重慢性肾小球肾炎患儿的尿液中培养得到了近端小管细胞;Vogelmann等[11]在肾小球疾病和健康对照尿液中培养得到了足突细胞;这些细胞在体外均具有增殖能力,能够用于相关疾病的发病机制研究。本文培养得到的尿液细胞系主要由两种类型的细胞组成:一种呈梭形,细胞排列紧密;另一种呈圆或椭圆形,细胞排列稀疏,这与 Dörrenhaus的发现相似,他们将尿液细胞分为1型和2型,分别为尿道上皮细胞和肾小管细胞来源[12],我们之前的研究也证实为足突细胞和尿道上皮细胞[13]。尿液细胞不像成纤维细胞,有其体外增殖特点,细胞增殖旺盛,但传代数少、易老化,Vogelmann等[11]认为尿液来源的细胞多数属于衰老细胞,在体外培养1~2周后会经历一个“危机期”,某些细胞发生凋亡。虽然,尿液细胞主要是上皮细胞来源、体外传代能力较弱、易凋亡,但Zhou等[14]发现尿液细胞仍具有重编程为 iPS细胞的能力,且由于尿液细胞来源丰富、获取简便,具有优越之处。国内学者们也成功建立了健康个体尿液细胞诱导来源的iPS细胞库[15],获得了系统性红斑狼疮、隐睾症患者特异的尿液-iPS细胞模型[16,17],Wang等[18]首次将尿液细胞直接诱导为神经前体细胞,这些都为疾病的发病机制研究和药物筛查提供了良好的细胞模型。
总之,尿液细胞培养简便易行、重复性高,尿液收集无创伤性,患者及其家属依从性好,是获取SMA患者来源标本的有效方法,在SMA发病机制研究和临床应用方面,有重要的应用前景和推广价值。
[1] Kolb SJ, Kissel JT. Spinal muscular atrophy: a timely review. Arch Neurol, 2011, 68(8): 979–984.
[2] Lefebvre S, Bürglen L, Reboullet S, Clermont O, Burlet P, Viollet L, Benichou B, Cruaud C, Millasseau P, Zeviani M, Paslier DL, Frézal J, Cohen D, Weissenbach J, Munnich A, Melki J. Identification and characterization of a spinal muscular atrophy-determining gene. Cell, 1995, 80(1): 155–165.
[3] Zhang ZX, Lotti F, Dittmar K, Younis I, Wan LL, Kasim M, Dreyfuss G. SMN deficiency causes tissue-specific perturbations in the repertoire of snRNAs and widespread defects in splicing. Cell, 2008, 133(4): 585–600.
[4] Martinez TL, Kong LL, Wang XY, Osborne MA, Crowder ME, Van Meerbeke JP, Xu XX, Davis C, Wooley J, Goldhamer DJ, Lutz CM, Rich MM, Sumner CJ. SMN in motor neurons determines synaptic integrity in spinal muscular atrophy. J Neurosci, 2012, 32(25): 8703–8715.
[5] Piazzon N, Schlotter F, Lefebvre S, Dodré M, Méreau A, Soret J, Besse A, Barkats M, Bordonné R, Branlant C, Massenet S. Implication of the SMN complex in the biogenesis and steady state level of the Signal Recognition Particle. Nucleic Acids Res, 2013, 41(2): 1255–1272.
[6] Talbot K, Davies KE. Spinal muscular atrophy. Semin Neurol, 2001, 21(2): 189–198.
[7] He J, Zhang QJ, Lin QF, Chen YF, Lin XZ, Lin MT, Murong SX, Wang N, Chen WJ. Molecular analysis of SMN1, SMN2, NAIP, GTF2H2, and H4F5 genes in 157 Chinese patients with spinal muscular atrophy. Gene, 2013, 518(2): 325–329.
[8] Ebert AD, Svendsen CN. Stem cell model of spinal muscular atrophy. Arch Neurol, 2010, 67(6): 665–669.
[9] Coovert DD, Le TT, McAndrew PE, Strasswimmer J, Crawford TO, Mendell JR, Coulson SE, Androphy EJ, Prior TW, Burghes AHM. The survival motor neuron protein in spinal muscular atrophy. Hum Mol Genet, 1997, 6(8): 1205–1214.
[10] Kumagai N, Inoue CN, Kondo Y, Iinuma K. Mitogenic action of lysophosphatidic acid in proximal tubular epithelial cells obtained from voided human urine. Clin Sci (Lond), 2000, 99(6): 561–567.
[11] Vogelmann SU, Nelson WJ, Myers BD, Lemley KV. Urinary excretion of viable podocytes in health and renal disease. Am J Physiol Renal Physiol, 2003, 285(1): F40–F48.
[12] Dörrenhaus A, Müller JIF, Golka K, Jedrusik P, Schulze H, Föllmann W. Cultures of exfoliated epithelial cells from different locations of the human urinary tract and the renal tubular system. Arch Toxicol, 2000, 74(10): 618–626.
[13] Zhang QJ, He J, Ni W, Lin X, Yao XP, Lin MT, Murong SX, Wang N, Chen WJ. Noninvasive urine-derived cell lines derived from neurological genetic patients. Neuroreport, 2013, 24(4): 161–166.
[14] Zhou T, Benda C, Duzinger S, Huang YH, Li XY, Li YH, Guo XP, Cao GK, Chen S, Hao LL, Chan YC, Ng KM, Ho JC, Wieser M, Wu JY, Redl H, Tse HF, Grillari J, Grillari-Voglauer R, Pei DQ, Esteban MA. Generation of induced pluripotent stem cells from urine. J Am Soc Nephrol, 2011, 22(7): 1221–1228.
[15] Xue YT, Cai XJ, Wang LL, Liao BJ, Zhang H, Shan YL, Chen QY, Zhou TC, Li XR, Hou JD, Chen SB, Luo RP, Qin DJ, Pei DQ, Pan GJ. Generating a non-integrating human induced pluripotent stem cell bank from urineerived cells. Plos One, 2013, 8(8): e70573.
[16] Chen YY, Luo RP, Xu Y, Cai XJ, Li WX, Tan KB, Huang JR, Dai Y. Generation of systemic lupus erythematosus-specific induced pluripotent stem cells from urine. Rheumatol Int, 2013, 33(8): 2127–2134.
[17] Zhou JM, Wang X, Zhang SL, Gu YJ, Yu L, Wu J, Gao TB, Chen F. Generation and characterization of human cryptorchid-specific induced pluripotent stem cells from urine. Stem Cells Dev, 2013, 22(5): 717–725.
[18] Wang LH, Wang LL, Huang WH, Su HX, Xue YT, Su ZH, Liao BJ, Wang HT, Bao XC, Qin DJ, He JF, Wu WT, So KF, Pan GJ, Pei DQ. Generation of integration-free neural progenitor cells from cells in human urine. Nat Methods, 2013, 10(1): 84–89.
(责任编委: 吴志英)
The construction of urine-derived cell lines from patients with spinal muscular atrophy
Wanjin Chen, Qijie Zhang, Jin He, Xiang Lin, Ning Wang
Department of Neurology, First Affiliated Hospital, Fujian Medical University, Fuzhou 350005, China
Spinal muscular atrophy (SMA) is a common neurodegenerative disease in childhood and infancy, clinically characterized by progressive and symmetric muscular weakness and atrophy. Few effective therapies are available now, and SMA is one of the most common genetic causes of infantile mortality. SMA patient-derived cells are beneficial in basic research on this disease, but the most common model cell, fibroblasts can only be obtained through invasive procedures such as muscle or skin biopsy, which are unwelcome to patients and their families. In this study, fresh urine from SMA patients and healthy controls was collected and centrifuged, and the urine sediment was cultured in vitro. The growth characteristics of urine-derived cells were observed, and the survival of motor neu-ron (SMN) gene, and the amount and localization of SMN protein in different urine cell lines were investigated. In total, 25 urine cell lines from 11 SMA patients and 14 healthy controls were established. These urine-derived cells expand robustly in vitro with stable cell morphological characteristics. The urine cell lines derived from patients carry the SMN1 gene defect and express a low level of SMN protein, while the intracellular localization of SMN protein is normal. Urine-derived cell culture technology is simple, non-invasive and highly reproducible, a way of obtaining and storing rare cell samples from SMA patients with which to study the pathogenesis of SMA.
spinal muscular atrophy; survival of motor neuron protein; urine; cell culture
2014-07-01;
2014-08-13
国家自然科学基金项目(编号:81322017,81371261),福建省自然科学基金杰出青年基金项目(编号:2012J06016)和国家临床重点专科建设项目资助
陈万金,副主任医师,研究方向:神经遗传病。E-mail: wanjinchen75@mail.fjmu.edu.cn
王柠,主任医师,教授,博士生导师,研究方向:神经遗传病与脑血管病。E-mail: ningwang@mail.fjmu.edu.cn
10.3724/SP.J.1005.2014.1168
时间: 2014-10-8 05:00:02 PM
URL: http://www.cnki.net/kcms/detail/11.1913.R.20141008.1700.005.html
