高效液相色谱法测定糖化酶中葡萄糖苷转移酶的活性
2014-05-08李双花陈茵佳
李双花, 冯 思, 陈茵佳, 李 彤,2*
(1.大连依利特分析仪器有限公司,辽宁大连116023;2.辽宁大连依利特分析仪器工程技术研究中心,辽宁大连116023)
在发酵法生产的糖化酶中常常含有葡萄糖苷转移酶(简称转苷酶),而在糖化酶催化麦芽糖和淀粉生产葡萄糖的过程中,它可打开麦芽糖的α-1,4键,并将游离出的一个葡萄糖残基转移到另一个葡萄糖或麦芽糖的α-1,6键上,生成潘糖或异麦芽糖等低聚糖,从而大大影响葡萄糖产品的纯度和产量,同时异麦芽糖的存在也会阻碍葡萄糖结晶[1,2]。所以控制糖化酶中转苷酶的活性,将有助于控制葡萄糖产品的质量。
目前转苷酶活性的测定方法有酶法[3,4]、分光光度法[5]、滴定法[6,7]等,但未见有高效液相色谱法测定的报道。酶法测定往往会出现不专一的情况,且易受到干扰;分光光度法则需要衍生,操作繁琐;滴定法是通过显色反应来测定的,而肉眼观察颜色变化的误差较大。高效液相色谱法测定具有准确、稳定的优点,且易于实现自动化[8],常被应用于糖类样品的分析[9,10]。本文以麦芽糖为底物,阿卡波糖为糖化酶抑制剂,采用SUGAR SH1011色谱柱、示差折光检测器的高效液相色谱法对糖化酶中转苷酶的活性进行测定,获得了较好的结果。
1 实验部分
1.1 仪器与试剂
P230高压恒流泵、EC2000色谱数据工作站(大连依利特分析仪器有限公司)。
葡萄糖(分析纯,纯度99.9%)、潘糖(分析纯,纯度99.9%)、麦芽糖(分析纯,纯度99.5%)、冰乙酸(分析纯,纯度99.5%)、浓硫酸(分析纯)(天津科密欧);阿卡波糖(拜耳医药保健有限公司);糖化酶样品1、2、3(湖南长沙某公司);去离子水(自制,Milli-Q超纯水纯化系统过滤)。
1.2 色谱条件
色谱柱为SUGAR SH1011色谱柱(300 mm×8.0 mm,6 μm;日本 Shodex公司),流动相为0.01 mol/L硫酸溶液,流速为0.6 mL/min,进样量为20 μL,柱温为60℃,检测器为RI-201H示差折光检测器(日本Shodex公司)。
1.3 活性测定
样品处理方法:移取0.4 mL 0.75 g/L阿卡波糖缓冲液(用20 mol/L醋酸缓冲液(pH 4.8)溶解)和0.1 mL糖化酶稀释液(将糖化酶原液用去离子水稀释20倍)置于10 mL具塞试管中,涡旋混匀;将试管放于37℃水浴中平衡10 min,吸取0.5 mL 20%(质量分数)麦芽糖溶液(用20 mol/L醋酸缓冲液(pH 4.8)溶解)置于试管中,涡旋混匀,然后将试管放入37℃水浴中,培养20 h后取出,在开水中煮沸10 min灭酶,冷却至室温;加入9 mL流动相,充分混匀,过0.45 μm滤膜。
空白处理方法:移取0.4 mL前述0.75 g/L阿卡波糖缓冲液和0.1 mL糖化酶稀释液置于10 mL具塞试管中,涡旋混匀;将试管放于37℃水浴中平衡10 min,涡旋混匀,然后将试管放入37℃水浴中,培养20 h后取出,在开水中煮沸10 min灭酶,冷却至室温;吸取0.5 mL 20%(质量分数)麦芽糖溶液于试管中,混合均匀;加入9 mL流动相,充分混匀,过0.45 μm 滤膜。
潘糖标准储备液处理方法:称取1.0 g(精确到0.001 g)潘糖于100 mL容量瓶中,加入流动相稀释到刻度,配成质量浓度为10 g/L的标准储备液。
由于产生的三糖较多,本方法中以潘糖为代表。通过液相色谱分析,得到样品溶液和空白溶液中潘糖的峰面积之差,采用外标法定量,求得潘糖的转化量,从而间接测得转苷酶的活性。
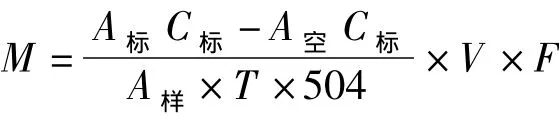
式中:M为转苷酶活性(单位:U);A样为样品溶液中潘糖的峰面积(单位:mV·s);A空为空白溶液中潘糖的峰面积(单位:mV·s);A标为标准溶液中潘糖的峰面积(单位:mAU·s);C标为标准溶液中潘糖的质量浓度(单位:g/L);V为样液最终定容体积(单位:mL);T为培养时间(单位:min);F为糖化酶稀释倍数。
2 结果与讨论
2.1 色谱条件的选择
高效液相色谱法测定糖类化合物含量具有快速、灵敏等优点,故常用来测定糖类化合物。氨基柱常被用来测定糖类化合物,但采用氨基柱时流动相中含有乙腈,分析成本高,环境污染大,而且以乙腈/水体系为流动相容易出现示差检测器基线波动大、平衡慢的问题,所以本实验选择SUGAR SH1011色谱柱,以硫酸水溶液为流动相测定潘糖含量。实验结果表明当硫酸浓度为0.01 mol/L时,葡萄糖、麦芽糖、潘糖和杂质分离效果较好(见图1)。
2.2 培养介质、pH及培养时间的选择
阿卡波糖在pH 4.8时抑制糖化酶的效果最佳,转苷酶的转苷最佳 pH为5.5[11]。综合考虑选择pH 4.8的醋酸缓冲液作为样品及空白溶液的培养介质。
转苷酶在一定条件下将麦芽糖转化为潘糖等三糖。从图2中可以看出,随着培养时间的增长,酶解产生的潘糖逐渐增多,但是在20 h之内的增长速度较快;在20 h之后,随着麦芽糖浓度的下降和产生三糖浓度的增高,增长速度变缓慢。考虑到时间关系,本文选择培养时间为20 h。
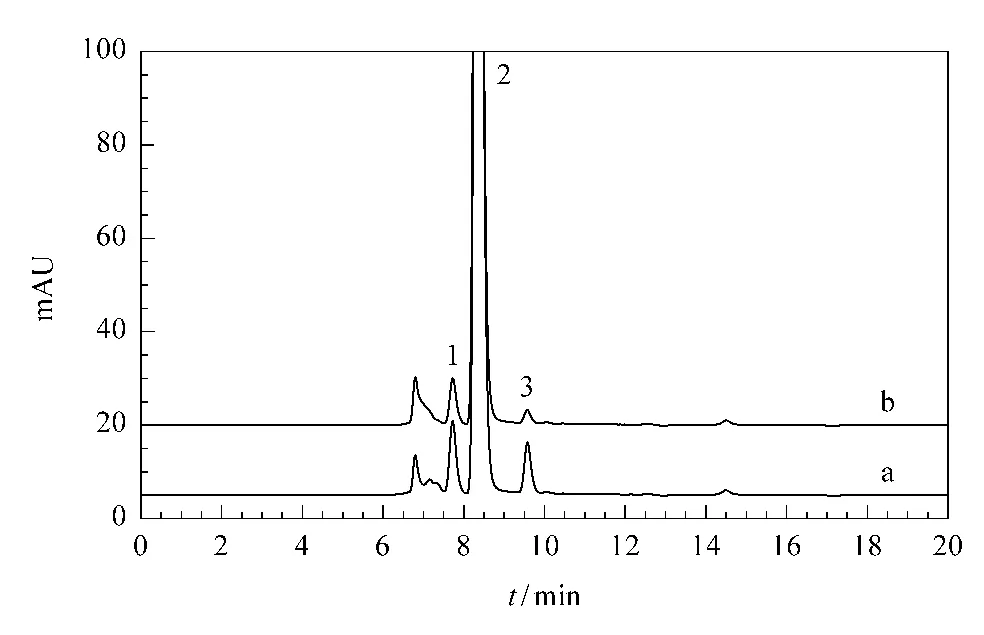
图1 (a)糖化酶样品及(b)空白溶液的HPLC谱图Fig.1 Chromatograms of(a)a diastatic enzyme sample and(b)a blank solution1.panose;2.maltose;3.glucose.
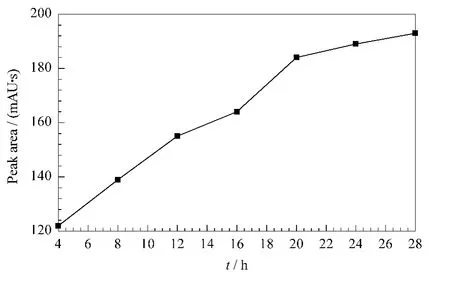
图2 培养时间对潘糖转化量的影响Fig.2 Effect of the incubation time on the transformation of panose
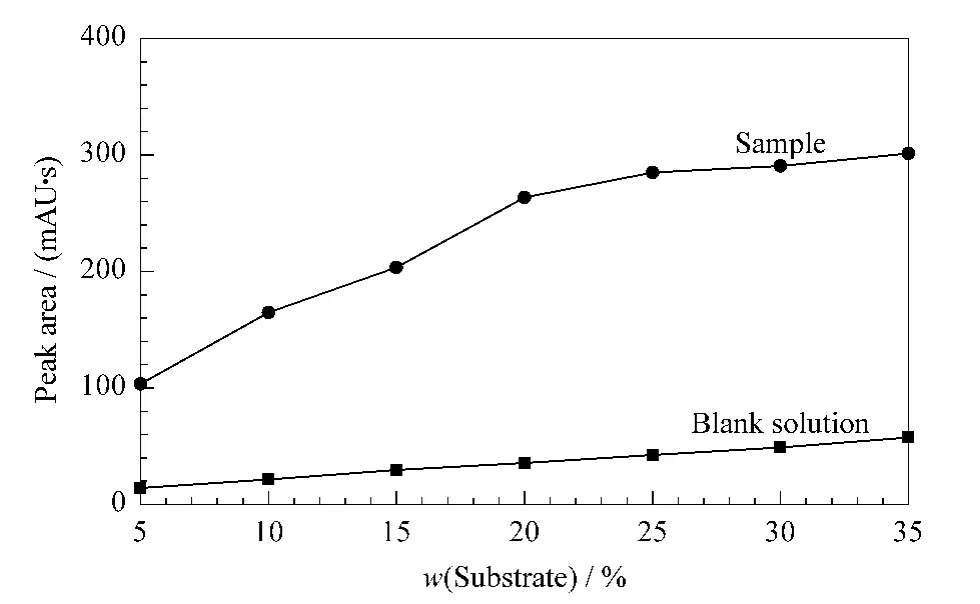
图3 底物(麦芽糖)的浓度对潘糖转化量的影响Fig.3 Effect of the concentration of substrate(maltose)on the transformation of panose
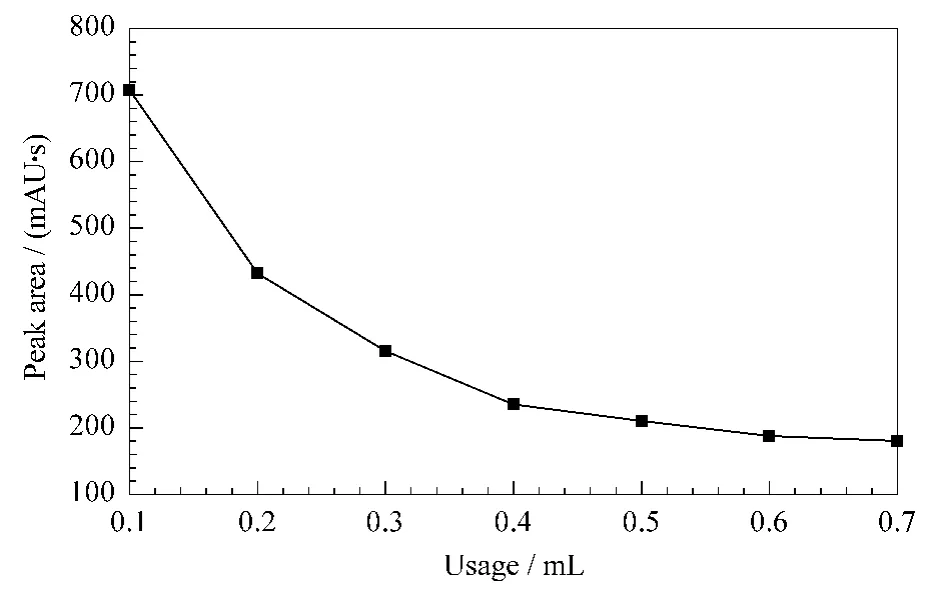
图4 抑制剂(0.75 g/L阿卡波糖)用量对葡萄糖转化量的影响Fig.4 Effect of usage of the inhibitor(0.75 g/L acarbose)on the transformation of glucose
2.3 底物(麦芽糖)浓度的选择
由化学动力学原理可知,只要底物浓度足够大,即可保证麦芽糖分解产生的三糖浓度只与酶浓度有关,而与麦芽糖浓度无关。但麦芽糖底物中常含有游离的三糖,随着麦芽糖浓度的增大,游离三糖的量也随之增大,导致空白值较高而影响测定结果。通过实验发现麦芽糖的质量分数为20%时较为合适(见图3),此时底物浓度已足够高,但空白溶液中游离三糖的浓度不是很高,不至于影响测定结果。
2.4 抑制剂(阿卡波糖)用量的选择
实验中阿卡波糖的作用是抑制糖化酶将麦芽糖转化为葡萄糖。实验结果表明,随着阿卡波糖用量的增大,产生葡萄糖的量逐渐下降。本实验使用阿卡波糖的质量浓度为0.75 g/L,当阿卡波糖的用量为0.4 mL时,产生葡萄糖的量基本趋于平衡(见图4),所以选择阿卡波糖的用量为0.4 mL。
2.5 潘糖标准溶液的线性关系及转苷酶活性的检出限、定量限
用流动相逐级稀释10 g/L潘糖标准储备液得到一系列浓度的标准溶液,分别进行分析。实验表明,在0.1~10 g/L范围内,其质量浓度X(g/L)与峰面积 Y呈良好的线性关系,相关系数 r为0.999 8,线性方程为Y=489.53X+7.61。分别按3倍信噪比(S/N=3)、10倍信噪比(S/N=10)确定转苷酶活性检出限为0.013 U、定量限为0.043 U。
2.6 方法的精密度
应用建立的方法对2号糖化酶样品重复6次测定。6次平行测定的RSD为0.63%,表明方法的重复性较好。
2.7 实际样品的测定
将糖化酶样品用去离子水稀释20倍,按照1.3节的方法处理,在1.2节的色谱条件下进行测定,得到糖化酶样品1、2、3中转苷酶的活性分别为3.91、3.91、1.03 U。
3 结论
采用高效液相色谱法测定糖化酶中转苷酶的活性具有分析速度快、操作简单、重复性好等优点。实验对底物浓度、培养时间等条件进行了优化。采用建立的方法对不同批次糖化酶中转苷酶的活性进行了测定,取得了良好的结果,为糖化酶的研究和质量控制提供了依据。
[1] Zhang S M,Wang H J,Lü Y,et al.Journal of Henan Agricultural University(张世敏,王会娟,吕洋,等.河南农业大学学报),2006,40(5):520
[2] Wang L D.Grain Processing(王良东.粮食加工),2008,33(6):65
[3] QB 2521-2001
[4] Zhang Q.[MS Dissertation].Zhengzhou:Zhengzhou University(张茜.[硕士学位论文].郑州:郑州大学),2011
[5] Zhao K,Lou Z H.Light Industry Science and Technology(赵柯,楼志华.轻工科技),2013(12):19
[6] Chen Y P,Wang Y,Hu X Z.Journal of Wuxi University of Light Industry(陈烨璞,汪云,胡学铮.无锡轻工大学学报),1998,17(3):86
[7] Lin W X,Yun X,Liu Y X,et al.Journal of Dalian Institute and Light Industry(林维宣,云霞,刘英新,等.大连轻工业学院学报),1996,15(1):73
[8] Fan H M,Yu S,Tang Y F.Journal of Food Safety and Quality(樊惠民,余实,谭远方.食品安全质量检测学报),2011,2(3):174
[9] Dai J.Chinese Journal of Chromatography(戴军.色谱),2012,30(2):113
[10] Zou Y H,Ju H F,Chen A Y.Journal of Instrumental Analysis(邹耀洪,居红芳,陈爱英.分析测试学报),2005,21(3):34
[11] Bi J F,Huang Y.Science and Technology of Food Industry(毕金峰,黄颖.食品工业科技),2004,25(2):119
