新型键合纤维素手性固定相的制备及其拆分性能评价
2014-05-08涂鸿盛华江颖章伟光
涂鸿盛, 范 军*, 谭 艺, 林 纯, 华江颖, 章伟光,*
(1.华南师范大学化学与环境学院,广东广州510006;2.广州研创生物技术发展有限公司,广东广州510663)
手性固定相-高效液相色谱(HPLC)直接拆分对映异构体技术是当今手性样品分离和分析的重要手段之一[1,2]。理想的手性固定相应具有较好的手性识别能力和较高的对映体选择性,能适用于多种结构类型的对映体分离[3]。其中,基于纤维素-三(3,5-二甲基苯基氨基甲酸酯)和直链淀粉-三(3,5-二甲基苯基氨基甲酸酯)等的涂覆型手性固定相(如Chiralcel OD和Chiralpak AD)已成功用于多种手性化合物的拆分[4,5]。但涂覆型手性固定相不耐高压,且溶剂耐受性差,在一些非常规流动相溶剂(如四氢呋喃、氯仿、二氯甲烷、丙酮、乙酸乙酯等)中,涂覆在硅胶表面的多糖衍生物会溶胀,甚至溶解,手性柱的分离性能骤降[3]。为了拓展多糖衍生物手性固定相的应用范围,Okamoto 等[6-8]、Kimata等[9]和 Francotte[10]分别研发了键合型多糖手性固定相的制备。与传统的涂覆型手性固定相材料相比,键合型手性固定相中手性选择剂与硅胶基质间通过化学键结合,化学稳定性显著提高,溶剂耐受性更好,流动相和样品溶剂的选择更多。目前已有公司相继推出了一系列键合型多糖手性柱产品,如Chiralpak IA-IF[11,12]。
与通过二异氰酸酯与硅胶键合的方法[6]、自由基共聚反应法[9]和光化学合成法[10]等相比,施陶丁格(Staudinger)反应法[13-15]具有条件温和、过程易控制和重现性好的特点。Zhang等[16]利用该方法制备了键合6-叠氮-6-脱氧纤维素-苯基氨基甲酸酯的手性固定相。本课题组也曾制备了以6-叠氮-6-脱氧纤维素(或直链淀粉)-3,5-二甲基苯基氨基甲酸酯为手性选择剂的键合型多糖手性固定相[17,18]。本研究采用施陶丁格反应将6-叠氮-6-脱氧纤维素-3,5-二氯苯基氨基甲酸酯键合到氨丙基硅胶上,得到了一种新的键合型手性固定相(命名为ImCel),并研究了其手性分离性能,探讨了非常规流动相溶剂与糖单元上取代基对固定相分离性能的影响。
1 实验部分
1.1 仪器与试剂
岛津SPD-15C高效液相色谱系统,配有紫外检测器、带20 μL定量环的7725i进样器和N2000工作站(日本岛津公司);Spectrum One红外光谱仪、TGA7热分析仪、2400 CHN元素分析仪(美国Perkin-Elmer公司)。
微晶纤维素(分析纯,上海国药化学试剂有限公司);裸硅胶(5 μm,30 nm,日本Fuji Silysia化学有限公司);3,5-二氯苯异氰酸酯(濮阳市宏大圣导新材料有限公司);正己烷、异丙醇、乙醇(色谱纯,天津科密欧化学试剂有限公司),三氟乙酸、二乙胺(色谱纯,上海晶纯生化科技股份有限公司);其他试剂均为国产分析纯。在固定相合成实验中,吡啶、甲苯、四氢呋喃用标准方法脱水干燥后使用。20种手性化合物样品结构式如图1所示,由广州研创生物技术发展有限公司提供。
1.2 ImCel的制备
ImCel的合成路线如图2所示。参考文献[18]方法得到6-叠氮-6-脱氧纤维素(Ⅰ)。将化合物Ⅰ(1.00 g)均匀分散在90 mL无水吡啶中,加入过量的3,5-二氯苯异氰酸酯(7.00 g,为纤维素上羟基物质的量的2倍用量),100℃下反应48 h。蒸除吡啶后加入甲醇,析出固体,得到6-叠氮-6-脱氧纤维素-3,5-二氯苯基氨基甲酸酯(Ⅱ)。参考文献[13,14]方法制备氨丙基硅胶。在氨丙基硅胶(4.00 g)上均匀涂敷化合物Ⅱ(1.00 g),然后超声分散于30 mL甲苯中。逐滴加入15 mL含三苯基膦(Ph3P,2.00 g)的甲苯溶液,CO2环境下过夜反应。过滤,依次用丙酮和四氢呋喃洗涤,最后真空干燥过夜得到目标产物ImCel。
1.3 色谱柱填装
将ImCel均匀分散于正己烷-异丙醇溶液(80∶20,v/v)中,以正己烷-异丙醇溶液(90∶10,v/v)为顶替液,在45 MPa压力下采用匀浆法将其装入不锈钢柱管(150 mm×4.6 mm)中。
1.4 色谱条件和计算
液相色谱分离实验在室温下进行。样品用乙醇溶解,流动相使用前经过滤及超声脱气处理。检测波长为254 nm,未注明时流动相的流速为1.0 mL/min。
保留因子k=(tR-t0)/t0,其中tR为样品在柱上的保留时间,t0为死时间。分离因子α=k2/k1,其中k1和k2分别为第1个和第2个洗脱对映异构体的保留因子。分离度Rs=2(tR2-tR1)/(w2+w1),其中tR1和tR2分别为第1个和第2个洗脱对映异构体的保留时间,w1和w2分别为相应对映异构体色谱峰的半峰宽[13,14]。
2 结果与讨论
2.1 手性选择剂及手性固定相的表征
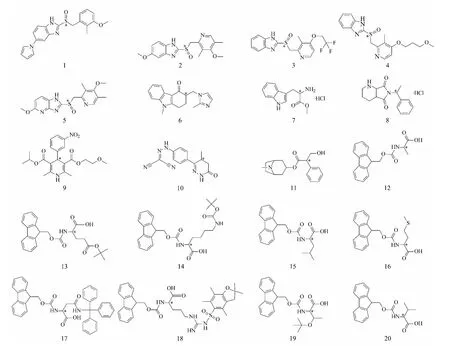
图1 20种手性化合物的结构示意图Fig.1 Structures of 20 chiral compounds
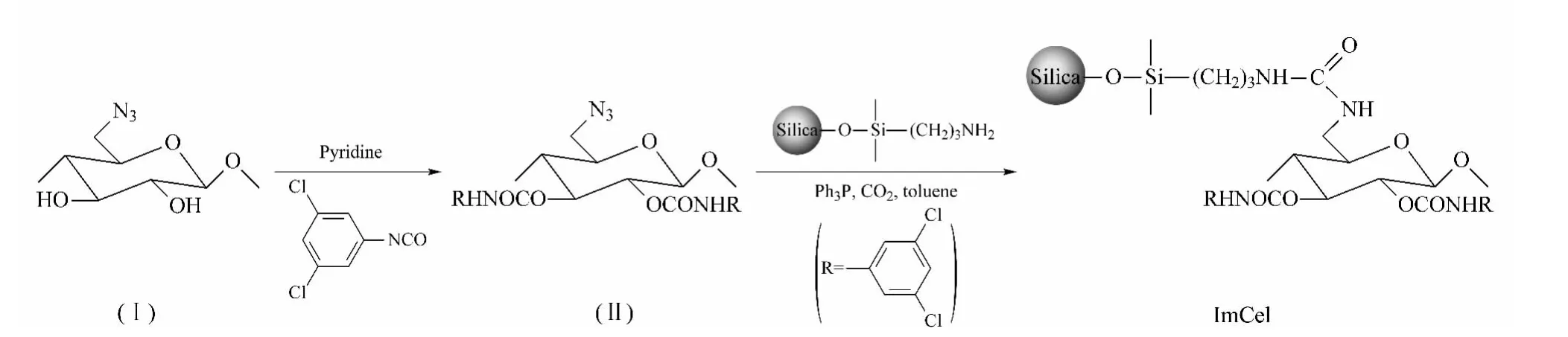
图2 ImCel的合成路线图Fig.2 Synthetic route of the ImCel
对实验中制备的手性选择剂(化合物Ⅱ)和手性固定相材料进行红外光谱表征。在化合物Ⅱ中,3 350 cm-1附近O-H伸缩振动峰的强度变弱,在3 319 cm-1处出现 N-H的特征吸收峰,在2 112 cm-1处出现N3的特征吸收峰,在1 735 cm-1处出现C=O的特征吸收峰。在ImCel的红外光谱中,2 100 cm-1附近的吸收峰消失,1 038 cm-1处出现Si-O-Si的特征吸收峰,纤维素单元上的其他特征吸收带(C=O和N-H)仍可观察到。
对氨丙基硅胶、化合物Ⅱ及手性固定相分别进行了元素分析。化合物Ⅱ的结果为:C 67.34%、H 6.58%、N 1.01%;ImCel的结果为:C 7.24%、H 0.98%、N 1.05%。与氨丙基硅胶的元素分析结果(C 4.19%、H 0.81%、N 2.73%)相比,在制备得到的手性固定相中,碳含量明显增加。另一方面,由热重分析结果可知,从室温到800℃范围内,ImCel的失重百分数为20.54%,氨丙基硅胶在相同温度范围内的失重百分数为5.57%。这些结果都表明,在发生施陶丁格反应后,手性选择剂(即化合物Ⅱ)被有效结合到硅胶表面。
2.2 ImCel的分离性能
研究了ImCel对20种手性化合物的分离性能,分析结果见表1。其中17对手性化合物得到了基线分离(分离度Rs≥1.5)。在流动相的选择上,除样品6和18外,其余15种样品在正己烷-醇的流动相条件下均可实现基线分离。此外,ImCel在反相条件下也具有较好的手性分离性能[11,19,20],如样品2在流速为0.7 mL/min的甲醇-醋酸/三乙胺缓冲溶液(0.1%,v/v,pH 4.8)(70∶30,v/v)条件下的Rs为1.89,α为1.36;样品6在流速为0.7 mL/min的乙腈-醋酸/三乙胺缓冲溶液(0.1%,v/v,pH 5.4)(70∶30,v/v)条件下的 Rs为1.80,α 为1.32;样品19在流速为0.7 mL/min的甲醇-水-三氟乙酸(75∶25∶0.1,v/v/v)条件下的 Rs为 2.22,α 为1.48。对比可知,ImCel在正相条件下的分离性能优于其在反相条件下的分离性能,所以后续工作主要在正相条件下进行。
多糖衍生物手性固定相对手性分子的识别关键在于固定相与底物分子间的相互作用(如氢键、偶极-偶极相互作用、π-π作用等)和多糖自身高度有序的结构[20]。ImCel上同时有脲键、酯基和芳环等官能团,极性的苯氨基甲酸酯基能够围绕纤维素主链形成螺旋沟槽[20];而拉唑类化合物(样品1~5)中同样含有O、N等原子及芳环,易与手性固定相发生相互作用,从而得到良好的拆分。拉唑类化合物样品的Rs均在3.0以上(见表1)。
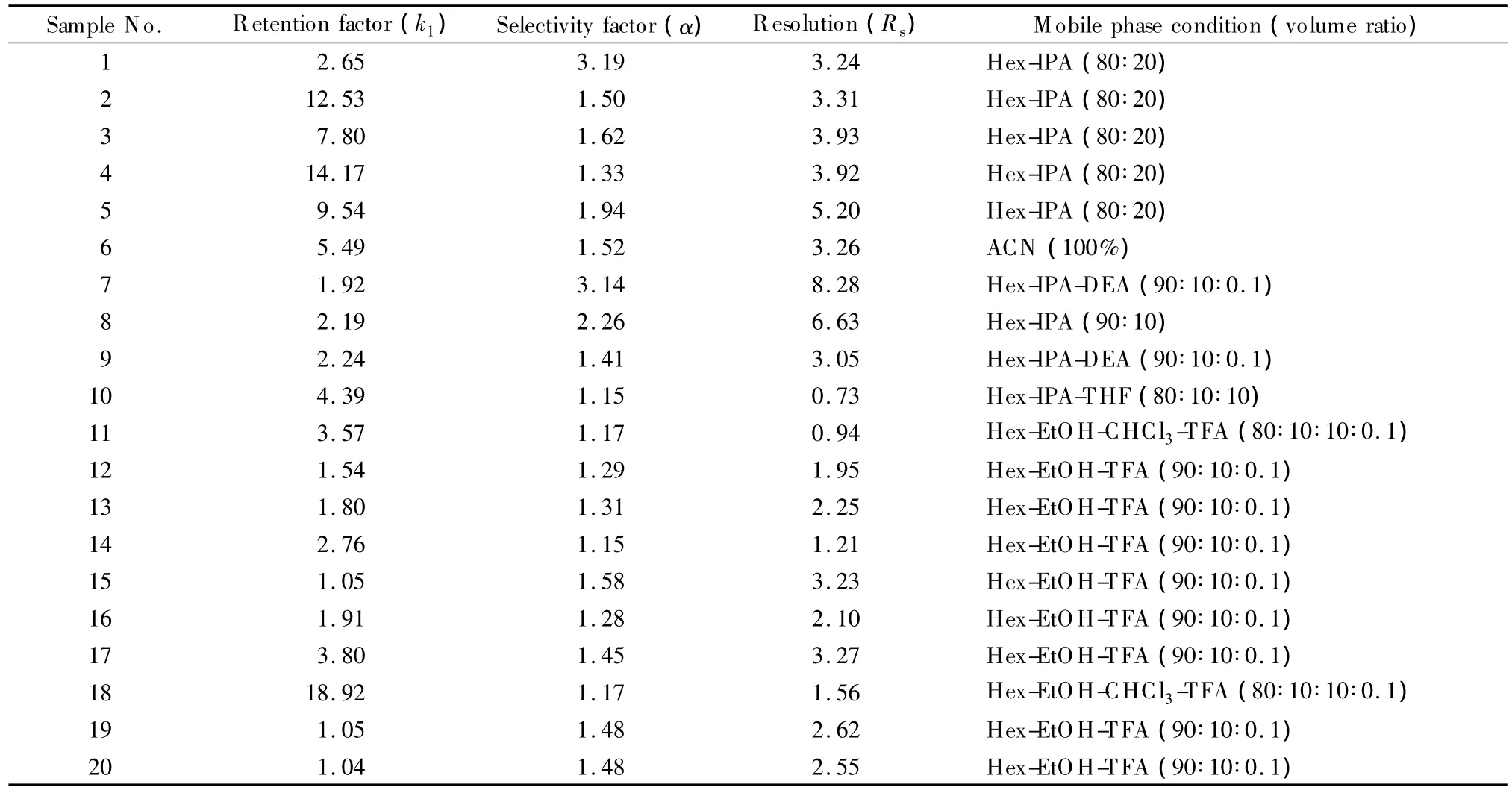
表1 ImCel对20种手性化合物的HPLC拆分条件与分离结果Table 1 Conditions and the separation performances on ImCel for 20 chiral compoundsby HPLC under optimized conditions
2.3 非常规流动相溶剂对ImCel分离性能的影响
与涂覆型手性固定相相比,键合型多糖手性固定相对溶剂耐受性好,适用于更多的流动相体系[11,12,20]。在本研究中,以 Hex-EtOH-TFA(80∶20∶0.1,v/v/v)和 Hex-IPA(80∶20,v/v)为基础,以10%(v/v)的非常规流动相溶剂(如氯仿、四氢呋喃和乙酸乙酯等)替代10%(v/v)的醇得到新的流动相,分别考察ImCel在新流动相条件下对样品10~20的分离情况。结果表明,相对于丙酮、四氢呋喃、乙酸乙酯和二氯甲烷等溶剂,在流动相中加入氯仿可明显提高ImCel对手性样品的分离能力。因此,本研究主要考察添加氯仿对固定相手性识别能力的影响。
如表2所示,添加非常规流动相溶剂后,ImCel对样品10、11、14和18的分离能力明显增强。在流动相Hex-IPA(80∶20,v/v)中,样品10的两种对映体同时被洗脱,无法得到拆分;添加10%THF后,样品10在 ImCel上的保留增强,分离度增大到0.73(见图3a)。样品18在Hex-EtOH-TFA(80∶20∶0.1,v/v/v)的流动相中分离度仅为0.69,添加氯仿后,分离度增大到1.56(见图3b)。此外,添加氯仿对这些样品分离的影响不完全相同,除样品17外,其余样品的分离因子都增大,但分离度的变化趋势略有不同。
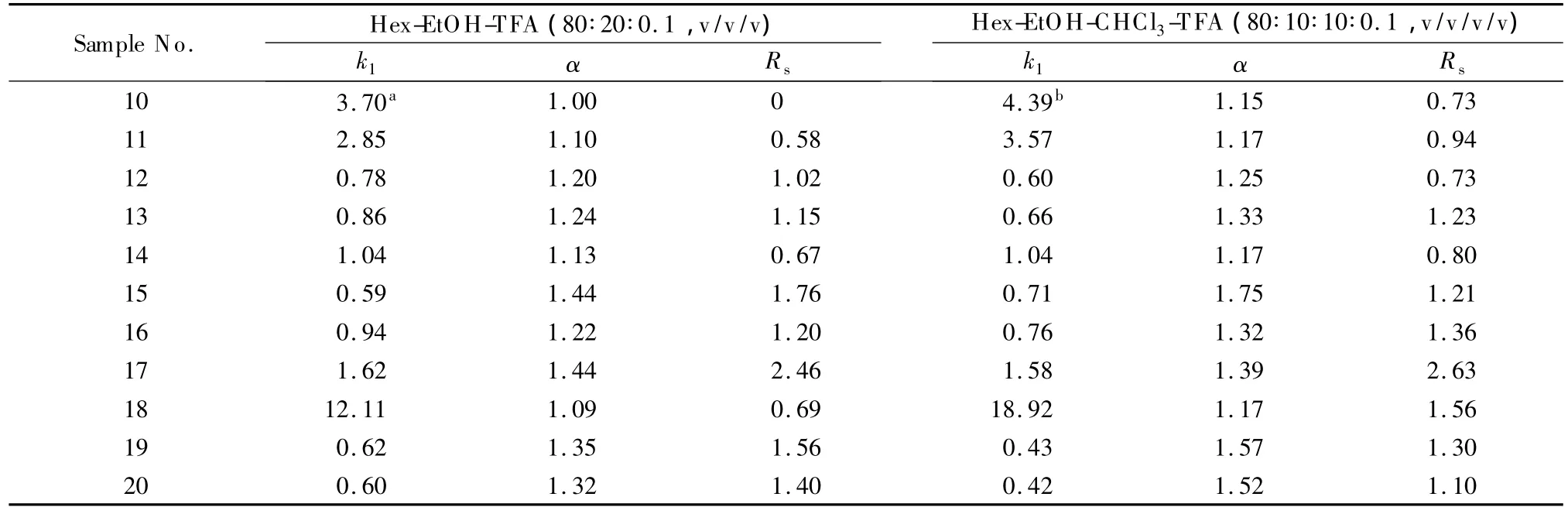
表2 非常规流动相溶剂对ImCel分离性能的影响Table 2 Effects of non-standard solvents on the separation performance of the ImCel
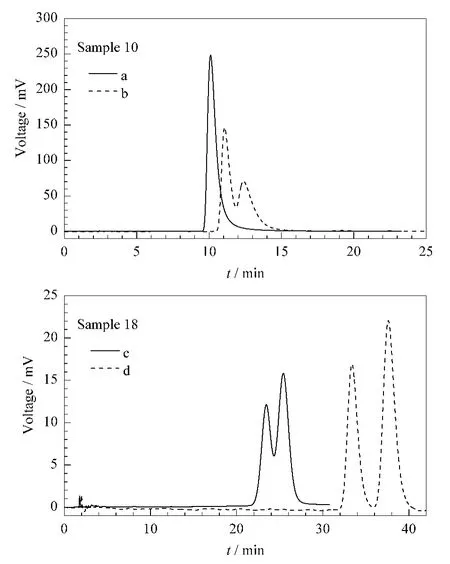
图3 样品10和18在不同流动相中的分离色谱图Fig.3 Chromatograms of samples 10 and 18 under different mobile phase conditionsMobile phases:a.Hex-IPA(80∶20,v/v);b.Hex-IPA-THF(80∶10∶10,v/v/v);c.Hex-EtOH-TFA(80∶20∶0.1,v/v/v);d.Hex-EtOH-CHCl3-TFA(80∶10∶10∶0.1,v/v/v/v).
2.4 糖单元上取代基对固定相分离性能的影响
此前,本实验室报道了一种以6-叠氮-6-脱氧纤维素-(3,5-二甲基苯基氨基甲酸酯)为手性选择剂的键合型手性固定相(命名为RC-IB)[18]。RC-IB和ImCel都以纤维素为原料,通过施陶丁格反应将手性选择剂键合到硅胶上;不同的是,RC-IB苯环上的3,5-位氢原子被甲基取代,而ImCel苯环上的3,5-位氢原子被氯原子取代。在流动相为 Hex-EtOH-TFA(90∶10∶0.1,v/v/v)的条件下,研究这两种固定相对一系列芴甲氧羰基(fmoc)-氨基酸衍生物(12~20)分离性能的差异,以探讨纤维素糖单元上取代基团对分离性能的影响,结果如表3所示。
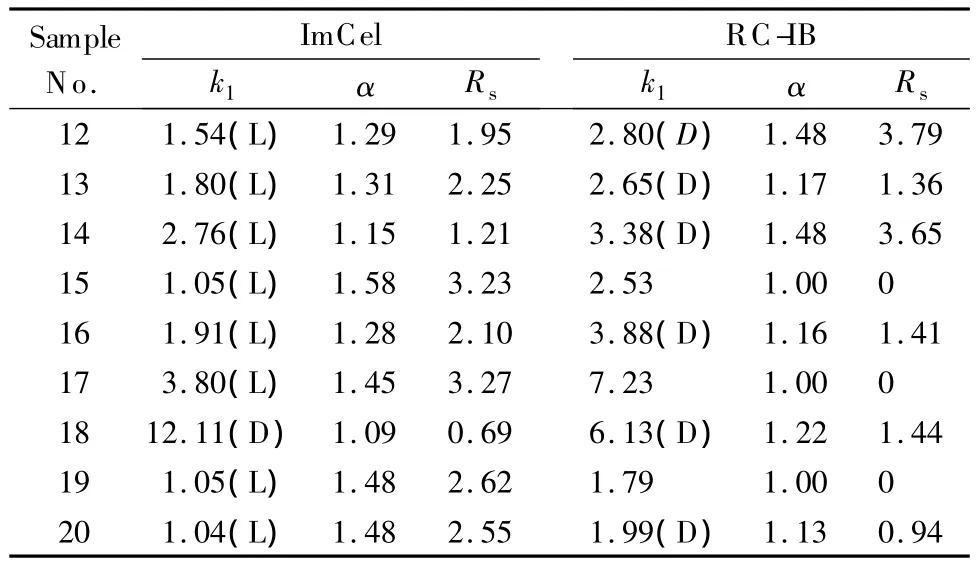
表3 样品12~20在ImCel和R C-IB上的拆分结果Table 3 Chromatographic data for samples 12-20 on ImCel and R C-IB
从样品的保留情况分析,除样品18外,其余样品在RC-IB上的保留因子都比在ImCel上的大,说明样品在RC-IB上的保留较强。从拆分结果分析,RC-IB对样品12、14和18表现出良好的识别能力,相应的分离度和分离因子都优于ImCel柱,但对样品15、17和19无分离趋势。ImCel对这一系列fmoc-氨基酸衍生物都表现出良好的识别能力,其中对样品13、15~17、19和20的拆分性能明显优于RC-IB。
虽然两种手性固定相的骨架结构、基质材料、键合方式相同,衍生官能团(即苯氨基甲酸酯)相似,与底物分子间形成的相互作用力(如氢键、偶极-偶极相互作用和π-π作用等)相似,但苯环上的取代基会影响芳环及相邻官能团的电荷密度,从而影响固定相与底物间的相互作用,进而影响其手性拆分性能。对于RC-IB,甲基的存在使苯环的π-电子密度增大,易与显π-酸性的底物分子产生π-π作用;对于ImCel,氯原子的吸电子效应引起苯环的π-电子密度降低,对邻近酰胺基的N-H键产生远程吸引作用,使得氢原子的电子密度降低,从而易与底物中的氢键给体产生氢键相互作用。这些相互作用都加强了固定相对手性底物的拆分性能[21],因此,Im-Cel和RC-IB间表现出一定的互补性。
由表3和图4可以看出,除样品18外,其余化合物在两种固定相上的洗脱顺序恰好相反,比如样品12和13的L型对映体在ImCel上的保留较弱,先于D型对映体被洗脱;而对于RC-IB,D型对映体则先于L型对映体被洗脱。对映体洗脱反转是高效液相色谱手性分离中一个非常有趣的现象,尽管文献报道改变手性选择剂的种类及固定方式[21]、柱温[22]、流动相的 pH 值[23,24]、有机添加剂的种类和比例[23,24]等条件可能引起对映体洗脱反转,但实际并不多见,目前对对映体洗脱反转现象尚难以解释和预测。
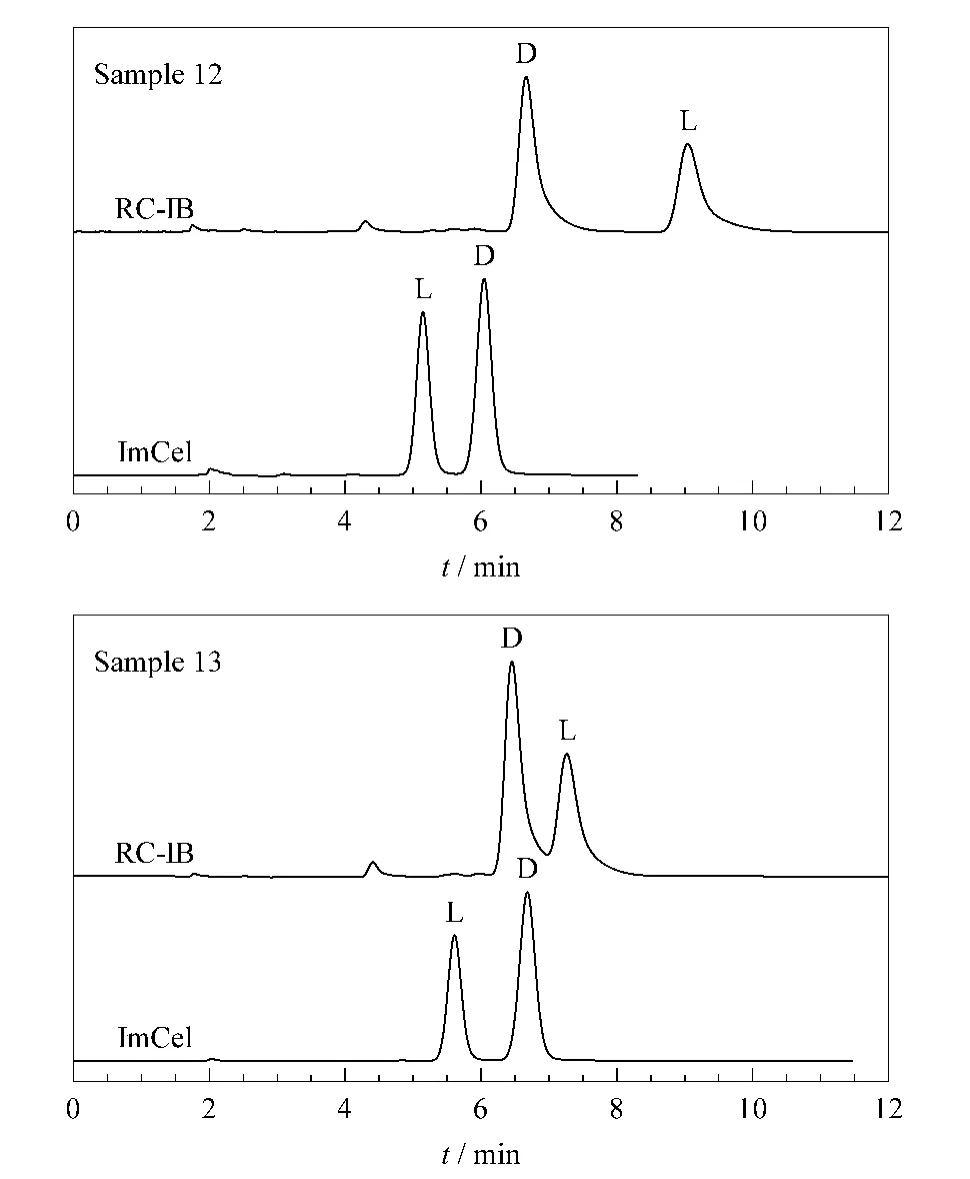
图4 ImCel和R C-IB对样品12和13的分离色谱图Fig.4 Chromatograms of samples 12 and 13 separated on ImCel and R C-IB,respectivelyMobile phase:Hex-EtOH-TFA(90∶10∶0.1,v/v/v).
3 结论
采用施陶丁格反应得到了一种新的键合型纤维素手性固定相ImCel,研究了其对20种手性化合物的拆分性能,讨论了添加非常规流动相溶剂对固定相分离性能的影响,研究了ImCel和RC-IB对一系列fmoc-氨基酸衍生物的分离性能差异,探讨了引起这些差异的原因。结果表明,ImCel对所选的手性化合物表现出了良好的分离性能,且添加非常规流动相溶剂可改善其对底物的识别能力。ImCel和RC-IB对一系列fmoc-氨基酸样品的分离具有互补性,并发现了手性固定相引起的对映体洗脱反转现象。
[1] Jin Z L,Hu F F,Wang Y B,et al.Chinese Journal of Chromatography(金召磊,胡芳芳,汪一波,等.色谱),2011,29(11):1087
[2] He X M,Yao Y Y,Ndorbor T,et al.Chinese Journal of Analytical Chemistry(何小梅,姚誉阳,Ndorbor Theophilus,等.分析化学),2013,41(8):1188
[3] Ikai T,Okamoto Y.Chem Rev,2009,109(11):6077
[4] Zhang C,Jin L X,Zhou S S,et al.Chirality,2011,23(3):215
[5] Zhang K,Xue N,Li L,et al.Chinese Journal of Chromatography(张恺,薛娜,李林,等.色谱),2010,28(2):215
[6] Okamoto Y,Aburatani R,Miura S,et al.J Liq Chromatogr,1987,10(8):1613
[7] Enomoto N,Furukawa S,Ogasawara Y,et al.Anal Chem,1996,68(17):2798
[8] Kubota T,Kusano T,Yamanoto C,et al.Chem Lett,2001,30(7):724
[9] Kimata K,Tsuboi R,Hosoya K,et al.Anal Methods Instrum,1993,1(1):23
[10] Francotte E R.J Chromatogr A,2001,906(1/2):379
[11] Zhang T,Franco P,Nguyen D,et al.J Chromatogr A,2012,1269:178
[12] Huang H,Jin J Y,Lee W J.Chinese Journal of Chromatography(黄虎,金京玉,李元宰.色谱),2009,27(4):467
[13] Lin C,Liu W N,Fan J,et al.J Chromatogr A,2013,1283:68
[14] Zhang Z B,Zhang W G,Luo W J,et al.J Chromatogr A,2008,1213(2):162
[15] Zhang L F,Wong Y C,Chen L,et al.Tetrahedron Lett,1999,40(9):1815
[16] Zhang S,Ong T T,Ng S C.Tetrahedron Lett,2007,48(31):5487
[17] Peng G M,Wu S Q,Fang Z L,et al.J Chromatogr Sci,2012,50(6):516
[18] Tan Y,Fan J,Lin C,et al.J Sep Sci,2014,37(5):488
[19] Xu X F,Guo Z M,Liang X M.Chinese Journal of Chromatography(徐雪峰,郭志谋,梁鑫淼.色谱),2012,30(11):1188
[20] Chankvetadze B.J Chromatogr A,2012,1269:26
[21] Chankvetadze L,Ghibradze N,Karchkhadze M,et al.J Chromatogr A,2011,1218(37):6554
[22] Yao B X,Zhan F P,Yu G Y,et al.J Chromatogr A,2009,1216(28):5429
[23] Wang T,Wenslow R M Jr.J Chromatogr A,2003,1015(1/2):99
[24] Wang Q Y,Xiong Y Y,Lu B Z,et al.J Sep Sci,2013,36(8):1343
