狂犬病病毒磷蛋白单抗的制备与应用
2014-04-13米立娟张守峰王述超扈荣良
米立娟,张守峰,刘 晔,王述超,扈荣良
(军事医学科学院军事兽医研究所 吉林省人兽共患病预防与控制重点实验室,长春 130122)
狂犬病病毒磷蛋白单抗的制备与应用
米立娟,张守峰,刘 晔,王述超,扈荣良
(军事医学科学院军事兽医研究所 吉林省人兽共患病预防与控制重点实验室,长春 130122)
以灭活的狂犬病病毒CVS株细胞毒免疫BALB/c小鼠,通过间接ELISA法和Western-blot筛选获得针对磷蛋白的单克隆抗体4株:1C9、4B10、2G12 、4G5,其中1C9针对氨基端保守表位。以亲和层析法纯化1C9单抗腹水,异硫氰酸荧光黄标记制备荧光抗体。以1C9磷蛋白荧光抗体与本实验室研制的狂犬病核蛋白免疫荧光抗原检测试剂盒,对本实验室收集的501份疑似狂犬病鼬獾、蝙蝠、犬和黄鼬的脑组织样品进行直接免疫荧光平行检测。结果显示,两种检测手段对基因1型狂犬病毒的检出结果完全一致,而蝙蝠源Irkut病毒仅能以磷蛋白单抗1C9检出。本研究成功获得了与我国现有不同基因型狂犬病毒良好反应的抗狂犬病磷蛋白单抗,并应用于狂犬病的直接免疫荧光检测,为狂犬病诊断提供了敏感性和可靠性良好的诊断试剂。
狂犬病病毒;磷蛋白单克隆抗体;荧光抗体
狂犬病(rabies)是由狂犬病病毒(Rabies virus, RV)感染中枢神经系统导致的致死性的人兽共患传染病。狂犬病病毒为弹状病毒科(Rhaboviridae)、狂犬病毒属(Lyssaavirus)成员,含有5种结构蛋白,分别编码核蛋白(nuclear protein,N)、磷蛋白(phosphoprotein,P)、糖蛋白(glycoprotein,G)、基质蛋白(matrix protein,M)和RNA聚合酶(RNA polymerase,L)。
狂犬病磷蛋白基因由894个核苷酸组成,编码297个氨基酸。在细胞中,通过核糖体渗漏扫描,P基因可以编码P1、P2(起始于20位氨基酸)、P3(起始于53位氨基酸)、P4(起始于69位氨基酸)、P5(起始于83位氨基酸)5种蛋白[1,2]。由于这五种蛋白氨基端核定位信号序列长度不一样,导致他们在细胞中的分布不同,从而行使不同的功能[3]。同时,近年来,科学家对RV磷蛋白功能的研究更加深入,Brzó zka等[4,5]发现磷蛋白可以阻断干扰素诱导因子3和7(IRF3/IRF7)的磷酸化及二聚化,进而阻断宿主干扰素信号通路,还可以通过阻止STAT1/STAT2向核内的转移阻断1型干扰素信号通路。同时,狂犬病病毒磷蛋白结构相对稳定,在细胞中的表达量仅次与核蛋白,因此,研制一种有效的RV磷蛋白单抗,对于研究狂犬病病毒各蛋白的功能及狂犬病病毒感染的诊断都有重要实际应用意义。
1 材料与方法
1.1 细胞、毒种与主要试剂RV弱毒株SRV9及强毒细胞适应株CVS-11、BHK-21细胞、小鼠骨髓瘤细胞(SP2/0)由本室保存;PEG4000、HRP标记的羊抗鼠二抗、RPMI-1640购自GIBCO BRL公司;HAT、HT、弗氏不完全佐剂与弗氏完全佐剂等购自Sigma公司;单克隆抗体亚型鉴定试剂盒购自PERSEN公司;IgG亲和纯化试剂nProte in A SepharoseTM 4 Fast Flow购自Pharmacia公司;DMSO为SERVA 公司产品;其他试剂均为国产或进口分析纯级。
1.2 小鼠免疫和杂交瘤细胞的建立用RV SRV9株脑毒,初免疫BALB/c小鼠(购自长春生物制品研究所实验动物中心),再用本室CVS-11细胞毒,超速离心后进行免疫。免疫程序如下:一免,100 μL 106TCID50的毒与等体积的弗氏完全佐剂充分混合,乳化,腹腔注射;二免、三免,取等量的病毒与等体积的弗氏不完全佐剂充分混合,每隔2周免疫1次;最后一次免疫3周后,再取300 μL等滴度病毒不加佐剂进行加强免疫,3 d后,取脾细胞与骨髓瘤细胞进行融合;细胞融合与筛选按常规方法进行[6],经4轮细胞克隆并对细胞克隆上清进行ELISA检测:CVS-11细胞毒作为阳性抗原,空白细胞为阴性抗原包被96孔酶标板,细胞克隆上清为一抗,HRP标记的羊抗鼠抗体为二抗。待阳性孔率达到100%时,对获得的杂交瘤细胞扩大培养,收集上清,细胞液氮冻存。
1.3 腹水制备基本步骤包括,利用灭菌液体石蜡腹腔注射BALB/c小鼠0.5 mL/只;取106个细胞/0.5 mL注入小鼠腹腔;2周左右腹腔明显膨大时,抽取腹水。
1.4 单克隆抗体的鉴定
1.4.1 单克隆抗体的亚型鉴定 按照单克隆抗体亚型鉴定试剂盒操作说明书,对得到的单克隆抗体进行亚型鉴定。
1.4.2 免疫印迹(Western-blot)分析 参照文献[7, 8]方法,用蛋白裂解液收集RV感染BHK-21细胞的蛋白为抗原,收集的未感染BHK-21细胞为阴性对照,在12% SDS聚丙烯酰胺凝胶中进行电泳,经半干法转印至PVDF膜上;以纯化的腹水分别为一抗,HRP标记的羊抗鼠IgG为二抗,进行免疫印迹反应分析。
1.5 抗体的纯化、荧光标记及荧光抗体工作浓度测定照Pharmac ia试剂说明,以亲和层析凝胶纯化小鼠腹水内抗体IgG,按文献[8]方法进行抗体的FITC 荧光标记。标记好的荧光抗体,以直接免疫荧光法[9]在接CVS-11毒株的BHK-21细胞上确定其工作浓度。
1.6 病料检测参照直接免疫荧光法[10]对犬27份、鼬獾292份、蝙蝠104份、黄鼬78份病料进行检测,同时用狂犬病核蛋白免疫荧光抗原检测试剂盒进行检测。
2 结果
2.1 杂交瘤细胞的获得与腹水的制备用狂犬毒强毒株CVS-11免疫BALB/c小鼠的脾细胞与SP2/0细胞融合后,细胞上清经间接ELISA检测,获得4株稳定分泌抗RV抗体的杂交瘤细胞,分别命名1C9、4810、2G12、4G5。这4株杂交瘤细胞经过扩增,注射小鼠腹腔;待小鼠腹部胀大,用5 mL注射器每3 d抽取1次腹水。腹水经10 000×g4 ℃离心10 min,取上清,于-80 ℃储存。
2.2 单抗亚型鉴定亚型鉴定结果显示,上述4株单抗均为IgG,其中的1C9株为IgG2a亚型。
2.3 单克隆抗体的Western-blot分析Western-blot分析表明,1C9株、4B10株单抗与RV反应只有1条40 kDa带;2G12株、4G5株单抗与RV反应有5条带,其中1条为40 kDa与磷蛋白大小一致,在26~34 kDa之间有3条带。这4株单抗均不与未感染RV的BHK-21细胞反应(图1)。
2.4 荧光抗体标记及工作浓度以亲和层析法对制备的小鼠腹水进行IgG 纯化,经SDS-PAGE 电泳证实,纯化产物仅呈现两条电泳带,即IgG 重链和轻链。每1 mL腹水纯化后的IgG 溶于3 mL PBS缓冲液内,经FITC 标记后,加终浓度为0.04%的叠氮钠防腐,4 ℃保存。经直接免疫荧光测定,该批次荧光抗体的工作浓度为1:900。染毒前后BHK-21细胞的直接免疫荧光检测效果见图2。
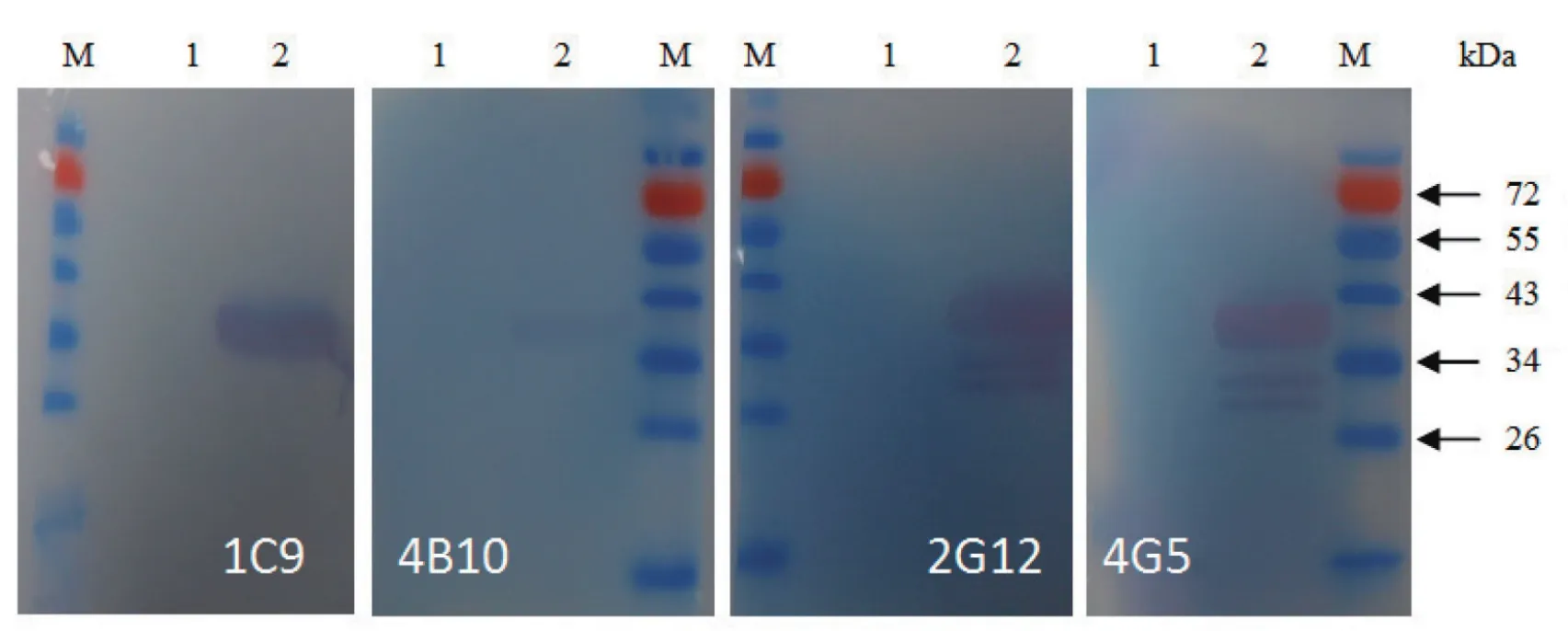
图1 4株单抗腹水分别与RV的Western-blot分析Fig.1 Western-blot analysis on monoclonal antibody reactivity to RV
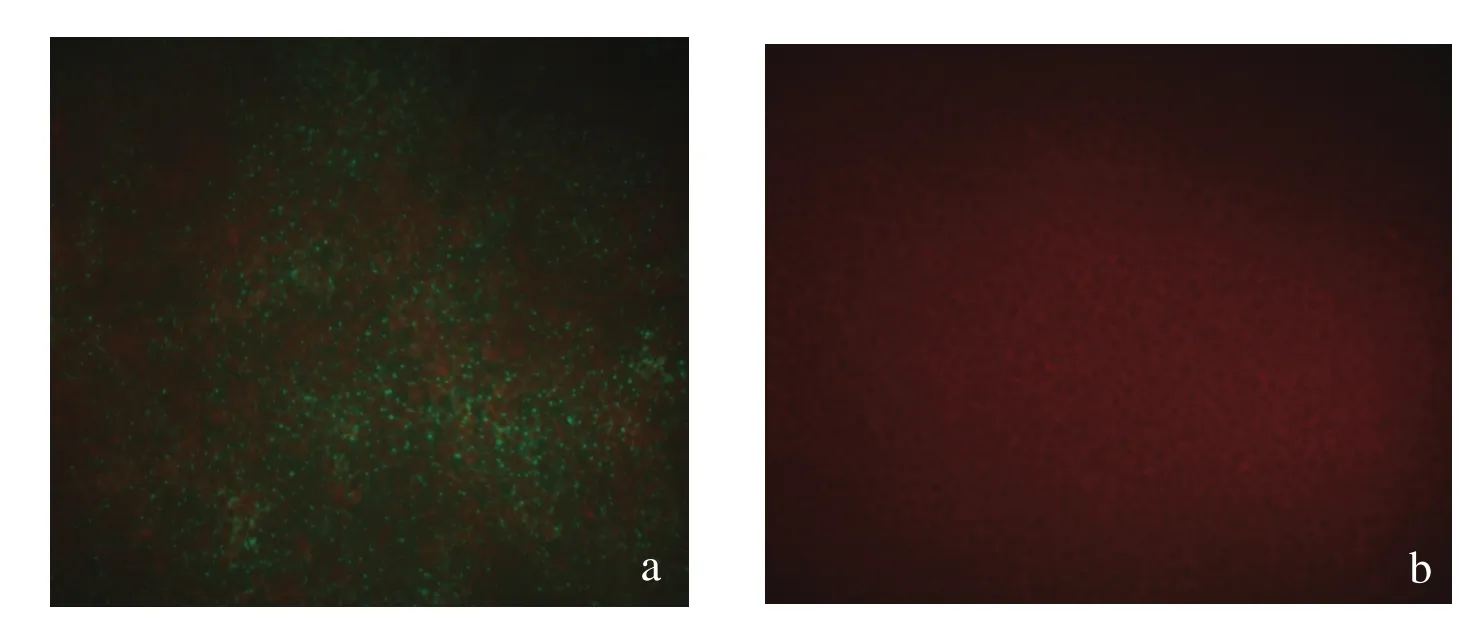
图2 病毒感染BHK-21细胞的直接免疫荧光结果Fig. 2 DFA result of BHK-21 cells infected or not infected with RV
2.5 病料检测结果磷蛋白荧光抗体按1:900的工作浓度,对犬27份、鼬獾292份、蝙蝠104份、黄鼬78份病料进行检测;同时,狂犬病核蛋白免疫荧光抗原检测试剂盒对同批样品进行了检测,结果见表1。

表1 DFA在疑似病料中检测结果Table 1 The results of RV in tissues samples by DFA
3 讨论
本实验获得的这4株杂交瘤细胞都是针对狂犬病毒磷蛋白的单克隆抗体。通过Western blot分析可知,这4株单抗均与RV感染细胞反应,而与不感染RV的细胞均不发生反应。其中1C9株、4B10株单抗与RV反应只有1条约40 kDa带,2G12株、4G5株单抗与RV反应有5条带,这与Chenik等[2]报道的狂犬病病毒磷蛋白多翻译起始现象一致。
狂犬病病毒磷蛋白基因在细胞中,利用核糖体渗漏扫描(leaky-scanning)可翻译出5种蛋白(p1、p2、p3、p4及p5),起始氨基酸位置分别为aa1、aa20、aa53、aa69和aa83[1,2]。DNAMAN软件预测,全长磷蛋白(p1)可能存在13个抗原表位,分布图3。
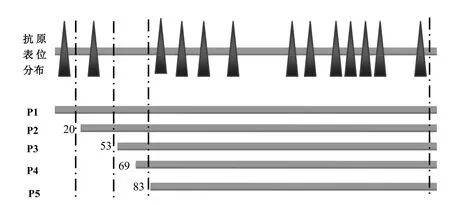
图3 P蛋白抗原表位预测图谱结果Fig. 3 Prediction result of antigenic epitopes for P protein
通过Western-blot分析可知,这4株单抗均与RV感染细胞反应,而与不感染RV的细胞均不发生反应。其中1C9株、4B10株单抗与RV反应只有1条约40 kDa带,故这两株单抗识别的抗原表位在aa1到aa20之间,即上图第一个抗原表位,此时,这两株单抗在蛋白印迹试验中只能识别p1,显示1条条带;2G12株、4G5株单抗与RV反应有5条带,故其识别的抗原表位在aa83之后,这些抗原表位可同时识别p1、p2、p3、p4及p5,显示5条条带,其中第4条与第5条条带因大小接近,在蛋白印迹试验图片中肉眼不可区分。
RV的结构蛋白中,磷蛋白的遗传稳定性较强,不同毒株之间抗原表位的同源性也较高[10],氨基酸同源为在92%~98%。因此选用磷蛋白的单克隆抗体,作为荧光抗体检测的工具,具有良好的特异性。
以1C9磷蛋白荧光抗体与本实验室研制的狂犬病核蛋白免疫荧光抗原检测试剂盒对本实验室收集的501份疑似狂犬病鼬獾、蝙蝠、犬和黄鼬的脑组织样品进行直接免疫荧光平行检测,结果显示,两种检测手段对基因1型狂犬病毒的检出结果完全一致。其中本试验的1C9荧光抗体从蝙蝠样品中检测出1份阳性,核蛋白荧光抗体试剂盒检测全是阴性。检测出的这份阳性样品经证实是国内分离到的第1株非RV狂犬病毒[11],该毒株属于弹状病毒科,狂犬病毒属,Irkut病毒种。该毒株具有致人感染死亡的毒力,因此及时准确地对该毒株进行检测是十分必要的。
核蛋白荧光抗体是目前应用与抗原检测比较常见的,但是目前它不能诊断检测出Irkut病毒;本试验制备的磷蛋白荧光抗体不但与核蛋白荧光抗体的检出结果一致,而且能检测出Irkut病毒,说明该荧光抗体可能成为一种良好的检测病毒抗原的工具。为了避免以后对狂犬病病原的漏检,可以将核蛋白荧光抗体与磷蛋白荧光抗体混合一起,共同对狂犬病毒进行检测,这样可以更准确的检测出狂犬病病毒,提高检测准确率。
[1] Chenik M, Chebli K, Blondel D. Translation initiation at alternate in-frame AUG codons in the rabies virus phosphoprotein mRNA is medited by a ribosomal leaky scanning mechanism[J]. J Virol,1995, 69(2): 707-712.
[2] Chenik M, Chebli K, Blondel D. Translation Initiation at Alternate In-Frame AUG Codons in the Rabies Virus Phosphoprotein mRNA Is Mediated by a Ribosomal Leaky Scanning Mechanism.[J]. J Virol, 1995, 69(2): 707-712.
[3] Oksayan S, Wiltzer L, rowe C L,et al. A novel nuclear trafficking module regulates the nucleocytoplasmic localization of the rabies virus interferon antagonist, P protein[J]. J Biol Chen, 2012, 287(33): 28112-28121.
[4] Brzózka K, Finke S, Conzelmann K K. Identification of the Rabies Virus AlphaBeta Interferon Antagonist: Phosphoprotein P Interferes with Phosphorylation of Interferon Regulatory Factor 3[J]. J Virol, 2005, 79(12): 7673-7681.
[5] Brzozka K, Finke S, Conzelmann K K,et al. Inhibition of Interferon Signaling by Rabies Virus Phosphoprotein P:Activation-Dependent Binding of STAT1 and STAT2[J]. J Virol, 2006, 80(6): 2675-2683.
[6] Yang L,Yoon K J, Li Y,et al. Antigenic and geneticvariations of the 15 kD nucleocap sid protein of porcine reproductive and respiratory syndrome virus isolates [J]. Arch Virol, 1999, 144(3): 525-546.
[7] Meulenberg J J, Petersen-den Besten A, De Kluyver E P,et al. Characterization of protein encoded by ORFs 2 to 7 of Lelystad Virus [J]. Virology, 1995, 206(1): 155-163.
[8] Golding J W. Monoclonal antibodies: principle and practice[M]. New York: Academic press, 1983.
[9] 沈关心, 周汝麟. 现代免疫学实验技术[M]. 武汉: 湖北科学技术出版社, 1998: 96-98, 162-165.
[10] 张守峰, 曹亮, 张菲, 等. 狂犬病毒核蛋白单抗和荧光抗体中和试验的建立与应用[J]. 中华检验医学杂志, 2006, 29(6): 554-557.
[11] 刘晔, 张守峰, 张菲, 等. 我国首次从吉林省境内蝙蝠体内分离获得狂犬病毒[J].中国兽医学报, 2012, 32(12): 1799.
PREPARATION OF MOUSE ANTI-RABIES VIRUS PHOSPHOPROTEIN MONOCLONAL ANTIBODIES AND APPLICATION
MI Li-juan, ZHANG Shou-feng, LIU Ye, WANG Shu-chao, HU Rong-liang
(Key Laboratory of Jilin Province for Zoonosis Prevention and Control, Institute of Military Veterinary, AMMS, Changchun 130122, China)
Four monoclonal antibodies against Rabies virus phosphoprotein were produced by immunization with Rabies virus strain CVS in BALB/c mice. After fusion, antibodies in the supernatant of the hybrid cells were respectively detected by ELISA test and western-blot method. Four hybrid cells secreting antibody binding to rabies virus , i.e. 1C9, 4B10, 2G12 and4G5 strains. The 1C9 monoclonal lgG antibody was purif ed by aff nity chromatography method and then labeled with FITC. 501 brain samples collected from ferret badgers, bats, dogs and weasels were detected using the labeled 1C9 antibody and FITC-labeled rabies virus N protein-specif c monoclonal antibody (made in our laboratory). The results showed that the labeled 1C9 antibody can detect rabies-related lyssaviruses isolated in China including Rabies virus and Irkut virus, however, the N protein-specif c monoclonal antibody only can detect Rabies virus. It suggests that the labeled 1C9 antibody can be used as a rabies diagnostic reagent in China.
Rabies virus; phosphoprotein; monoclonal antibody
S852.659.5
A
1674-6422(2014)01-0025-05
2013-8-11
农业部公益性行业项目资助(201203056)
米立娟,女,硕士研究生,预防兽医学专业
扈荣良, E-mail:ronglianghu@hotmail.com
