密码子优化型鸭甲肝病毒VP1基因在昆虫细胞中的表达
2014-04-13李传峰陈宗艳孟春春梁瑞英刘光清
李传峰,陈宗艳,孟春春,梁瑞英,胡 文,刘光清
(中国农业科学院上海兽医研究所,上海 200241)
·研究论文·
密码子优化型鸭甲肝病毒VP1基因在昆虫细胞中的表达
李传峰,陈宗艳,孟春春,梁瑞英,胡 文,刘光清
(中国农业科学院上海兽医研究所,上海 200241)
为了提高基因A型鸭甲肝病毒(Duck hepatitis A virus,DHAV)VP1基因在昆虫细胞中的表达水平, 本研究根据昆虫细胞密码子偏爱性对野生型DHAV VP1(wtVP1)基因进行改造, 合成了optiVP1基因,并利用Bac-to-Bac表达系统构建了重组杆状病毒rBacmid-wtVP1和rBacmid-optiVP1, 分别转染对数生长期的sf9昆虫细胞表达VP1蛋白。转染72 h后,sf9细胞出现典型的细胞病变(cytopathic effect,CPE), Western-blot和间接免疫荧光法(indirect immunof uorescence assay,IFA)检测结果表明VP1蛋白在重组杆状病毒感染的sf9昆虫细胞中获得了良好表达。用Image J软件对 Western-blot扫描的图片进行灰度分析发现,optiVP1基因在昆虫细胞中的表达水平明显高于wtVP1。本研究为进一步研制诊断抗原和新型基因工程疫苗的开发奠定了基础。
鸭甲肝病毒; VP1;重组杆状病毒;密码子优化
根据国际病毒学分类委员会2012年发表的最新病毒学分类第9次报告,鸭甲肝病毒(Duck hepatitis A virus, DHAV)目前是小RNA病毒科(Picornaviridae)、禽肝病毒属(Avihepatovirus)的唯一成员[1]。DHAV主要包括3个基因型或血清型,即基因A、B和C型或血清1、2和3型[2,3]。其中,基因A型(或血清1型)DHAV为呈世界性分布的经典毒株[4-6];基因B型(或血清2型)DHAV仅出现中国的台湾地区[7];基因C型(或血清3型)DHAV主要分布于韩国和中国大陆[2,3,8,9]。DHAV能引起雏鸭的一种急性高度致死性传染病,即鸭病毒性肝炎(duck viral hepatitis, DVH),主要侵害4周龄以内的雏鸭,特别是1周龄以下的雏鸭最易感,死亡率可达到90%以上,严重危害了养鸭业的健康发展。
基因A型DHAV基因组是一种单股正链RNA分子(+ssRNA),全长约7.7 kb,仅含有一个大的开放阅读框(open reading frame, ORF),编码一条由2249个氨基酸组成的多聚蛋白前体。多聚蛋白前体在病毒自身编码蛋白酶的作用下裂成3个结构蛋白(VP0、VP3和VP1)和多个非结构蛋白[4,6]。在小RNA病毒中VP1蛋白作为主要的宿主保护性蛋白,编码主要的抗原位点并具有主要的型特异性中和位点,可诱导机体产生保护性中和抗体[10]。因此,VP1蛋白可作为研制新型疫苗和诊断抗原的候选分子,具有较重要的学术价值和现实意义。同时,由于VP1蛋白分子暴露于病毒粒子的表面,极易发生变异,导致出现新血清型的DHAV。而且A型DHAV经过鸡胚传代后可得到具有良好免疫原性而无致病性的弱毒株,VP1蛋白C端氨基酸序列发生了较为一致的突变,这表明VP1可能与病毒的致病性密切相关[11-13]。因此,VP1是研究DHAV致病机理的最重要靶基因之一。
由于缺乏有效的细胞培养体系,目前VP1相关研究仅局限于序列分析[11,13,14]、原核表达以及相关的应用[15,16]。原核表达的局限性限制了对VP1蛋白更为深入和全面的研究。本实验室前期研究中发现,利用Bac-to-Bac昆虫/杆状病毒表达系统在sf9细胞中表达DHAV VP1蛋白时,表达量偏低影响了实验效率。为了提高DHAV VP1蛋白的表达量,本研究根据昆虫细胞密码子的偏爱性,在不改变野生型VP1基因(wtVP1)编码氨基酸的基础上设计并合成了优化型VP1基因(optiVP1),分别构建了含有wtVP1和optiVP1基因重组杆状病毒,并分析两者在昆虫细胞中表达的差异,为进一步研制诊断抗原和新型基因工程疫苗的开发奠定了基础。
1 材料与方法
1.1 材料
1.1.1 毒(菌)株、细胞、质粒和载体 鸭甲肝病毒ZJ-V株(GenBank登录号:EF382778)、感受态细胞E.coliDH5α和E.coliDH10Bac、昆虫细胞系sf9和pFast-DHAV重组质粒均由中国农业科学院上海兽医研究所禽病研究室保存;杆状病毒转移载体pFastBac1购自Invitrogen公司。
1.1.2 工具酶和试剂 LATaq酶、T4 DNA连接酶、限制性内切酶、dNTP均购自TaKaRa宝生物工程(大连)公司;质粒小量提取试剂盒和DNA凝胶回收试剂盒购自Axygen公司;SF-900II SFM昆虫细胞培养基、Grace’s培养基、转染试剂Cellfectin II Reagent均购自Invitrogen公司;辣根过氧化物酶(HRP)标记的羊抗兔IgG和异硫氰酸荧光素(FITC)标记的山羊抗兔IgG购自北京康为世纪生物科技有限公司;兔抗DHAV VP1多克隆抗血清由本实验室制备和保存。
1.2 方法
1.2.1 引物设计和基因合成 根据GenBank中登录的基因A型DHAV全基因组序列(登录号:EF382778),设计特异扩增VP1基因的引物。上游引物P1:5'-AAACTGCAGATGGGTGATT CTAACCAGTTGG-3',下游引物P2:5'-CGG GGTACCCTATTCAATT TCCAGATTGAG-3',在上下游引物的5'端分别加入PstⅠ和KpnⅠ酶切位点(下划线所示)以及相应的保护性碱基,扩增目的片段大小为714 bp。根据Bac-to-Bac昆虫/杆状病毒表达系统手册,设计1对通用引物以验证目的基因是否重组到杆状病毒上,上游引物M13up: 5'-GTTTTCCCAGTCACGAC-3',下游引物M13down: 5'-CAGGAAACAGCTATGAC-3'。以上引物均由上海英骏生物技术有限公司合成。将A型DHAV的VP1基因全部密码子按照昆虫细胞密码子偏爱性进行优化,并将该基因两端分别引入PstⅠ和KpnⅠ两个酶切位点。优化后的VP1基因(optiVP1)由上海捷瑞生物工程有限公司合成并重组至pFastBac1载体上,获得质粒pFast-optiVP1。
1.2.2 基因A型DHAV VP1基因的扩增 以pFast-DHAV重组质粒为模板,用设计合成的特异性引物P1和P2进行扩增。扩增反应的条件:95 ℃预变性5 min;94 ℃变性1 min,52 ℃退火45 s,72 ℃延伸45 s,30个循环;72 ℃延伸10 min。1%的琼脂糖凝胶电泳检测结果。
1.2.3 重组供体质粒的构建与鉴定 将DNA凝胶回收试剂盒回收的PCR产物和杆状病毒转移载体pFastBac1分别用PstⅠ和KpnⅠ双酶切、胶回收、连接和转化DH5α感受态细胞,培养后挑取单一菌落进行PCR鉴定,筛选出阳性克隆子,经过双酶切鉴定后送样测序,鉴定正确的重组质粒命名为pFastwtVP1。同时将合成的pFast-optiVP1重组质粒进行双酶切鉴定。
1.2.4 重组杆状病毒穿梭质粒的构建与鉴定 分别将pFast-wtVP1和pFast-optiVP1转化DH10Bac感受态细胞,37 ℃培养4 h后,取100 μL涂布于含有卡那霉素(50 μg/mL)、庆大霉素(7 μg/mL)、四环素(10 μg/mL)以及X-gal(100 μg/mL)和IPTG(20 μg/mL)的LB平板上。37 ℃避光培养48 h后,挑取白色菌落,在同样含有上述3种抗性的LB平板上进行2次筛选,挑取白色菌落摇菌。按照Bac-to-Bac昆虫/杆状病毒表达系统手册提取重组Bacmid质粒,分别用M13上下游引物进行PCR鉴定,同时设立Bacmid空质粒作为对照。鉴定为阳性的重组杆粒分别命名为rBacmid- wtVP1和rBacmid- optiVP1。
1.2.5 重组杆状病毒的拯救 参考Cellfectin Reagent说明书进行操作。在重组杆粒rBacmid-wtVP1、rBacmid-optiVP1和转染试剂Cellfectin II Reagent中分别加入100μL Grace’s培养基(不含胎牛血清和抗生素)混匀后,转染试剂混合物分别与前两者混合均匀,室温孵育45 min,分别制成rBacmid-wtVP1和rBacmid-optiVP1脂质体。取生长良好的sf9单层细胞,弃去培养液;用新的Grace’s培养基洗2次,将rBacmid-wtVP1和rBacmid-optiVP1脂质体分别覆盖细胞,28 ℃孵育5 h;弃去残留的脂质体混合物,加入Grace’s完全培养基(含胎牛血清和抗生素),28℃继续孵育至70%~80%细胞出现病变,收集培养上清和细胞,300×g离心15 min,上清即为原代毒种(P1代),4 ℃避光保存备用。将P1代毒种在sf9昆虫细胞上扩大培养1次后即为P2代毒种,以此类推。同时转染Bacmid空质粒作为阴性对照。
1.2.6 重组病毒表达产物的Western-blot鉴定 用P3代毒种接种对数生长期sf9细胞,72 h后弃去培养基,PBS洗涤3次,加入适当体积的PBS重悬细胞沉淀,超声裂解后加入等体积的2×SDS loading buffer(100 mmol/L Tris-HCl pH8.0、200 mmol/L巯基乙醇、4%SDS、2%溴酚蓝和20%甘油)。混匀,水浴煮沸5 min后进行SDS-PAGE电泳,以同样处理的正常昆虫细胞作为阴性对照。电泳分离后,以10V的恒压将目的蛋白从凝胶上转移到硝酸纤维素膜上,PBST洗膜后用5%的脱脂乳于37 ℃封闭30 min,然后加入兔抗DHAV VP1多克隆抗血清(1:100),37 ℃作用2 h;PBST洗涤3次,5 min/次,然后加入HRP标记的山羊抗兔IgG(1:2000),37 ℃作用1 h,充分洗涤后,DAB显色和拍照。
1.2.7 重组病毒表达产物的间接免疫荧光(indirect immunofluorescence, IFA)鉴定 将感染后72 h的sf9细胞用PBST洗涤3次,以固定剂(4%甲醛)于常温下固定细胞约20 min。弃去固定液,PBST洗涤3次,自然干燥后加入兔抗VP1多克隆抗血清(1:100),37 ℃作用2 h。PBST洗涤3次,5 min/次,然后加入FITC标记的山羊抗兔IgG(1:200),37 ℃作用1 h。PBST充分洗涤4~5次后,荧光显微镜下观察荧光反应。同时设置正常和感染野生型杆状病毒的sf9细胞作为对照。
2 结果
2.1 VP1的扩增和穿梭质粒的构建与鉴定以P1和P2为引物进行PCR扩增而获得的PCR产物,经过1%琼脂糖凝胶电泳检测可得到大小约为714 bp左右的条带,与预期大小一致(图1A)。将获得的PCR产物克隆到杆状病毒转移载体pFastBac1,制备的重组质粒以及人工合成的重组质粒pFast-optiVP1经过PstⅠ和KpnⅠ双酶切和测序鉴定均表明,VP1基因片段插入方向和阅读框正确(图1B)。
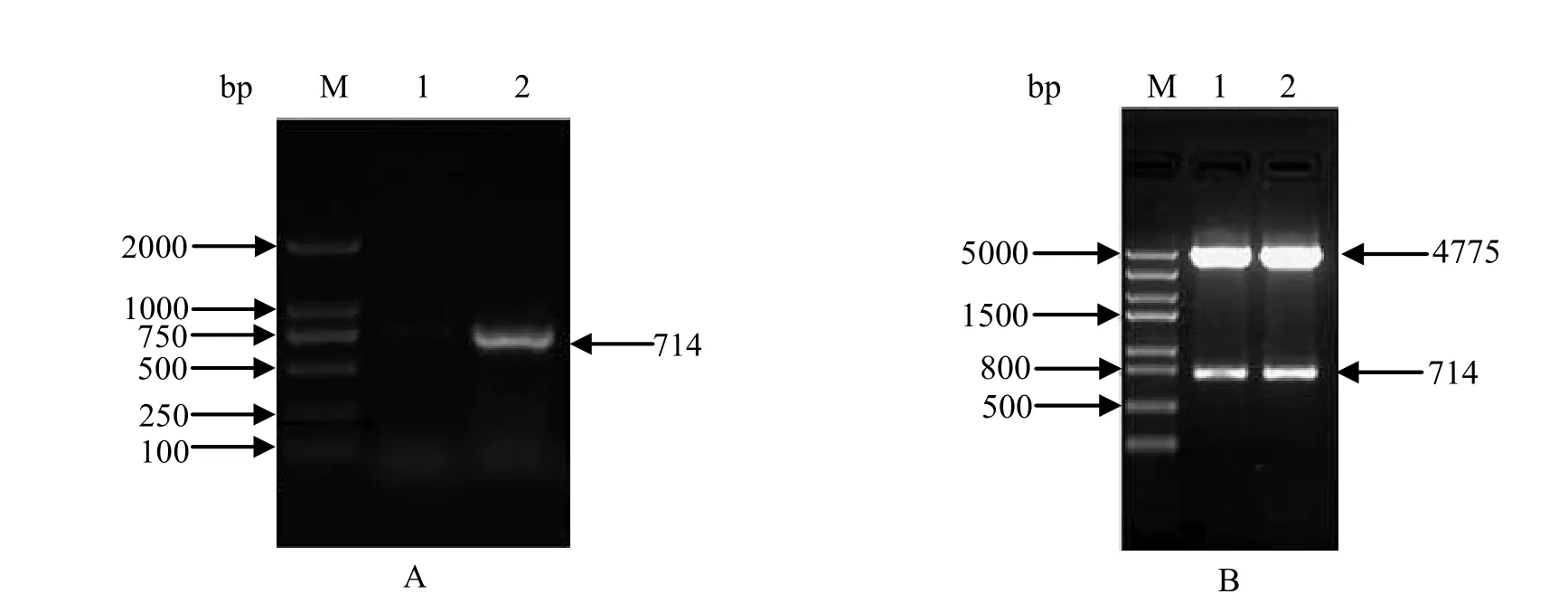
图1 VP1基因的PCR扩增(A)和重组穿梭质粒的酶切鉴定(B)Fig.1 Amplif cation of VP1 gene by PCR (A) and identif cation of recombinant transfer plasmids by restriction analysis(B)
2.2 重组杆状病毒质粒的构建与鉴定将pFast-wtVP1和pFast-optiVP1转化DH10Bac感受态细胞中,发生位点特异性转座作用,经过3抗LB平板(50 μg/mL卡那霉素、7 μg/mL 庆大霉素、10 μg/mL四环素、100 μg/mL X-gal和40 μg/mL IPTG)蓝白斑筛选,得到白色阳性菌落。阳性菌落用mini-attTn7位点外的M13上下游引物进行PCR鉴定。得到的阳性重组质粒经PCR扩增可出现大小约3000 bp的条带,分别命名为rBacmid-wtVP1和rBacmid-optiVP1,而野生型杆状病毒质粒Bacmid仅出现大小约为273 bp的条带,与预期片段大小一致(图2)。
2.3 重组杆状病毒转染sf9昆虫细胞将重组杆状病毒质粒rBacmid-wtVP1和rBacmid-optiVP1转染sf9昆虫细胞5 d后,出现明显细胞病变,主要表现为细胞变大、变圆,细胞核增大甚至充满整个胞浆,核内有包涵体样、折光性差的颗粒,呈现颗粒状细胞逐渐崩解,漂浮于培养基中,转染野生型杆粒Bacmid也可产生类似病变,而未转染的sf9细胞形态完整,生长正常(图3)。
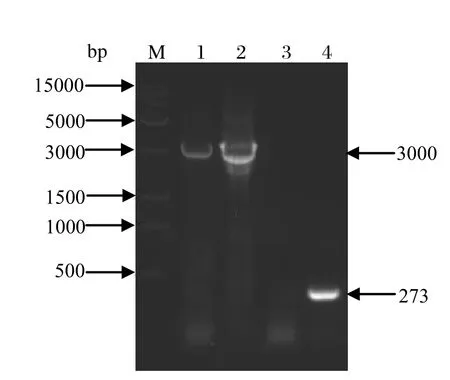
图2 重组杆状病毒质粒的PCR鉴定Fig.2 Identif cation of recombinant bacmid by PCR amplif cation
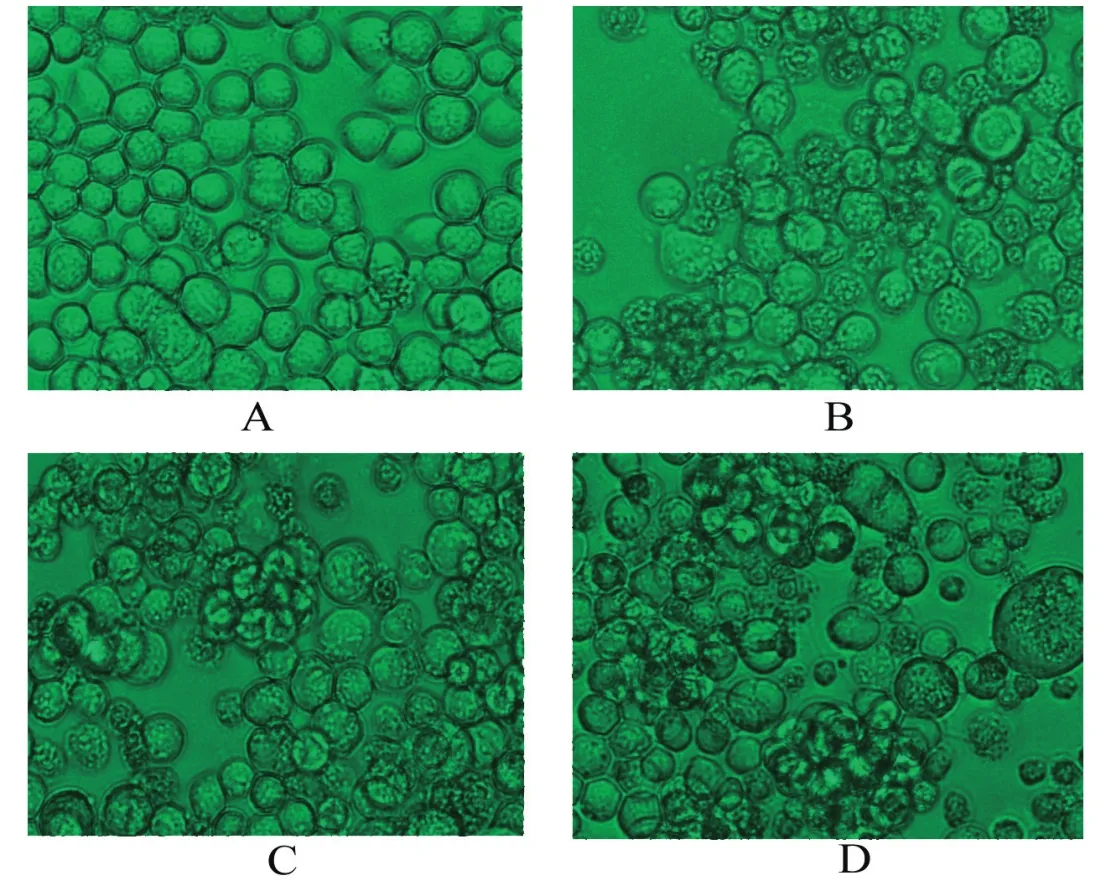
图3 重组杆状病毒转染sf9细胞后的细胞病变(200×)Fig.3 Cytopathic effects of Sf9 cells infected with recombinant baculovirus (200×)
2.4 重组病毒表达产物的Western-blot检测对重组杆状病毒在sf9昆虫细胞中的表达产物进行Westernblot分析,结果显示转染重组杆粒Bacmid-wtVP1和rBacmid-optiVP1的sf9细胞裂解产物均在大约27 kDa出现特异性的反应条带,与预期大小一致,而转染野生型杆粒Bacmid的sf9昆虫细胞以及正常sf9昆虫细胞在此位置均未出现目的条带(图4A)。用Image J软件对 Western-blot扫描的图片进行灰度分析发现,优化后的VP1基因在昆虫细胞中的表达量明显高于野生型VP1基因,大约提高2倍(图4B)。
2.5 重组病毒表达产物的IFA检测将P3代重组杆状病毒以及野生型杆状病毒感染sf9昆虫细胞,于27 ℃培养箱培养72 h后进行IFA检测。检测结果显示,转染了重组杆粒rBacmid-wtVP1和rBacmid-optiVP1的sf9昆虫细胞中均可见到特异的绿色荧光,而且两者相比,转染了重组杆粒rBacmid-optiVP1的昆虫细胞中阳性细胞数量明显更多。而转染了野生型杆状病毒的昆虫细胞和正常昆虫细胞均未出现荧光。
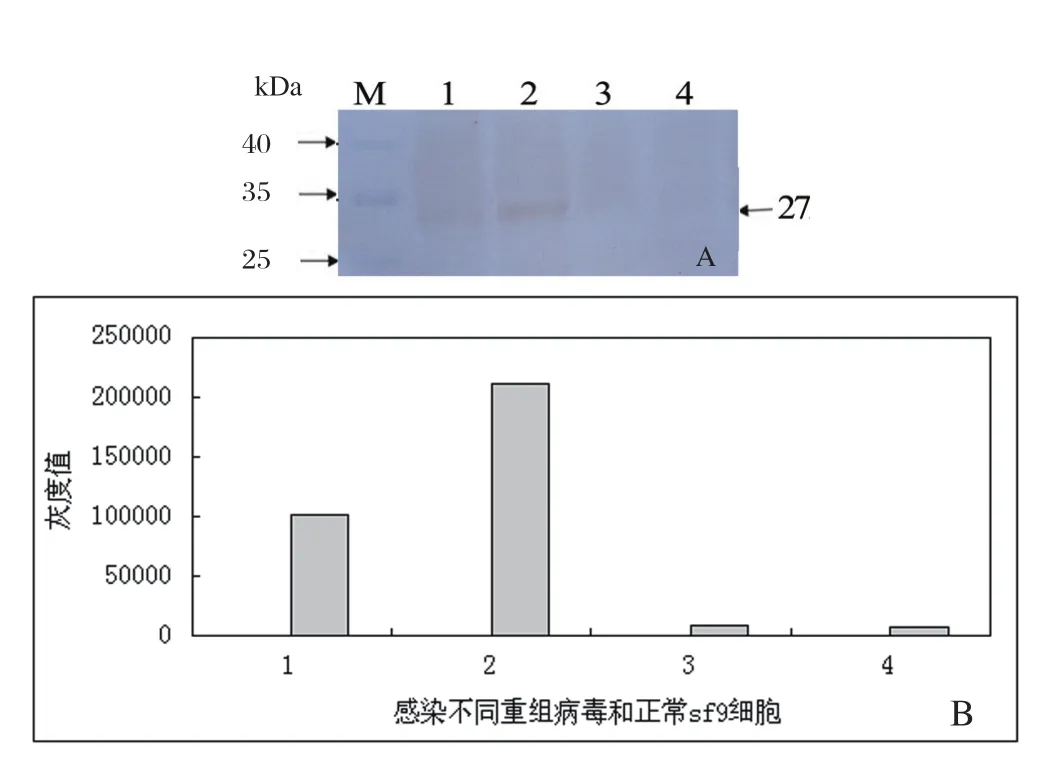
图4 Western-blot检测VP1蛋白在昆虫细胞中的表达Fig.4 Western-blot analysis of VP1 protein expression in insect cells
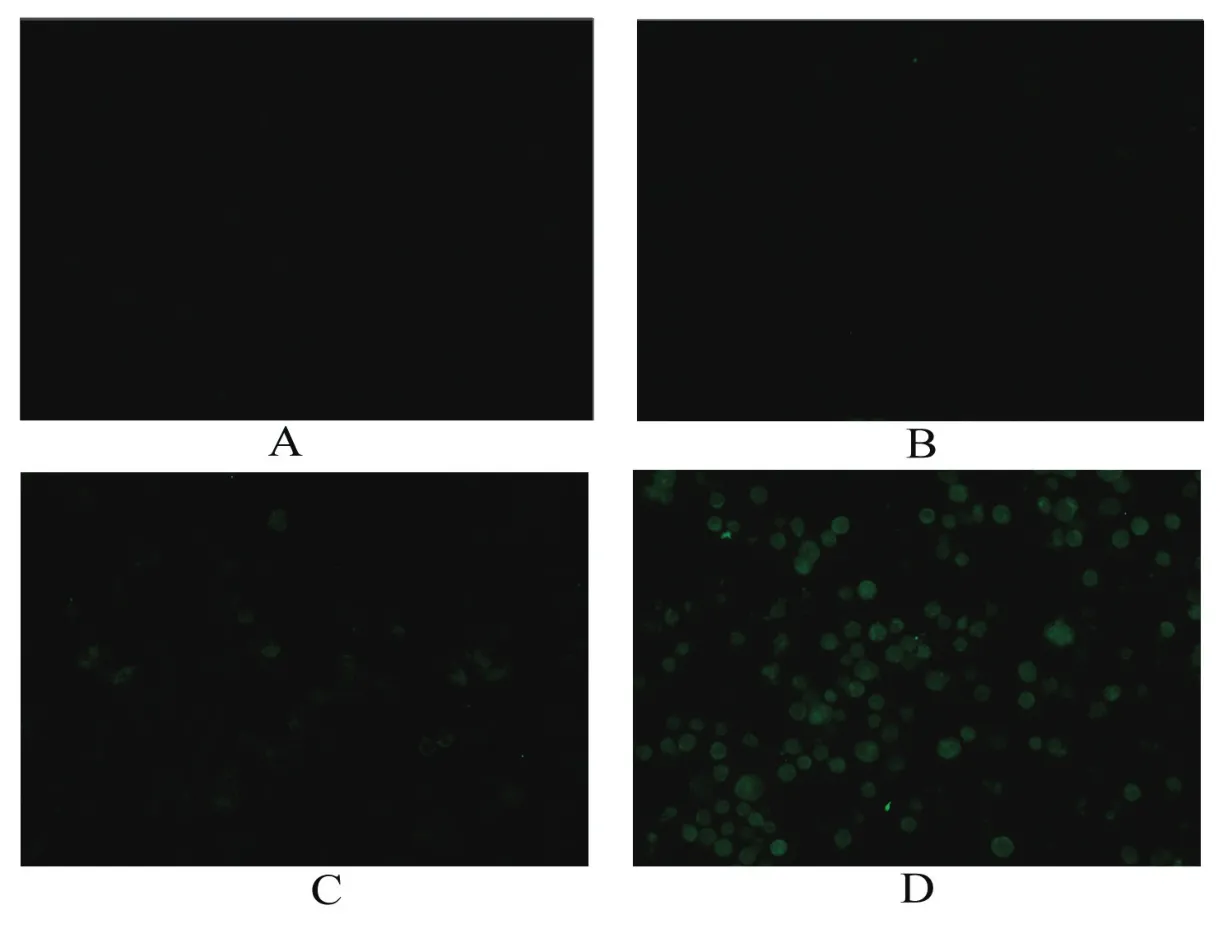
图5 间接免疫荧光法(IFA)检测DHAV VP1蛋白在昆虫细胞中的表达Fig.5 Identif cation of DHAV VP1 protein expression in insect cells by indirect immunof uorescence assay
3 讨论
VP1蛋白作为DHAV最重要一种抗原性结构蛋白,能够诱导机体产生保护性抗体,因此在DHAV的流行病学调查以及和新型疫苗的研发中具有重要作用[15,17]。目前对A型DHAV VP1蛋白的重组表达多利用原核表达系统,应用研究也局限于血清学诊断法的建立[15,16]。原核表达系统具有操作简单、生产周期短,成本低、表达量高且易于纯化等显著特点,但表达产物缺乏翻译后的修饰,多以无生物活性的包涵体形式存在[18]。Bac-to-Bac杆状病毒表达系统作为一种成熟的真核表达系统,有其自身独特的优势[19-21],主要表现在具备真核细胞完备的翻译后加工修饰系统以及转移外源蛋白的能力,因此表达的蛋白具有良好的生物活性;宿主范围狭窄,仅限于昆虫,对哺乳动物和禽类等脊椎动物具有较高安全性。此外,它还具有基因体外重组所需时间短,阳性重组率高的特点,重组体不需要蚀斑纯化即可获得,这大大提高了工作效率和经济效益。因此,该系统已经广泛应用于多种功能蛋白或病毒样颗粒(virus like particles, VLP)的表达[22-25]。为了获得更接近天然构象和生物活性的蛋白,本研究选择了Bac-to-Bac杆状病毒表达系统在sf9细胞中表达DHAV VP1蛋白。
本实验在前期研究中发现,VP1蛋白在杆状病毒表达系统中时表达量偏低,不足以用于进行诊断试剂和亚单位疫苗的研制。已有的研究成果已经表明,不同种类生物或同种生物不同组织器官对密码子的使用频率是不同的,优势密码子与基因表达水平呈正相关[26]。宿主细胞对密码子的偏爱性,经常影响外源基因在宿主细胞的表达效率[27]。换言之,通过密码子优化的策略可以显著提高外源基因的表达水平。Chen等[28]在不改变小鹅瘟病毒 VP2蛋白氨基酸序列的基础上根据昆虫细胞的偏爱性优化了VP2基因,显著提高了其在昆虫细胞上的表达量,并形成了病毒样颗粒。Cao等[29]曾利用Bac-to-Bac昆虫细胞杆状病毒系统成功表达了Asia I型口蹄疫病毒的VLPs,而不能表达O型口蹄疫病毒的VLPs,然而优化O型口蹄疫病毒衣壳蛋白编码基因后也成功表达并形成了VLPs。在前期研究中发现,DHAV VP1基因能够在昆虫细胞中表达但是表达量偏低。通过与宿主昆虫细胞密码子偏爱性进行分析发现,两者密码子偏爱性存在较大的差异(结果未显示)。这可能是降低VP1基因在昆虫细胞中表达量的主要原因。因此,本研究根据昆虫细胞密码子的偏爱性优化了DHAV VP1基因,使其更利于在昆虫细胞中表达。研究结果也证实,密码子优化的策略的确提高了VP1基因在昆虫细胞的表达量。虽然本研究未进行定量分析,但是根据Western-blot以及IFA结果仍能很容易判断密码子优化的VP1基因要明显高于野生型VP1基因的表达水平,而且也表明了VP1蛋白具有良好的抗原性。
总之,本研究在不改变基因A型DHAV VP1蛋白氨基酸序列的基础上,通过密码子优化策略使其能在昆虫细胞中得到更为高效的表达,为进一步建立检测DHAV的血清学方法以及新型基因工程疫苗奠定了坚实基础。
[1] King A M Q, Lefkowitz E, Adams M J,et al. Picornaviridae [M]//Virus Taxonomy: Classification and Nomenclature of Viruses: Ninth Report of the International Committee on Taxonomy of Viruses. San Diego, Elsevier/Academic Press, 2012, 855-880.
[2] Wang L, Pan M, Fu Y,et al. Classification of duck hepatitis virus into three genotypes based on molecular evolutionary analysis[J]. Virus Genes, 2008, 37(1): 52-59.
[3] Fu Y, Pan M, Wang X,et al. Molecular detection and typing of duck hepatitis A virus directly from clinical specimens[J]. Vet Microbiol, 2008, 131(3-4): 247-257.
[4] Kim M C, Kwon Y K, Joh S J,et al. Molecular analysis of duck hepatitis virus type 1 reveals a novel lineage close to the genus Parechovirus in the family Picornaviridae[J]. J Gen Virol, 2006, 87(Pt 11): 3307-3316.
[5] Ding C, Zhang D. Molecular analysis of duck hepatitis virus type 1[J]. Virology, 2007, 361(1): 9-17.
[6] Tseng C H, Knowles N J, Tsai H J. Molecular analysis of duck hepatitis virus type 1 indicates that it should be assigned to a new genus[J]. Virus Res, 2007, 123(2): 190-203.
[7] Tseng C H, Tsai H J. Molecular characterization of a new serotype of duck hepatitis virus[J]. Virus Res, 2007, 126(1-2): 19-31.
[8] Kim M C, Kwon Y K, Joh S J,et al. Recent Korean isolates of duck hepatitis virus reveal the presence of a new geno- and serotype when compared to duck hepatitis virus type 1 type strains[J]. Arch Virol, 2007, 152(11): 2059-2072.
[9] Cha S Y, Roh J H, Kang M,et al. Isolation and characterization of a low pathogenic duck hepatitis A virus 3 from South Korea[J]. Vet Microbiol, 2013, 162(1): 254-258.
[10] Muir P, Kammerer U, Korn K,et al. Molecular typing of enteroviruses: current status and future requirements. The European Union Concerted Action on Virus Meningitis and Encephalitis[J]. Clin Microbiol Rev, 1998, 11(1): 202-227.
[11] Liu G, Wang F, Ni Z,et al. Genetic diversity of the VP1 gene of duck hepatitis virus type I (DHV-I) isolates from southeast China is related to isolate attenuation[J]. Virus Res, 2008, 137(1):137-141.
[12] Wang Y, Li C, Chen Z,et al. Complete genome comparison of duck hepatitis virus type 1 parental and attenuated strains[J]. Virus Genes, 2012, 45(2): 398-401.
[13] Jin X, Zhang W, Gu C,et al. Identification and molecular analysis of the highly pathogenic duck hepatitis virus type 1 in Hubei province of China[J]. Res Vet Sci, 2008, 85(3): 595-598.
[14] Gao J, Chen J, Si X,et al. Genetic variation of the VP1 gene of the virulent duck hepatitis A virus type 1 (DHAV-1) isolates in Shandong province of China[J]. Virol Sin, 2012, 27(4): 248-253.
[15] Liu M, Zhang T, Zhang Y,et al. Development and evaluation of a VP1-ELISA for detection of antibodies to duck hepatitis type 1 virus[J]. J Virol Methods, 2010, 169(1): 66-69.
[16] Li C, Chen Z, Meng C,et al. High yield expression of duck hepatitis A virus VP1 protein in Escherichia coli, and production and characterization of polyclonal antibody[J]. J Virol Methods, 2013, 191(1): 69-75.
[17] Fu Y, Chen Z, Li C,et al. Protective immune responses in ducklings induced by a suicidal DNA vaccine of the VP1 gene of duck hepatitis virus type 1[J]. Vet Microbiol, 2012, 160(3-4): 314-318.
[18] Yin J, Li G, Ren X,et al. Select what you need: a comparative evaluation of the advantages and limitations of frequently used expression systems for foreign genes[J]. J Biotechnol, 2007, 127(3): 335-347.
[19] Jackson J A. Baculovirus expression systems and insect cells[J]. Bioprocess Technol, 1991, 13: 402-413.
[20] Patterson R M, Selkirk J K, Merrick B A. Baculovirus and insect cell gene expression: review of baculovirus biotechnology[J]. Environ Health Perspect, 1995, 103(7-8): 756-759.
[21] Hitchman R B, Possee R D, King L A. Baculovirus expression systems for recombinant protein production in insect cells[J]. Recent Pat Biotechnol, 2009, 3(1): 46-54.
[22] Kiener T K, Premanand B, Kwang J. Immune responses to baculovirus-displayed enterovirus 71 VP1 antigen[J]. Expert Rev Vaccines, 2013, 12(4): 357-364.
[23] Peralta A, Maroniche G A, Alfonso V,et al. VP1 protein of Foot-and-mouth disease virus (FMDV) impairs baculovirus surface display[J]. Virus Res, 2013, 175(1): 87-90.
[24] Wang W, Chen X, Xue C,et al. Production and immunogenicity of chimeric virus-like particles containing porcine reproductive and respiratory syndrome virus GP5 protein[J]. Vaccine, 2012, 30(49): 7072-7077.
[25] Jeoung H Y, Lee W H, Jeong W,et al. Immunogenicity and safety of virus-like particle of the porcine encephalomyocarditis virus in pig [J]. Virol J, 2011, 8: 170.
[26] Ramakrishna L, Anand K K, Mohankumar K M,et al. Codon optimization of the tat antigen of human immunodeficiency virus type 1 generates strong immune responses in mice following genetic immunization[J]. J Virol, 2004, 78(17): 9174-9189.
[27] Gustafsson C, Govindarajan S, Minshull J. Codon bias and heterologous protein expression[J]. Trends Biotechnol, 2004, 22(7): 346-353.
[28] Chen Z, Li C, Zhu Y,et al. Immunogenicity of viruslike particles containing modified goose parvovirus VP2 protein[J]. Virus Res, 2012, 169(1): 306-309.
[29] Cao Y, Sun P, Fu Y,et al. Formation of virus-like particles from O-type foot-and-mouth disease virus in insect cells using codon-optimized synthetic genes[J]. Biotechnol Lett, 2010, 32(9): 1223-1229.
ENHANCED EXPRESSION OF CODON-OPTIMIZED VP1 GENE OF DUCK HEPATITIS A VIRUS IN INSECT CELLS
LI Chuan-feng, CHEN Zong-yan, MENG Chun-chun, LIANG Rui-ying, HU Wen, LIU Guang-qing
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
The objective of the present study was to enhance expression level of VP1 gene of Duck hepatitis A virus (DHAV) genotype A in insect cells by manipulating the codon usage bias. The codon usage of wild-type DHAV VP1 (wtVP1) gene was optimized and designated as optiVP1. The recombinant rBacmid-optiVP1 and rBacmid-wtVP1 plasmids were then constructed using the Bac-to-Bac baculovirus expression system (BEVS) and then transfected to sf9 insect cells at logarithmic phase for expression of VP1 protein. The typical cytopathic effect was observed in sf9 cells at 72 h post transfection. The expression of VP1 protein in sf9 cells was conf rmed in Western blotting and indirect immunof uorescence assay (IFA). The VP1 amounts on Western blotting were measured using the software Image J. The expression level of optiVP1 gene was signif cantly increased as compared with wtVP1 gene. This study provided a basis for development of diagnostic reagents and genetically engineered novel vaccines for DHAV.
Duck hepatitis A virus; VP1; recombinant baculovirus; codon optimization
S852.659.6
A
1674-6422(2014)01-0001-08
2013-10-30
国家自然科学基金项目(31101848);中央级公益性科研院所基本科研业务费专项(2012JB13);公益性行业(农业)科研专项(201003012);国家高技术研究发展计划(863)项目(2011AA10A200)
李传峰,男,博士,助理研究员,主要从事水禽病毒病分子生物学研究
刘光清,E-mail: liugq@shvri.ac.cn
