油茶油体观察及其与含油量的相关性
2014-03-13罗丽萍杜尚广江香梅付宇新郭夏丽
罗丽萍 肖 萍 杜尚广 江香梅 付宇新 郭夏丽
(南昌大学生命科学与食品工程学院1,南昌 330031)
(江西省林业科学院2,南昌 330031)
脂类是种子贮藏能量最有效的形式[1]。在种子发育过程中,脂类主要以三酰甘油(triacylglycerols,TAGs)的形式在内质网上合成后被运输到胞内的贮油细胞器-油体(oil bodies)或称为脂肪体(lipid bodies)中,为种子萌发和幼苗生长提供能量[2-3]。油体是植物细胞中最小的细胞器,其直径为0.5~2.5μm,且因植物种类、组织来源等不同[4-5]。油体十分稳定,在干燥种子细胞内或经离心分离,油体间均不发生融合或聚合[6]。近年来,对油体形态结构、蛋白质成分、结构功能和分子水平以及利用油体构建生物反应器生产外源蛋白和发展生物柴油等方面有较多研究报道[4,7]。
油茶(Camellia oleifera)是我国特有的木本油料树种,与油棕、油橄榄和椰子并称为世界四大木本食用油料植物[8]。成熟的油茶种子经榨取所得油称为茶油,茶油色清味香、营养丰富,被誉为“东方橄榄油”,是高级烹调食用油[9],也是医药和化妆品等的主要原料。含油量是油料植物的主要农艺性状和育种指标,提高含油量一直是油茶育种中最重要的问题。
种子中油体与含油量关系一直受到人们的关注。Ting等[10]研究发现,高油玉米品种具有较大的油体和较高的TAG/油质蛋白比。Peng等[11]对芝麻油体进行了人工合成,合成的油体大小与TAG/油体蛋白成正比。Siloto等[12]通过在拟南芥中调控油质蛋白基因的表达水平,证明了油体大小的变化会影响种子内脂肪酸的累积,从而影响到种子的含油量。Hu等[13]研究欧洲油菜油体结构与含油量之间的关系,发现显著的大油体与低含油量之间存在高度相关。董劲松等[14]观察成熟甘蓝型油菜种子子叶细胞内油体发现,油菜种子细胞中油体的总面积与含油量之间存在正相关。少数研究者对油茶油体进行了报道,包括对油茶种子的油体蛋白进行了分离和鉴定,对其基因的分离和生物信息学进行了分析,还研究了油体蛋白的原核融合表达载体的构建[15],而有关油茶油体的形态、大小以及与种子含油量之间的关系均鲜见报道。
为观察油茶油体的形态大小,研究油茶油体与种子含油量之间的关系,本试验将冰冻切片、荧光染料尼罗红染色和激光扫描共聚焦显微镜(laser scanning confocalmicroscope,LSCM)观察技术相结合,建立了油茶油体快捷观察与鉴定技术体系;并对不同含油量的油茶品系的油体进行观察和统计分析,探讨油茶种子含油量与油体的关系。研究结果可为油茶油体改造,高油油茶品系选育等提供理论依据。
1 材料与方法
1.1 试验材料
选择成熟干燥的油茶种子,7个油茶品系名及含油量分别为:遂巾子52.82%;珍珠子51.32%;二水桃50.20%;石柿红皮50.13%;观音桃48.73%;赣萍茶47.88%;茅岗大果46.50%,均由江西省林业科学院提供。
1.2 试验方法
1.2.1 冰冻切片最适厚度以及尼罗红染液最适浓度的筛选
选取外观正常、饱满的油茶种子,去除种皮后,切取子叶中间1.0 cm×0.5 cm×0.5 cm大小,放入福尔马林-醋酸-酒精混合液(FAA液)于4℃冰箱中固定15 h后,在-20℃下,用冰冻切片机(Leica CA 1950)切片,切片放入尼罗红染液[16]中避光孵育15 min,期间用枪头吹打几次,促使染料与细胞内油脂充分结合。切片厚度分别设定为15、20、25、30、35、40μm。尼罗红染液配制方法为:称取5 mg尼罗红(J&K百灵威科技)溶于 5 mL丙酮中,得到1 mg/mL的母液,分装后在4℃避光保存[17]。用双蒸水将尼罗红母液分别稀释到浓度为1、2、5、10、20、40μg/mL现配现用。
1.2.2 制片、观察
染色后用0.1 mol/L PBS缓冲液漂洗3次,洗去未结合的染料。制片,用浸镜油封片。在 LSCM(ZEISSLSM 710)下使用20倍和40倍物镜扫描观察并拍照,扫描参数为HeNe激光,激发波长为483 nm,吸收波长为566~670 nm。
1.2.3 图片处理与数据统计
测定油茶品系遂巾子、珍珠子、二水桃、石柿红皮、观音桃、赣萍茶、茅岗大果共7个品系单个子叶贮藏细胞内油体截面积。利用ZEN 2008 Light Eddition软件的测量功能,每个品系随机选取30个油体测定其面积、周长,推算出油体直径;再每个品系随机选取30个细胞进行单个细胞内油体截面积计算与统计,设定名词:含油体率=单个细胞内油体截面积÷整个细胞面积大小×100%,通过量化,方便比较各个品系间的油体的含量的差异。
2 结果与分析
2.1 冰冻切片与染色的探讨
经过对不同厚度切片进行不同浓度尼罗红染液的染色比较观察,最终确定适合油茶种子子叶细胞内油体观察的切片厚度为25μm,尼罗红染液的浓度为10μg/mL,染色时间为15 min。由于细胞内油体的完整观察需要合适的细胞厚度,太厚油体过分重叠,太薄则油体可能损失。而用荧光染料尼罗红对切片进行染色目的是使其与细胞内油脂物质相结合并发出荧光检测信号,染液浓度太低染色时间太短,则染液无法与细胞内脂类物质结合完全。因此在保证细胞内脂类物质完全染色的情况下缩短时间,以达到快捷准确的目的。在制片过程中,用浸镜油进行封片,可达到减少尼罗红荧光染料淬灭以及延迟子叶贮藏细胞失水收缩的效果[14]。
2.2 油茶种子中油体观察
从7个油茶品系成熟种子子叶贮藏细胞内油体的LSCM观察图片(图1)中可以看出油茶种子子叶贮藏细胞内油体为球形,未见椭圆或不规则形状,与董劲松等[14]报道的甘蓝型油菜油体的形态有所不同。

图1 7个油茶品系成熟种子子叶贮藏细胞内油体的LSCM观察(Bar=10μm)
经测定,每个品系的平均直径见表1。7个品系油茶油体平均直径为2.52μm,标准差为1.99μm,图2中显示了油茶种子油体大小的分布情况,从图2可以看出多数油体直径分布在2.00~3.00μm之间。Tzen等[5]报道,油菜、玉米、花生、芝麻的油体直径分别为0.65、1.45、1.95、2.00μm,由此可看出不同植物种子油体的大小不同。
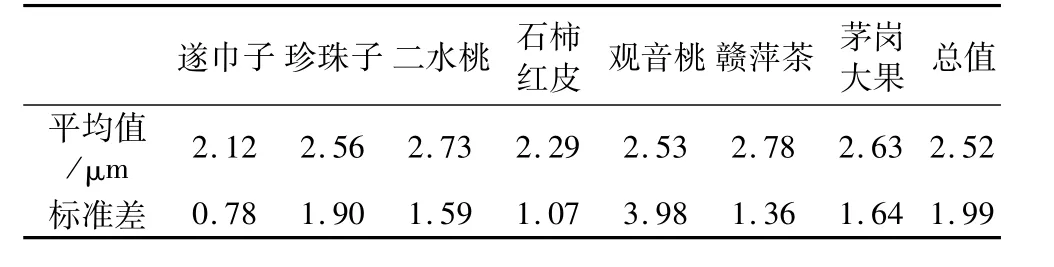
表1 7个油茶品系成熟种子子叶贮藏细胞内油体直径
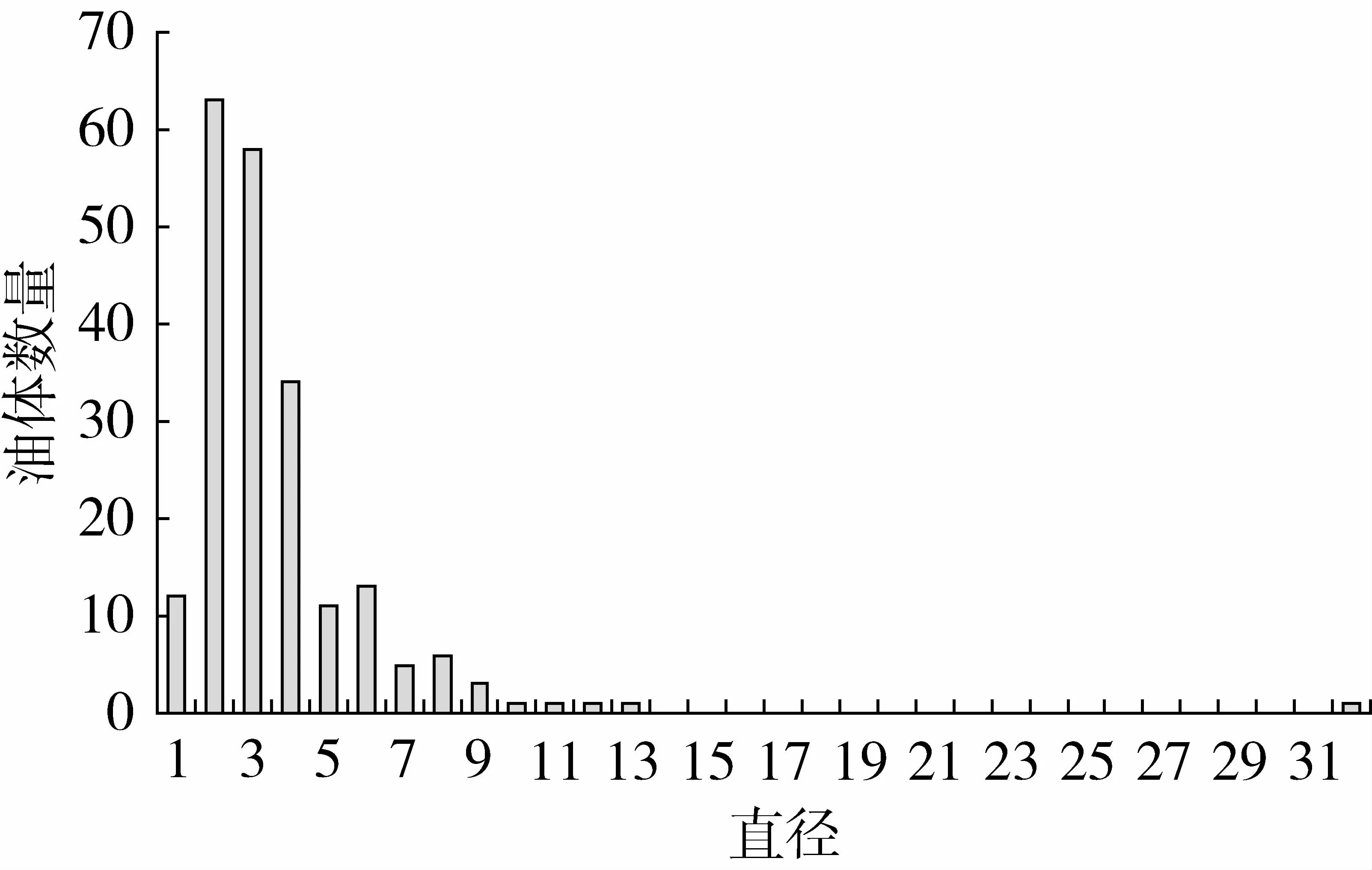
图2 油茶种子油体大小分布
迄今为止,国内外植物油体的形态观察已报道的植物有拟南芥[12]、甘蓝型油菜[13-14]、玉米[10]、大豆[18]等。通过对所报道的植物种类的油体大小进行比较[5],发现不同物种的种子中油体的大小不同,直径大小由小到大依次是:油菜、芥菜、棉花、亚麻、玉米、花生、芝麻、油茶。除油茶为木本植物外,前面7种均为草本植物,而油茶油体在其中为最大的,由此推测油体的大小可能与植物的类型也存在一定关系。
2.3 不同含油量的油茶种子子叶贮藏细胞内油体的分布观察
从7个油茶品系成熟种子子叶贮藏细胞内油体的LSCM观察图片(图1)中可以看出含油量越高的油茶品系细胞染色越深,细胞内油体排列更紧密,油体数量越多,并集中堆叠分布于细胞中央,不与细胞壁接触,边缘清晰;而含油量越低的品系细胞染色越浅,细胞内油体或分布于细胞壁边缘,或稀疏分散于细胞内,油体数量越少且不连续。此结果与相关文献所报道的甘蓝型油菜油体的描述结果类似[14,19]。
2.4 不同含油量油茶种子子叶贮藏细胞内含油体率统计分析
为准确反映不同含油量的油茶品系种子子叶细胞内油体含量的差异,从获取的图片中选取有代表性的细胞进行细胞面积与细胞内油体截面积之和的测量,并计算出含油体率(表2)。从表2中可以看出,7个油茶种子子叶细胞内油体量随着含油量的增加而增加,对油茶种子含油量和含油体率绘制标准曲线(图3)。可知油茶种子含油量越高,种子子叶细胞内含油体率越高,种子含油量与含油体率成正相关,与 Ting等[10]、Peng等[11]、董劲松等[14]所报道的结果一致。

表2 7个油茶品系含油量与含油体率的比较/%
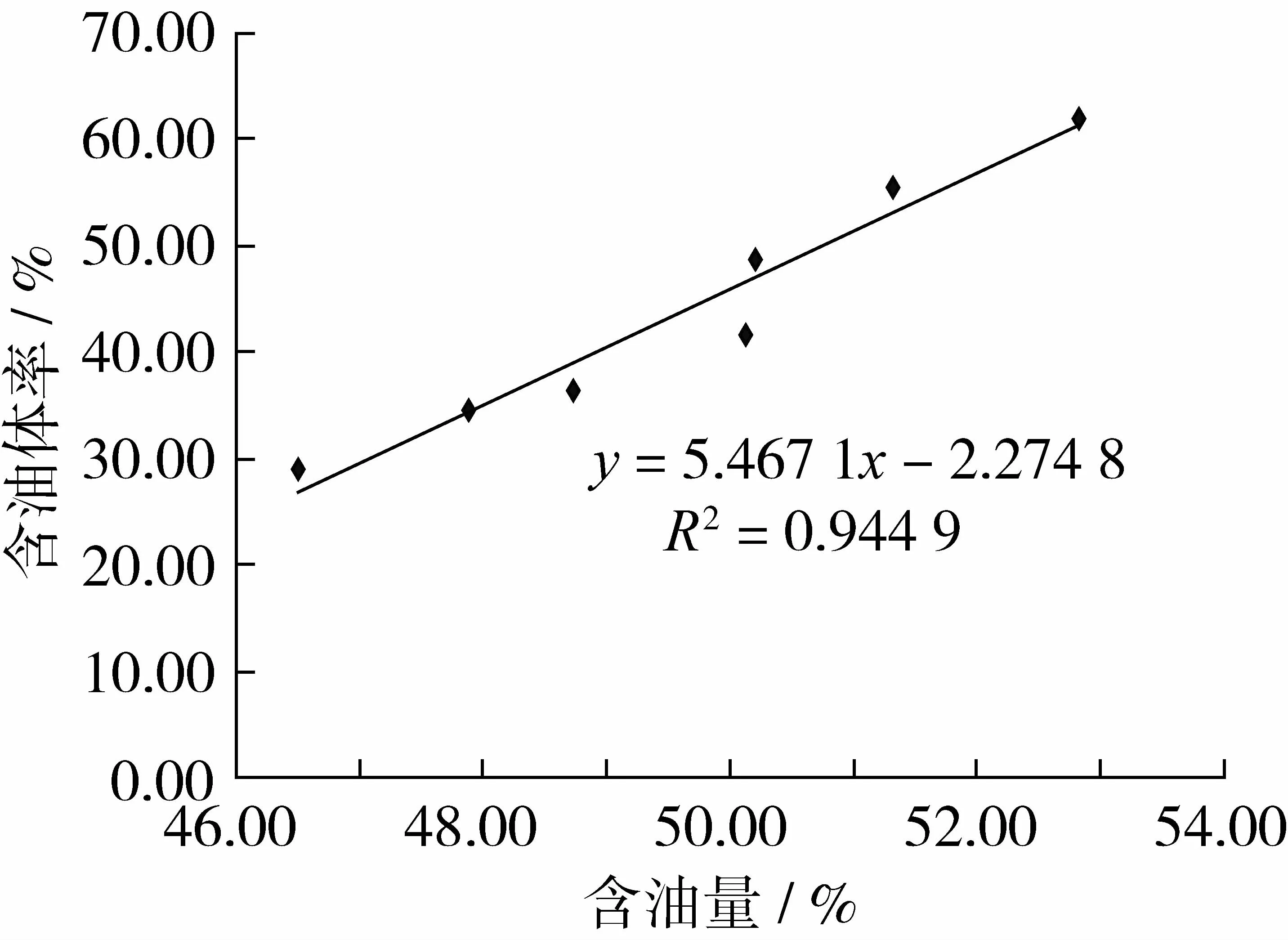
图3 油茶种子含油量和含油体率标准曲线
3 结论
通过测量不同含油量的油茶品系种子子叶细胞内的油体直径,未发现有明显差异,但是油体在细胞内的分布与截面面积差异较明显。油茶种子含油量越高,油体排列越紧密,截面面积越大。
采用冰冻切片机切片、荧光染料尼罗红染色和LSCM显微观察相结合技术,建立了油茶油体准确快捷观察与鉴定的研究体系,可为油茶油体的研究提供技术支持。利用含油量与含油体率的相关性以及不同含油量油茶种子子叶细胞内油体形态、分布的差异,可快速准确地判断油茶种子的含油量高低,为油茶高油品系的选育提供理论依据。
[1]仇键,谭晓风.植物种子油体及相关蛋白研究综述[J].中南林学院学报,2005(25):96-100
[2]Huang A H C.Oil bodies and oleosins in seeds[J].Annual Review of Plant Physiology and Plant Molecular Biology,1992,43:177-200
[3]Huang A H.Oleosins and Oil Bodies in Seeds and Other Organs[J].Plant Physiology,1996,110:1055-1061
[4]程红焱,宋松泉.种子的贮油细胞器—油体及其蛋白[J].植物学通报,2006(23):418-430
[5]Tzen J T C,Cao Y Z,Laurent P,et al.Lipids,proteins,and structure of seed oil bodies from diverse species[J].Plant Physiology,1993,101:267-276
[6]Frandsen G I,Mundy J,Tzen JTC.Oil bodies and their associated proteins,oleosin and caleosin[J].Physiologia Plantarum,2001,112:301-307
[7]赵传志,卢金东,苏磊,等.以油体作为生物反应器的研究进展[J].生物技术通报,2008(2):73-76
[8]庄瑞林.中国油茶(第2版)[M].北京:中国林业出版社,2008:54-127
[9]马力.茶油与橄榄油营养价值的比较[J].粮食与食品工业,2007,14:42-44
[10]Ting JT L,Lee K,Ratnayake C,et al.Oleosin genes in maize kernels having diverse oil contents are constitutively expressed independent of oil contents[J].Planta,1996,199:158-165
[11]Peng CC,Lin IP,Lin CK,et al.Size and stability of reconstituted sesame oil bodies[J].Biotechnology Progress,2003,19:1623-1626
[12]Siloto R M P,Findlay K,Lopez-villalobos A,et al.The accumulation of oleosins determines the size of seed oilbodies in Arabidopsis[J].The Plant Cell,2006,18:1961-1974
[13]Hu Z Y,Wang X F,Zhan GM,etal.Unusually large oilbodies are highly correlated with lower oil content in Brassica napus[J].Plant Cell Reports,2009,28:541-549
[14]董劲松,石东乔,高建芹,等.甘蓝型油菜油体数量及面积之和与含油量的相关性[J].植物学报,2009(44):79-85
[15]仇键.油茶种子油体蛋白基因的分离克隆及其原核表达[D].长沙:中南林业科技大学,2006
[16]Greenspan P,Mayer E P,Fowler SD.Nile red:a selective fluorescent stain for intracellular lipid droplets[J].The Journal of Cell Biology,1985,100:965-973
[17]董劲松.甘蓝型油菜(Brassica napus L.)油体发育机制及其与含油量相关性研究[D].南京:南京农业大学,2008
[18]SchmidtM A,Hermanb EM.Suppression of soybean oleosin producesmicro-oil bodies that aggregate into oil body/ER complexes[J].Molecular Plant,2008(1):910-924
[19]代柳亭.不同含油量甘蓝型油菜种子油脂分布、生理生化特性以及化学调控的研究[D].重庆:西南大学,2008.
