室温离子液体在有机合成中的应用研究进展
2014-03-10洪哲
洪 哲
(太原理工大学化学化工学院,山西 太原 030024)
室温离子液体(RTILs)通常是由有机阳离子和无机阴离子构成的一种室温熔盐。与传统的有机溶剂相比,RTILs 具有电化学窗口宽、固有导电性高、热稳定性强、不易挥发、溶解度大、极性可控等优良物理化学性能及优点,其可作为挥发性有机溶剂的绿色替代品,用于化学合成、生物溶解、电化学装置等领域[1]。RTILs 用作有机合成反应溶剂,同时还有催化功能,其反应速度快,区域选择性好,目标产率高,后处理简单,溶剂可以重复使用,具有绿色应用大好前景,相关研究具有一定应用价值。
1 Friedel-Crafts 反应
1.1 Friedel-Crafts 烷基化反应
Friedel-Crafts 反应是一类芳香族亲电取代反应,是制备烷基烃和芳香酮的方法。RTILs 中苯与1-氯丁烷的Friedel-Crafts 烷基化反应如式(1),由于中间碳正离子亲电性增强,所以反应选择性和产率较好,催化活性稳定,可重复使用[2]。在溶有Sc(OTf)3的[Bmim][PF6]、[Emim][SbF6]、[Emim][BF4]等离子溶液中,苯和多种烯烃发生的Friedel-Crafts 烷基化反应,其单烷基化目标产物的选择性较好,转化率较高[3],如十二碳烯和苯的烷基化反应。在通过微波辅助路易斯酸离子液体催化合成辅酶Q10 中间体的Friedel-Crafts烷基化反应中,一般随[Etpy][BF4]路易斯酸离子增强([Etpy][BF4]/AlCl3除外),其反应的催化活性增加,[Etpy][BF4]/ZnCl2催化活性最好,反应仅150 s,收率达89%[4]。在[Bmim][PF6]中吲哚的N-烷基化、2-萘酚的O-烷基化,其杂原子的烷基化目标产物选择性较好[5-6]。若将RTILs 负载于硅、碳等载体上进行反应,更有利于产物与催化剂分离。
1.2 Friedel-Crafts 酰基化反应
Friedel-Crafts 酰基化反应通常是在路易斯酸催化下,让酰氯与苯环进行酰化的反应,与传统工业合成相比,RTILs 中的Friedel-Crafts 酰基化反应转化率高、选择性好,易于回收、环境污染小,如苯甲醚、氯苯、甲苯在RTILs 中的酰基化反应。在[Bmim][Tf2N]/CO2均匀相中二茂铁进行酰化反应生成乙酰基二茂铁是可行的[7]。在[Emim][AlCl3]/甲苯中二茂铁的酰基化反应,单酰化产物的产率很高。在[Bmim][dca]中多种醇、酚和糖类的O-酰化反应,产率较高。
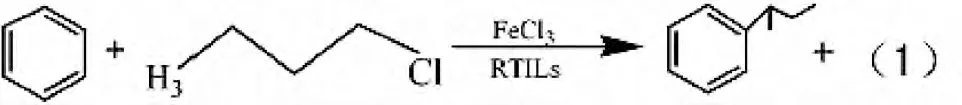
2 偶联反应
2.1 Heck 反应
Heck 反应是合成具有高选择性和高分子量共轭聚合物的有效方法。单齿亚磷酸酯如亚磷酸三苯酯等是Heck 交叉耦合反应良好和有效的配体[8]。与普通有机溶剂相比较,RTILs 中的Heck 反应时间缩短、催化剂稳定、溶剂和催化剂能循环使用,如钯催化烯烃与卤代芳烃或芳香酐生成芳香烯烃,如式(2)[9];而如溴化四烷基磷离子液体对钯催化剂有稳定作用,使钯原子在反应过程中不失活,不沉淀[10]。在三相系统[Bmim][PF6]/水/己烷中的Heck 反应,产物易于分离,反应体系可重复使用。

2.2 Suzuki 交叉偶联反应
Suzuki 偶联反应是碳-碳键结合反应,如二苯偶联、卤代物与有机硼酸偶联等。RTILs 中的Suzuki 反应避免了传统反应温度高、催化剂用量较大、稳定性差等缺点。用[Bmim][PF6]介入固载于氧化铝上的Pd(OAc)2催化芳卤与芳硼酸的耦合反应,可以防止催化剂流失,增强活性和稳定性,利于多次重复使用。在[Emim][BF4]中萘硼酸与氯代喹啉或异喹啉的Suzuki 反应,交叉偶联选择性好,产物收率较高。
2.3 Trost-Tsuji 反应
Trost-Tsuji 反应主要是碳-碳键、碳-氮键、碳-氧键的偶联,具有很好的区域选择性,如甲基环己烷/[Bmim]Cl 中钯催化亚甲基化合物烯丙基化反应,其反应速度明显提高[11]。
2.4 其他偶联反应
Stille 交叉偶联反应,如钯催化下有机锡化合物和不含β-氢的卤代烃的交叉偶联;碳-杂原子交叉偶联反应,如RTILs 中卤代芳烃与苯等取代磷化物的偶联;其他还有Rosenmund-von Braun反应、Sonogashira 反应、烯烃关环歧化等。
3 加成反应
3.1 环加成反应
3.1.1 Diels-Alder 反应
Diels-Alder 反应是合成桥环化合物的重要方法,如环戊二烯和甲基丙烯酸甲酯的Diels-Alder 反应,在极性RTILs 中主要生成内型产物,如式(3)。在丙氨酸甲酯硝酸盐([AME][NO3])催化的环戊二烯和甲基丙烯酸甲酯的Diels-Alder 反应中,[AME][NO3]起路易斯酸作用,其催化活性主要来源于[AME]阳离子[12]。固定化氧化锆纳米粉体在RTILs 中作为路易斯酸用于包含吡喃基骨架的多环杂环化合物的合成反应,经在不同溶剂中试验比较,用氧化镐(20%)作催化剂,在[Bmim][NO3]中的反应时间短,产率最高[13];[Bmim][NO3]具有水溶性,可用水洗涤分离,干燥后重复使用。RTILs 中用稀土金属三氟甲磺酸酯催化Diels–Alder 反应,可有效促进产品高收益和内/外立体选择性,而且Sc(OTf)3循环使用六次后其活性基本不变[14],同时发现Ce(OTf)4·5H2O 在[HMI][BF4]中效果更好。

3.1.2 其他环加成反应
CO2同环氧丙烷的环加成反应,如[Bmim][BF4]对CO2和环氧丙烷加成生成环状碳酸酯起很好催化作用;自由基环化加成反应,如在[Bmim][BF4]的CH2Cl2溶液中,用Mn(OAc)3催化α-甲基苯乙烯与1,3-二酮类化合物环加成,目标产率较高;还有1,3-二偶极环加成,苯醌类与乙烯衍生物的加成等。
3.2 非环加成反应
3.2.1 Michael 加成反应
Michael 加成是由一个亲电的共轭体系和一个亲核的碳负离子进行的共轭加成反应。与传统加成相比,RTILs 中的Michael 加成反应无需强碱催化,避免大量副反应,缩短反应时间,提高反应选择性,如[Bmim][OH]中活性亚甲基化合物与共轭酮、酯和腈化物的加成反应,时间缩短,产率提高,离子液体能重复使用[15]。用苯磺酸钠改性硅胶吸附[DBIM][SbF6]形成的催化体系,为在水中进行的吲哚衍生物和α,β-不饱和羰基化合物的反应提供疏水环境,从而提高催化剂性能[16]。
3.2.2 其他非环加成反应
氢化反应,如在[Bmim][BF4]中铼催化的环己烯氢化,再如[Bmim][PF6]中炔烃的锆氢化反应,(E)-烯基锆化合物的区域选择性和立体选择性高,若在Pd(PPh3)4存在下经与芳基卤化物交叉偶联反应,(E)-1,2-二取代乙烯收率高[17];氢胺化反应,如钯催化苯乙烯和苯胺的氢胺化加成等。
4 缩合反应
4.1 羟醛缩合
羟醛缩合反应较多用于药物及药物中间体等的合成。L-脯氨酸催化各种离子液相中结合醛与各种如丙酮、环戊酮等酮的非对称交叉羟醛缩合反应,产率范围从81%到99%[18]。将脯氨酸溶于改性[Bmim][BF4]中并固化到硅胶上,来催化羟醛缩合反应,比用[Bmim][PF6]的产率更高,活性更稳定。
4.2 Knoevenagel 缩合
Knoevenagel 缩合是醛或酮在弱碱催化下,与具有活泼α-氢原子的化合物缩合的反应,如与活性亚甲基化合物反应,如式(4)。用[Bmim][OH]催化脂肪醛或酮类与丙二酸二乙酯的Knoevenagel缩合,反应时间短,产率高。
4.3 缩醛反应
缩醛是有机合成中重要的中间体、香料等,缩醛作用是要保护羰基,如丁醛和乙二醇反应合成丁醛乙二醇缩醛。用BrΦnsted 酸性离子液体BAIL(1)催化醛或酮与醇反应,其选择性100%,转化率很高[19]。
5 氧化还原反应
5.1 氧化反应
在RTILs 中的氧化反应避免了许多传统氧化反应中如反应时间长、酸性强、毒性高、不稳定和收率低等弊端。用过氧化氢对烯烃和烯丙醇类化合物进行环氧化反应,速度较快,立体选择性好。
5.2 还原反应
RTILs 中不饱和烃如1-戊烯等的催化氢化,其反应速度比传统反应快几倍;在[Bmim][BF4]、[Bmim][PF6]等中用硼烷或硼氢化物把醛或酮还原到醇,其反应速度随反应温度提升而提高,活性不变[20]。
6 羰基化反应
6.1 氢甲酰化反应
氢甲酰化反应用于烯烃与氢气及一氧化碳在催化和高压下制备醛类,如在含有[AsF6]、[BF4]、[PF6]等阴离子溶液中铼催化烯烃(如1-戊烯)进行的氢甲酰化,与传统反应相比,其选择性和产率都有所提高。固载化的离子液体[Rh(acac)(CO)2]催化剂在氢甲酰化反应中性能更稳定。
6.2 其他羰基化反应
烯烃和醇的氢酯基化,如在[Bmim][BF4]中用钯催化叔丁醇氢酯基化获得异戊酸酯产物的反应,无须加入强酸;还有卤代芳烃的羰化反应、烷烃的羰化、苯胺的氧化羰化、炔醇的羰化等。
7 RTILs 在其他有机反应中的应用
叠氮反应,如短寡核苷酸功能化咪唑阳离子液体的烷基卤化物叠氮[21];Beckmann 重排,如环己酮肟在含磷化合物/RTILs 中重排制己内酰胺的反应;Baylis-Hillman 反应,如在[Bmim][BF4]中的反应速度是传统方法的三十倍;酰化反应,如在酶/RTILs 中黄酮类化合物与长链脂肪酸生成酯的反应[22];以及[Bmim][BF4]中乙酰化糖衍生物与硫醇合成硫代糖苷[23],双酸性离子液体的催化氧化噻吩脱硫反应等[24]。
8 结语
RTILs 在有机合成及催化等领域的应用是近年来新兴的绿色化学研究。RTILs 在溶解、催化、分离、回收等方面性能优越,用在有机合成反应上,克服了传统的固相、液相合成反应中存在的不足,使反应速度加快、区域选择理想、产物分离简便、催化剂活性基本不变、RTILs/催化剂可重复使用、成本降低、产率提高、污染减小。因此,有关多功能化RTILs 的许多反应理论及RTILs 绿色有机合成应用研究等更待进一步深入。
[1]Tiwari A K,Saha S K.Aggregation behaviour and thermodynamics of mixed micellization of gemini surfactants with a room temperature ionic liquid in water and water-organic solvent mixed media [J].The Journal of Chemical Thermodynamics,2013,60:29-40.
[2]应安国,叶伟东,刘泺,等.离子液体在有机合成中的应用研究进展[J].有机化学,2008,28(12):2081-2094.
[3]王寿武,冯莉,陈双平,等.离子液体及其在有机合成中的应用[J].日用化学工业,2005,35(2):102-106.
[4]Chen Y,Zu Y,Fu Y,et al.Efficient lewis acid ionic liquid-catalyzed synthesis of the key intermediate of coenzyme Q10 under microwave irradiation[J].Molecules,2010,15(12):9486-9495.
[5]郝苏霞,王桂荣,栾艳勤,等.离子液体在Friedel-Crafts反应中的应用进展[J].化工进展,2009,28(6):953-957.
[6]邹汉波,董新法,林维明.离子液体及其在绿色有机合成中的应用[J].化学世界,2004 (2):107-110.
[7]Kazemi S,Peters C J,Kroon M C.Phase behavior of the ternary system acetylferrocene,the ionic liquid 1-Butyl-3-methylimidazolium Bis (trifluoromethylsulfonyl) imide,and carbon dioxide to be applied in Friedel–Crafts acylation reactions [J].Journal of Chemical &Engineering Data,2013,58(4):951-955.
[8]Cárdenas J C,Fadini L,Sierra C A.Triphenylphosphite and ionic liquids:positive effects in the Heck cross-coupling reaction[J].Tetrahedron Letters,2010,51(52):6867-6870.
[9]石家华,孙逊,杨春和,等.离子液体研究进展[J].化学通报,2002(4):243-250.
[10]张所波,丁孟贤,高连勋.离子液体在有机反应中的应用[J].有机化学,2002,22(3):159-163.
[11]顾彦龙,彭家建,乔琨,等.室温离子液体及其在催化和有机合成中的应用[J].化学进展,2003,15(3):221-241.
[12]Zhu X,Liu J,Zhang D,et al.Theoretical illustration on the catalytic effect of alanine methyl ester nitrate ionic liquid on the Diels–Alder reaction between cyclopentadiene and methacrylate [J].Computational and Theoretical Chemistry,2012,996:21-27.
[13]Balalaie S,Poursaeed A,Khoshkholgh M J,et al.Zirconium oxide (NP)-ionic liquid as an efficient media for the domino Knoevenagel hetero Diels-Alder reaction with unactivated alkynes[J].Comptes Rendus Chimie,2012,15(4):283-289.
[14]Sarma D,Kumar A.Rare earth metal triflates promoted Diels–Alder reactions in ionic liquids [J].Applied Catalysis A:General,2008,335(1):1-6.
[15]陈晓伟,包宗宏.室温离子液体的应用进展[J].精细石油化工,2006,23(2):60-64.
[16]赵地顺,杨洁,张娟,等.固载化离子液体在有机合成中的应用进展[J].现代化工,2011,31(1):15-19.
[17]Huang B,Wang P,Hao W,et al.The first example of hydrozirconation of alkynes in room temperature ionic liquids[J].Journal of Organometallic Chemistry,2011,696(13):2685-2688.
[18]Hakkou H,Carrié D,Paquin L,et al.Ionic liquid-phase organic synthesis (IoLiPOS) methodology applied to cross aldol reaction [J].Russian Journal of Organic Chemistry,2011,47(3):371-373.
[19]吕雪霞,乐长高.Br-nsted 酸性离子液体在有机合成中的应用[J].化学试剂,2010,32(8):702-706.
[20]刘晓庚,陈梅梅,刘长鹏,等.室温离子液体在化学合成和萃取分离中的应用[J].化学世界,2006(10):629-635.
[21]Jadhav A H,Kim H.Short oligo (ethylene glycol) functionalized imidazolium dicationic room temperature ionic liquids:Synthesis,properties,and catalytic activity in azida tion[J].Chemical Engineering Journal,2012,200:264-274.
[22]Lue B M,Guo Z,Xu X.Effect of room temperature ionic liquid structure on the enzymatic acylation of flavonoids[J].Process Biochemistry,2010,45(8):1375-1382.
[23]Santra A,Sau A,Misra A K.Synthesis of Thioglycosides in Room Temperature Ionic Liquid[J].Journal of Carbohydrate Chemistry,2011,30(2):85-93.
[24]王金龙,何志强,吴业帆,等.Br覬nsted-Lewis 双酸性离子液体的 合成与应 用[J].化工进展,2012,31(11):2460-2464.
