慢病毒载体介导增强型绿色荧光蛋白转染大鼠角膜的效率及其毒性研究
2014-03-02刘立赵敏
刘立,赵敏
与其他病毒比较,慢病毒具有转染效率高、遗传表达稳定、能感染多种细胞等优势[1],近年来开始用于眼科研究。眼球具有易于操作和观察的特点,是眼科基因治疗的优势之一。选择最佳的给药途径以作用于靶向组织是当前基因治疗研究的热点。有学者通过角膜基质注射和刮除角膜上皮敷贴两种途径进行慢病毒转染,发现角膜基质注射效率更高,但该操作技术要求较高[2],且对角膜有明显的侵袭性,需要寻找其他更简便高效的转染途径。慢病毒载体来源于人免疫缺陷病毒1型、2型(HIV-1、HIV-2),猫免疫缺陷病毒(FIV)和猿免疫缺陷病毒(SIV)[3]。研究发现,将反转录病毒载体转染造血干细胞后移植,可导致X染色体连锁重症联合免疫缺陷(SCID-X1)患者发生白血病,表明病毒载体的使用存在一定安全问题[4]。本实验观察并分析慢病毒载体介导的增强型绿色荧光蛋白(LV-EGFP)转染大鼠角膜的效率及其毒性,以筛选慢病毒转染角膜的最佳途径,为临床应用提供实验依据。
1 材料与方法
1.1 实验动物及主要器材 SPF级健康成年SD大鼠25只,体重160~180g,雌雄不限(重庆医科大学动物实验室提供),大鼠的相关处理符合美国眼科协会有关规定。慢病毒载体LV-EGFP(元件顺序为mU6-MCS-Ubi-EGFP,上海吉凯基因公司合成)。倒置荧光显微镜(Olympus公司,日本)。RPMI 1640培养液及2%热灭活的胎牛血清(FCS,Hyclone公司,美国),硫酸链霉素及青霉素(华北制药华胜有限公司),L-谷氨酰胺(Invitrogen公司,美国)。
1.2 实验分组 原始病毒滴度测定为1.5×109TU/ml,使用Enhanced Infection Solution进行稀释,转染前1h使用聚凝胺(浓度为10μg/ml)与慢病毒进行等体积充分混合,并静置于4℃冰箱。按照完全随机分组法分组。感染复数(multiplicity of infection,MOI)以大鼠角膜内皮细胞为目标细胞计算。A组:MOI=5点眼组;B组:MOI=5结膜下注射组;C组:MOI=10点眼组;D组:MOI=10结膜下注射组;E组:MOI=10离体转染组。MOI=5和MOI=10分别对应病毒量为3×105TU/角膜和6×105TU/角膜,稀释后的体积分别为5μl及10μl。A、B组以及C、D组分别来自同一大鼠的左眼及右眼。A、B组共用10只大鼠,C、D组共用10只大鼠(在实验过程中A、B组大鼠和C、D组大鼠各死亡1只,实际统计数据分别为9只),离体转染组使用5只大鼠。
1.3 转染模型的建立 活体转染:所有大鼠均采用10%水合氯醛(3ml/kg)腹腔注射进行全身麻醉,并联合使用1%盐酸奥布卡因进行眼部局麻。转染前1h使用聚凝胶(浓度为10μg/ml)与慢病毒进行等体积充分混合,并静置于4℃冰箱。待大鼠麻醉效果满意后,结膜下注射组用微量注射器于右眼9点位角膜缘外约2mm结膜处进针,缓慢注射,注射完毕后以棉签轻按注射处,迅速退出针头,以防止病毒液在针头退出时被带出。点眼组使用微量注射器将病毒液缓慢均匀滴注到大鼠角膜表面。因大鼠结膜囊容量有限,共分3次滴完,每次间隔2min。各组大鼠每日给予病毒1次,连续7d。
离体转染:取出以水合氯醛过量麻醉处死的大鼠眼球,采用10%聚维酮碘持续冲洗2min,平衡液冲洗2次,洗净聚维酮碘;沿距角膜缘周围1~2mm,以角膜缘为同心圆将角膜及巩膜一同剪下,将其置于96孔板内。将LV-EGFP以6×105TU/角膜(即MOI=10)加入孔中,同时加入离体培养液(RPMI 1640培养液、100U/ml青霉素、100mg/ml硫酸链霉素、2mmol/L谷氨酰胺和2%热灭活FCS)2ml进行转染,每次转染时间6h,每24h更换离体培养液及病毒液,连续7d后取出角膜。
1.4 角膜荧光观察 活体转染组转染7d后于显微镜下完整取下双眼角膜,离体转染组直接从转染液中取出,置于4%多聚甲醛中固定24h,梯度乙醇脱水,二甲苯透明,石蜡包埋后进行连续切片,厚度约为6μm,置于烤箱烘干后在荧光显微镜下观察荧光强度及分布情况并拍照。
1.5 HE染色及观察 将已经切片的角膜组织行常规HE染色,并于显微镜下观察各组角膜细胞的形态,有无炎性细胞浸润,有无凋亡细胞,以确定慢病毒对角膜细胞是否存在毒性。
1.6 统计学处理 采用SPSS 19.0软件进行统计分析。所有图片均在同一显微镜下观察,拍摄参数均相同,且于同一天拍摄完成。荧光图片采用Image Pro Plus 6.0软件进行处理,将荧光强度转换为光密度(A)值,数据资料以x±s表示。相同MOI值组别之间比较采用配对t检验,不同MOI组之间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 荧光显微镜下荧光分布情况 各组角膜全层出现明显荧光表达,主要分布于上皮细胞和内皮细胞,较基质细胞表达增强。点眼方式转染角膜荧光分布均匀,全层角膜出现较强荧光表达,角膜细胞形态未见明显改变。结膜下注射方式转染角膜全层均有荧光分布,但分布不均匀,主要成团分布于角膜内皮细胞附近。离体转染全角膜呈强荧光表达,近内皮细胞处可见少许成团分布(图1)。
2.2 角膜荧光强度比较 各组荧光强度分别为:A组0.1803±0.0440,B组0.1061±0.0434,C组0.2369±0.0157,D组0.2002±0.0307,E组0.2434±0.0173。相同MOI不同转染途径两组比较(A组与B组、C组与D组比较),点眼方式的荧光表达较结膜下注射方式更加强烈(P<0.05)。相同转染方式的两组相比(A组与C组、B组与D组比较),高MOI组荧光表达更强烈(P<0.05)。E组荧光强度与C组比较差异无统计学意义(P>0.05),但与其他各组比较差异均有统计学意义(P<0.05)。
2.3 HE染色观察 各组角膜结构完整,各细胞层次清晰,层间未见炎性细胞分布,未见新生血管,细胞形态正常,未见明显细胞凋亡。离体转染角膜经7d培养液转染后,角膜内皮细胞仍然生长良好,未见内皮细胞皱缩、变形及缺失等病理改变(图2)。
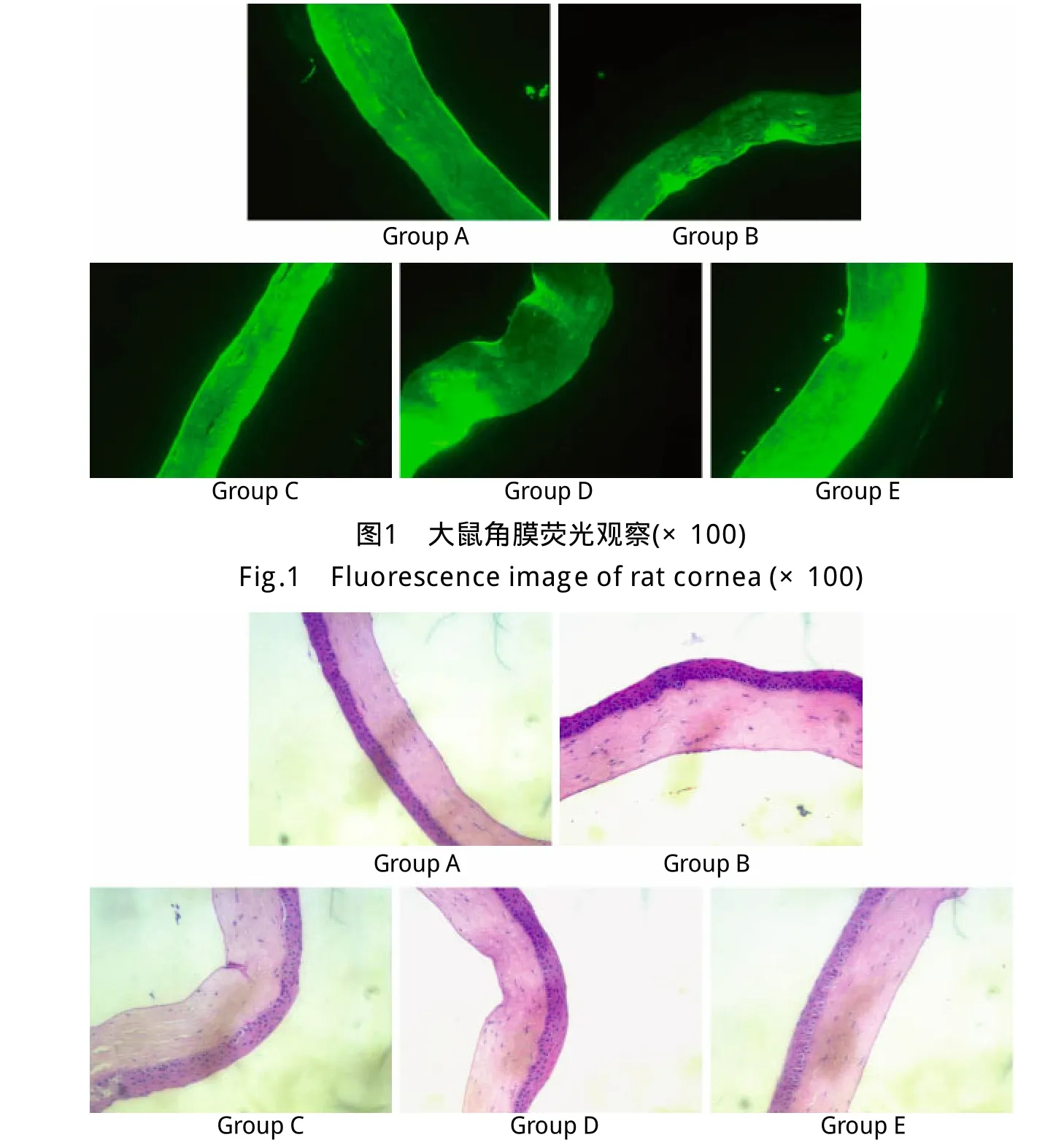
图2 大鼠角膜病理分析(HE ×100)Fig.2Histopathologic image of rat cornea (HE ×100)
3 讨 论
EGFP报告基因在反转录病毒、腺病毒等载体转移系统中被广泛用于基因转移效率的评估。本实验首先建立了3种不同角膜转染途径的动物模型,即点眼方式、结膜下注射方式和离体角膜转染方式。这3种转染方法简便易行,其中点眼和结膜下注射为眼科最常用的给药方式,便于实施。分析角膜荧光强度发现,在相同MOI条件下,点眼方式的角膜荧光强度高于结膜下注射方式(P<0.05),且荧光在角膜的分布更为均匀。结膜下注射角膜荧光强弱不均,较强荧光主要出现在角膜内皮层附近。导致点眼方式转染效率较高的原因可能与点眼后药物主要分布于眼前节组织如结膜、角膜、房水等有关,结膜下注射除上述组织获得高度药物浓度外,晶体和玻璃体内亦存在一定量药物,其分布范围广于点眼方式。因此,在相同MOI条件下,通过结膜下注射方式进入角膜的病毒数量少于点眼方式。
离体转染方式角膜荧光强度与同浓度点眼方式差异无统计学意义(P>0.05),可能与房水-角膜屏障和角膜上皮屏障有关。一方面,角膜内皮细胞间形成紧密连接,不仅可阻止房水进入细胞外间隙,具有角膜-房水屏障功能,而且能主动泵出水分,阻止房水进入角膜基质内而致角膜基质层水肿,维持角膜相对脱水状况。从采用结膜下注射的B、D两组结果可以看出,通过房水进入角膜的慢病毒主要集中在角膜内皮层附近,且成团状分布。另一方面,角膜中成熟的上皮细胞分布于整个角膜上皮层,由角膜边缘向角膜中心迁移,并覆盖于角膜顶端,最顶端的角膜上皮细胞为紧密连接,限制了细胞间药物的渗透以及病菌的通过[5]。从各组角膜荧光强度可以看出,EGFP主要表达于角膜上皮和角膜内皮细胞,基质细胞表达较少。另外,可能由于病毒量较少,MOI是根据内皮细胞数量计算的,而内皮细胞在角膜的3层结构中数量最少,以致病毒数量不能保证整个角膜的细胞都能很好地感染病毒。A、C组以及B、D组在相同转染途径下,荧光强度比较差异有统计学意义(P<0.05),表明随着病毒浓度升高,病毒转染效率提高,EGFP在角膜上的表达增多。
在低MOI病毒感染情况下5组角膜细胞均未发生病理改变,各组角膜细胞形态完整,各层结构清晰。采用离体方式对角膜进行长时间持续转染后,角膜内皮细胞生长良好,未见缺失,表明角膜在低MOI慢病毒感染条件下安全、无毒性。
慢病毒载体可以感染多种细胞,包括分裂细胞和非分裂细胞[6],更有研究指出,慢病毒载体可以转染所有哺乳动物细胞[7],表明可将其用于T淋巴细胞的转染,以解决角膜移植免疫排斥反应的问题。慢病毒载体的优势在于来源广泛,易于大量获得,感染效率较高,可稳定而长期地表达目的基因,且不会引起非特异性反应[8-9]。载体的正确选择是转染成功的关键因素,本实验中使用的慢病毒来源为HIV-1。
转染途径是将慢病毒成功运用于活体转染的另一重要因素。由于眼球部位的特殊性,即其位于人体体表,且角膜位于眼球外层,使得角膜转染途径便利且易于观察。从本实验来看,对比两种眼科临床最常用的给药方式,点眼方式能更好地感染角膜。从给药简便性和患者依从性来看,点眼方式均明显优于侵入性操作的结膜下注射。本实验为点眼给药途径用于慢病毒转染提供了良好的依据。
综上所述,LV-EGFP能在较低MOI下有效转染大鼠角膜,且点眼方式比结膜下注射的转染效率更高,而提高MOI可提高角膜转染的效率,大鼠角膜在较低MOI下持续转染的安全性良好。但本实验只探讨了低MOI情况下慢病毒对角膜的毒性作用,如果需使用更高浓度的慢病毒用于角膜的基因治疗,则需要对其遗传毒性进行更全面和深入的研究。
[1]Yang J, Lu Y, Guo LH, et al. Construction of bicistronic lentiviral vectors carrying HSV-tk and EGFP gene [J]. Chin J Ophthalmol,2007, 43(5): 387-392. [杨晋, 卢奕, 郭礼和, 等. 绿色荧光蛋白和胸苷激酶基因共表达的慢病毒载体的构建及表达[J].中华眼科杂志, 2007, 43(5): 387-392.]
[2]Bin L, Du ZY, Xu YC. Study on the effectiveness of Lentidviral vector-mediated enhanced green fluorescent protein transfection in vivo via two ways of corneal stromal cells in rats [J]. Laser J,2011, 32(2): 57-59. [宾莉, 杜之渝, 许寅聪. 慢病毒载体介导增强型绿色荧光蛋白两种途径体内转染大鼠角膜基质细胞有效性的试验研究[J]. 激光杂志, 2011, 32(2): 57-59.]
[3]Chen CY, Liu YJ, Niu ZY. Research and application of lentiviral vectors carrying [J]. Chin J Prosthodont, 2012, 13(2): 117. [陈彩云, 刘亚京, 牛忠英. 慢病毒载体的研究进展及应用[J]. 口腔颌面修复学杂志, 2012, 13(2): 117.]
[4]Hacein-Bey-Abina S, Von Kalle C, Schmidt M, et al. LMO2-associated clonal T cell proliferation in two patients after gene therapy for SCID-X1[J]. Science, 2003, 302(5644): 415-419.
[5]Mannermaa E, Vellonen KS, Urtti A. Drug transport in corneal epithelium and blood--retina barrier: emerging role of transporters in ocular pharmaeokinefics[J]. Adv Drug Deliv Rev,2006, 58(11): 1136-1163.
[6]Gao SF, Zhang SR, Xu L, et al. Effect of small interfering RNA targeting CD47gene mediated by lentivirus vectors on proliferation and apoptosis of human laryngocarcinoma Hep-2cells[J]. Med J Chin PLA, 2013, 38(8): 634-638. [高树峰, 张少容, 徐莲, 等. 慢病毒介导的siRNA靶向CD47基因对人喉癌细胞Hep-2增殖、凋亡的影响[J]. 解放军医学杂志, 2013,38(8): 634-638.]
[7]Naldini L, Blomer U, Gallay P, et al. In vivo gene delivery and stable transduction of non dividing cells by a lentiviral vector[J].Science, 1996, 272(5259): 263-267.
[8]Wang XF, He YL, Liu MB, et al. Effect of lentiviral-mediated Bcl-2gene on primary human ovarian granulosa cells[J]. Med J Chin PLA, 2012, 37(8): 760-764. [王雪峰, 何援利, 刘木彪, 等. 携带Bcl-2基因的慢病毒对原代培养的人卵巢颗粒细胞的影响[J]. 解放军医学杂志, 2012, 37(8): 760-764.]
[9]Wang L, Xu XH, Zhang NK, et al. Transfection of lentivirus recombined with marker gene into human umbilical cord Wharton's Jelly-derived mesenchymal stem cells[J]. Tianjin Med J, 2013, 41(10): 985-988. [王力, 徐小红, 张宁坤, 等. 携带标记基因的慢病毒载体转染人脐带华通胶间充质干细胞的实验研究[J]. 天津医药, 2013, 41(10): 985-988.]
