α-生育酚琥珀酸酯对急性放射病小鼠早期造血损伤的防护作用观察
2014-03-02贾超张刘珍邢爽柳晓兰善亚君丛悦崔宇王丽梅从玉文
贾超,张刘珍,邢爽,柳晓兰,善亚君,丛悦,崔宇,王丽梅,从玉文
骨髓内造血干/祖细胞受到外界刺激后可迅速释放到外周血中[1]。急性放射病时骨髓造血功能障碍,造血干/祖细胞数量显著减少[2],但残存的造血干/祖细胞功能尚未完全损伤,保护照射后骨髓残存造血干/祖细胞可以促进自身造血功能的重建。维生素E衍生物α-生育酚琥珀酸酯(α-tocopherol succinate,α-TOS)具有独特的药理保健功能及免疫调节和细胞保护作用[3],且其抗氧化作用强于生育酚[4]。研究显示,在照射前24h皮下注射400mg/kg α-TOS对经致死剂量照射的CD2F1小鼠具有明显的保护作用[5],但α-TOS对射线照射后早期造血干/祖细胞的影响鲜有报道。本研究观察了α-TOS对60Co γ射线照射C57BL/6J雄性小鼠早期造血功能的保护作用。
1 材料与方法
1.1 主要试剂及仪器 D-α-生育酚琥珀酸酯(C33H54O5)购于美国Sigma公司,批号SL10043,1210U/g,以4%的DMSO完全溶解后,用聚乙二醇(PEG400)配成8.8mg/ml的溶液。MEK-7222K全自动血细胞分析仪(日本光电工业株式会社公司),FACSVerse流式细胞仪(美国BD公司),MEK-640外周血象检测稀释液(日本光电工业株式会社公司);IMDM培养基(Gibco,上海立菲生物技术公司),甲基纤维素培养基(StemCell,Methocult M3434)。
1.2 实验动物及分组 实验采用6~8周龄SPF级C57BL/6J雄性小鼠,体重22±2g,购自北京华阜康生物科技股份有限公司,动物质量合格证证号SCXK(京)-2009-0004。购回后在军事医学科学院实验动物中心饲养,动物饲养设施合格证号SYXK-(军) 2007-004。照射前1周将实验动物分笼饲养于SPF级动物房(每笼5只),自由饮水,标准饲料经60Co γ射照射除菌后喂养。照射前24h将实验动物称重并随机分组,α-TOS组小鼠皮下注射400mg/kg α-TOS (0.1ml/只),正常对照和照射对照组小鼠皮下注射辅剂PEG4000.1ml/只。竞争抑制实验中,绿色荧光蛋白(EGFP)转基因小鼠由军事医学科学院实验动物中心赠送,并于该中心饲养。
1.3 动物照射 将实验动物放入有机玻璃盒内行钴源照射,照射距离4.5m,一次全身照射不同剂量,照射量率67~69cGy/min。照射后小鼠送回动物房饲养,每日观察。
1.4 存活实验 20只小鼠称重后随机分成照射对照组和α-TOS组(n=10),两组照射剂量均为9.0Gy,照射量率68.5cGy/min。照射后连续30d观察动物存活数,绘制存活曲线。
1.5 外周血象检测 30只小鼠随机分为正常对照组、照射对照组和α-TOS组(n=10)。照射对照组和α-TOS组小鼠接受一次性6.5Gy全身照射,照射量率67.1cGy/min。给药前1h从每只小鼠尾静脉取血20μl,快速吹打进装有2ml外周血象检测稀释液的EP管中,采用全自动血细胞分析仪检测血象,作为0d的数据,照射后1、4、7、10、14、18、22、31、45d割尾取血检测外周血象。
1.6 骨髓有核细胞(BMNCs)计数 12只小鼠随机分成正常对照组、照射对照组和α-TOS组(n=4)。照射对照组和α-TOS组小鼠接受一次性6.5Gy全身照射,照射量率68.0cGy/min。照射后2h、24h脱臼处死动物,75%乙醇浸泡消毒,剥取小鼠股骨,剔除股骨肌肉,用2%FBS IMDM缓冲液、7号针头冲出骨髓,过4号针头制成骨髓单细胞悬液,吹打均匀,细胞计数板计数BMNCs数量。
1.7 骨髓细胞集落培养 将1.6获取的BMNCs加入甲基纤维素培养基,调整细胞密度为5×104/ml,然后接种于12孔培养板,1ml/孔,每组3只复孔,在37℃、5% CO2培养箱中培养,第4天计数红细胞集落生成单位(CFU-E,大于8个细胞/集落),第7天分别计数粒细胞-单核细胞集落生成单位(CFU-GM,大于50个细胞/集落)、爆式红系集落生成单位(BFU-E,大于50个细胞/集落)、巨核细胞集落形成单位(CFU-MK,大于3个细胞/集落)、混合集落生成单位(CFU-Mix,含有粒、红、巨噬和巨核多个造血细胞系列的集落)。计数红系BFU-E时,需进行二甲氧基联苯胺染色,集落细胞呈棕红色者为阳性。
1.8 骨髓竞争移植实验 供体小鼠一:C57BL/6J小鼠分为正常对照供体、照射对照供体和α-TOS给药供体3组,每组4只,按1.2方式给药,照射对照组和α-TOS给药组供体一次性全身照射6.5Gy,照射量率67.3cGy/min。照射后2h取股骨冲出骨髓单细胞,计数后重悬细胞,调整密度至2×107/ml。供体小鼠二:EGFP转基因小鼠4只,取股骨冲出骨髓单细胞,计数后重悬细胞,调整密度至2×106个/ml。将供体小鼠一的3组小鼠骨髓细胞悬液分别与供体小鼠二的骨髓细胞悬液等体积混合,细胞数量比例为10:1。
受体小鼠:C57BL/6J小鼠30只,一次性全身照射9.0Gy,照射量率67.3cGy/min。照射后6h随机分为3组,每组10只动物,分别接受上述混合BMNCs经尾静脉注射移植后分为正常对照组、照射对照组和α-TOS组。受体鼠接受来自C57BL/6J小鼠的移植细胞数为2×106个/只,来自EGFP转基因小鼠的移植细胞数为2×105个/只。移植后35d各受体鼠割尾取血,流式细胞仪检测EGFP阳性细胞的比例。
1.9 统计学处理 采用SPSS 12.0软件进行统计分析,数据结果以x±s表示,采用Origin Pro8软件包进行作图。存活实验中两样本的比较采用独立样本t检验;其他实验多个样本均数的比较采用单因素方差分析(One-way ANOVA),外周血细胞数据的比较采用重复测量的方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 α-TOS对9.0Gy照射小鼠存活率的影响 照射对照组小鼠照射后第9天开始出现死亡,第13天全部死亡,存活时间为10±1d(图1)。α-TOS组小鼠从照射后第12天开始出现死亡,30d小鼠存活率为40%,死亡鼠存活时间15±6d。与照射对照组比较,α-TOS可明显提高9.0Gy照射小鼠30d存活率,并显著延长死亡动物存活时间(P<0.01)。照射前24h皮下给予400mg/kg α-TOS后小鼠未出现明显不良反应。
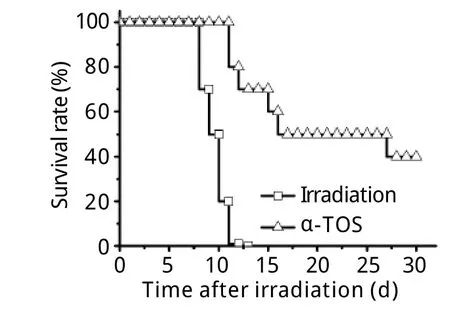
图1 α-TOS对9.0Gy γ射线照射小鼠存活率的影响Fig. 1Effect of α-TOS on survival rate of 9.0Gy γ-ray irradiated mice
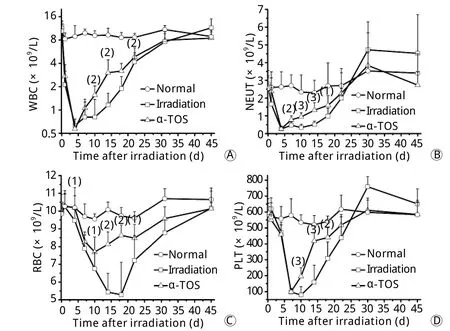
图2 α-TOS对6.5Gy γ射线照射小鼠外周血象的影响Fig. 2Effect of α-TOS on peripheral blood cells in mice irradiated with 6.5Gy γ-ray
2.2 α-TOS对6.5Gy照射小鼠外周血象的影响 照射后1d小鼠外周血白细胞数(WBC)急剧下降,第4天达最低值,随后开始恢复,但回升缓慢,第10天仍维持较低水平,而α-TOS组回升迅速,照射后第10、14、18、31天明显高于照射对照组(P<0.01),31d基本恢复至正常水平(图2A)。照射后1d小鼠外周血中性粒细胞(NEUT)即开始下降,第4天达最低值,随后开始恢复,α-TOS组照射后第7、10、14、18天明显高于照射对照组(P<0.05,P<0.01,P<0.001,图2B)。照射对照组小鼠外周血红细胞(RBC)呈进行性下降,第18天达最低值,随后开始恢复;α-TOS组小鼠外周血RBC在照射后第4天高于照射对照组(P<0.05),第10天开始恢复,恢复开始时间明显早于照射对照组,且明显提高了最低值水平(P<0.05),照射后第14、18、22、31天外周血RBC均明显高于照射对照组(图2C)。照射对照组小鼠外周血小板(PLT)在照射后快速下降(图2D),第10天达最低值,α-TOS组小鼠第10、14、18天均明显高于照射对照组(P<0.01)。
2.3 α-TOS对6.5Gy照射小鼠照射后2h骨髓造血祖细胞的影响 6.5Gy照射后2h小鼠BMNCs总数无明显变化(表1)。图3反映了小鼠受照后2h骨髓造血祖细胞数目和集落生成能力,与照射对照组比较,α-TOS组集落形成数无明显升高,通过CFCs及MPCs计算小鼠每根股骨中有增殖能力的造血祖细胞数目,结果显示α-TOS组的粒-巨噬系祖细胞、巨核系祖细胞、多向系祖细胞数均明显低于照射对照组(P<0.05,P<0.01)。
2.4 α-TOS对小鼠受照射后24h骨髓造血祖细胞的影响 照射后24h,受照射小鼠BMNCs明显减少,照射对照组与α-TOS组比较无明显差异(表1)。小鼠骨髓造血祖细胞数目和集落生成能力如图4所示,与照射对照组比较,α-TOS组各系集落数均有明显升高(P<0.01),红系各期祖细胞、粒-巨噬系祖细胞、巨核系祖细胞、多向系祖细胞数均高于照射对照组(P<0.01,P<0.05)。
表1 小鼠受照射后2h、24h BMNCs计数(×106/股骨,,n=4)Tab. 1Number of mice bone marrow nucleated cells at 2and 24hours after irradiation(×106per femur,, n=4)
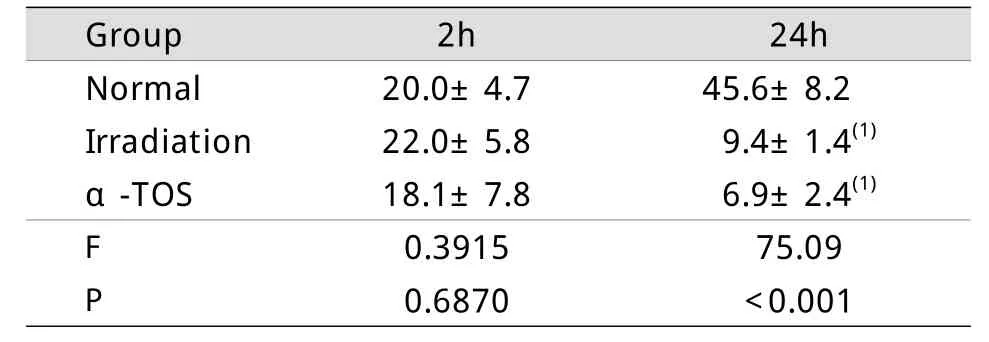
表1 小鼠受照射后2h、24h BMNCs计数(×106/股骨,,n=4)Tab. 1Number of mice bone marrow nucleated cells at 2and 24hours after irradiation(×106per femur,, n=4)
(1)P<0.001compared with normal group
Group 2h 24h Normal 20.0±4.7 45.6±8.2Irradiation 22.0±5.8 9.4±1.4(1)α-TOS 18.1±7.8 6.9±2.4(1)F 0.3915 75.09P 0.6870 <0.001
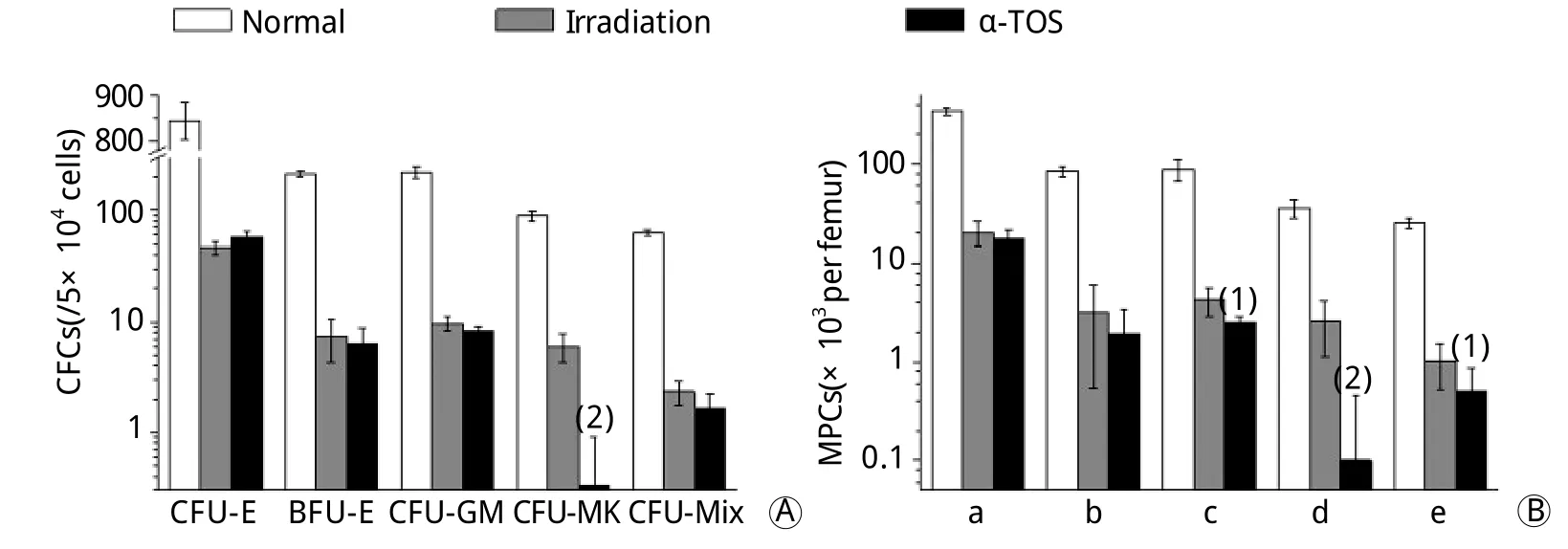
图3 α-TOS对6.5Gy γ射线照射后2h小鼠骨髓造血祖细胞的影响Fig. 3Effects of α-TOS on bone marrow progenitor cells in mice at 2hours after 6.5Gy γ-ray irradiation
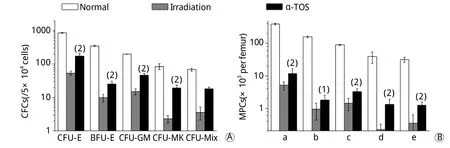
图4 α-TOS对6.5Gy γ射线照射后24h小鼠骨髓造血祖细胞的影响Fig. 4Effects of α-TOS on bone marrow progenitor cells in mice at 24hours after 6.5Gy γ-ray irradiation
2.5 α-TOS对受照小鼠骨髓造血干细胞的影响将各供体组与正常EGFP小鼠的骨髓细胞混合移植后35d,检测各受体组小鼠外周血中EGFP阳性细胞比例(图5)。正常对照组小鼠中,EGFP比例接近0,说明在造血重建过程中,来自正常小鼠C57BL/6J的骨髓细胞与来自EGFP小鼠的骨髓细胞相比具有绝对优势。而接受照射的小鼠骨髓细胞与来自EGFP小鼠的骨髓细胞按10:1比例共输注后,EGFP小鼠骨髓细胞承担了主要的造血重建功能,与照射对照组比较,α-TOS受体组小鼠EGPF阳性细胞比例明显下降(80.11% vs 85.65%,P<0.01),即来自α-TOS供体组的小鼠干细胞发挥了较好的作用,说明α-TOS明显保护了受照射小鼠骨髓干细胞的活性和能力。
3 讨 论
骨髓中有核细胞以粒细胞系统、红细胞系统和淋巴细胞系统为主,还有少量单核细胞、巨核细胞和其他一些骨髓细胞,并且各系统血细胞中的原始阶段细胞极少,以成熟阶段细胞为主。辐照损伤后,骨髓有核细胞总数减少,红系细胞比例大幅下降。造血祖细胞是造血干细胞分化成骨髓造血原始细胞之前的中间发育阶段,虽然其增殖能力有限,但对造血损伤后血细胞减少阶段和恢复期的造血重建具有重要意义,其数量的维持依赖于造血干细胞的增殖分化[6]。造血干细胞是辐射损伤后造血功能重建的基础,造血干细胞死亡或增殖能力丧失,使血细胞生成夭折于起始阶段是照后全血细胞减少的重要原因,如果受照射的造血干细胞残存并保留部分增殖分裂能力,则具有迅速恢复的潜能。
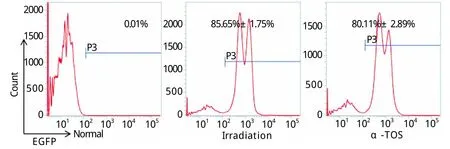
图5 α-TOS对6.5Gy γ射线照射后2h小鼠骨髓干细胞的影响Fig. 5Effects of α-TOS on bone marrow stem cells in mice at 2hours after 6.5Gy γ-ray irradiation
本研究结果表明,维生素E的衍生物α-TOS可有效提高9.5Gy致死剂量照射小鼠的存活率,延长存活时间,并可促进6.5Gy照射小鼠外周血WBC、NEUT、RBC和PLT的恢复。在探讨α-TOS对小鼠受照射后早期造血干/祖细胞的影响时,集落培养结果和造血祖细胞计数显示,照射对照组各系造血祖细胞数量从2h开始急剧下降,24h继续降低,说明照射对造血祖细胞早期的损伤比较严重。α-TOS组各系造血祖细胞数量2h时亦明显降低,照射后24h红系祖细胞和爆式红系祖细胞数继续降低,但降低幅度小于照射对照组,而粒-巨噬系祖细胞、巨核系祖细胞、多向系祖细胞数量则开始回升,明显高于照射对照组,提示照射后2h α-TOS没有表现出对照射小鼠造血祖细胞的保护作用,而24h则有明显保护效果。竞争性移植实验结果显示,照射后2h,来自α-TOS供体组的干细胞具有更强的重建能力,表明α-TOS保护了受照射小鼠早期骨髓干细胞的活性和功能。上述结果表明,α-TOS对受照射小鼠早期造血干/祖细胞具有明显的保护作用,进而减轻了急性放射病小鼠早期造血损伤的程度,加速外周血细胞数量的恢复,最终达到降低致死效应的目的。
在集落形成实验中,α-TOS组照射后2h部分系造血祖细胞数量明显低于照射对照组,推测可能是由于α-TOS的动员作用所致。文献报道α-TOS[7]以及另一种维生素E类化合物γ-生育三烯酚[8-9]均有动员小鼠骨髓干/祖细胞进入外周血的能力,因此,照射后2h骨髓腔中的造血祖细胞数量一过性降低可能与其被动员入血有关。另有报道认为α-TOS可诱导粒细胞集落刺激因子(G-CSF)生成,继而由G-CSF动员干细胞进入外周血[10]。但α-TOS对受辐射小鼠照后早期造血干/祖细胞的保护作用是细胞直接动员效应还是刺激细胞因子分泌产生的间接效应目前尚不明确,有待进一步深入研究。
[1]Shpall EJ. The utilization of cytokines in stem cell mobilization strategies[J]. Bone Marrow Transplan, 1999, 23(Suppl 2):S13-S22.
[2]Koenig KL, Goans RE, Hatchett RJ, et al. Medical treatment of radiological casualties: current concepts[J]. Ann Emerg Med,2005, 45(6): 643-652.
[3]Fariss W, Nicholls-Grzemski FA, Tirmenstein MA, et al.Enhanced antioxidant and cytoprotective abilities of vitamin E succinate is associated with a rapid uptake advantage in rat hepatocytes and mitochondria[J]. Free Radic Biol Med, 2001,31(4): 530-541.
[4]Carini R, Poli G, Dianzani MU, et al. Comparative evaluation of the antioxidant activity of alpha- tocopherol, alphatocopherolpolyethylene glycol 1000succinate and alphatocopherol succinate in isolated hepatocytes and liver microsomal suspensions[J]. Biochem Pharmacol, 1990, 39(10): 1597-1601.
[5]Singh VK, Brown DS, Kao TC. Tocopherol succinate: a promising radiation countermeasure[J]. Int Immunopharmacol,2009, 9(12): 1423-1430.
[6]Mao BZ, Chen JP. Base and clinic of acute radiation sickness[M].Beijing: Military Medical Science Press, 2002. 22-25.[毛秉智,陈家佩. 急性放射病基础与临床[M]. 北京: 军事医学科学出版社, 2002. 22-25.]
[7]Singh VK, Browna DS, Kao TC, et al. Preclinical development of a bridging therapy for radiation casualties[J]. Exp Hematol,2010, 38(1): 61-70.
[8]Kulkarni S, Ghosh SP, Satyamitra M, et al. Gamma-tocotrienol protects hematopoietic stem and progenitor cells in mice after total-body irradiation[J]. Radiat Res, 2010, 173(6): 738-747.
[9]Ray S, Kulkarni SS, Chakraborty K, et al. Mobilization of progenitor cells into peripheral blood by gamma-tocotrienol: a promising radiation countermeasure[J]. Int Immunopharmacol,2013, 15(3): 557-564.
[10]Singh PK, Wise SY, Ducey EJ, et al. Radioprotective efficacy of tocopherol succinate is mediated through granulocyte-colony stimulating factor[J]. Cytokine, 2011, 56(2): 411-421.
